
теория к занятию №1 аминокислоты
.docМетодические рекомендации
к лабораторным занятиям по дисциплине «Биохимия»
для студентов специальности «Биология»
Рассмотрены и рекомендованы на заседании кафедры химии
протокол №7 от 25.01.2012
Занятие №1
АМИНОКИСЛОТЫ И ПЕПТИДЫ
Цель занятия: изучить классификацию, номенклатуру, физико-химические свойства и биологическую роль аминокислот, основные биохимические реакции аминокислот.
Теоретическая часть:
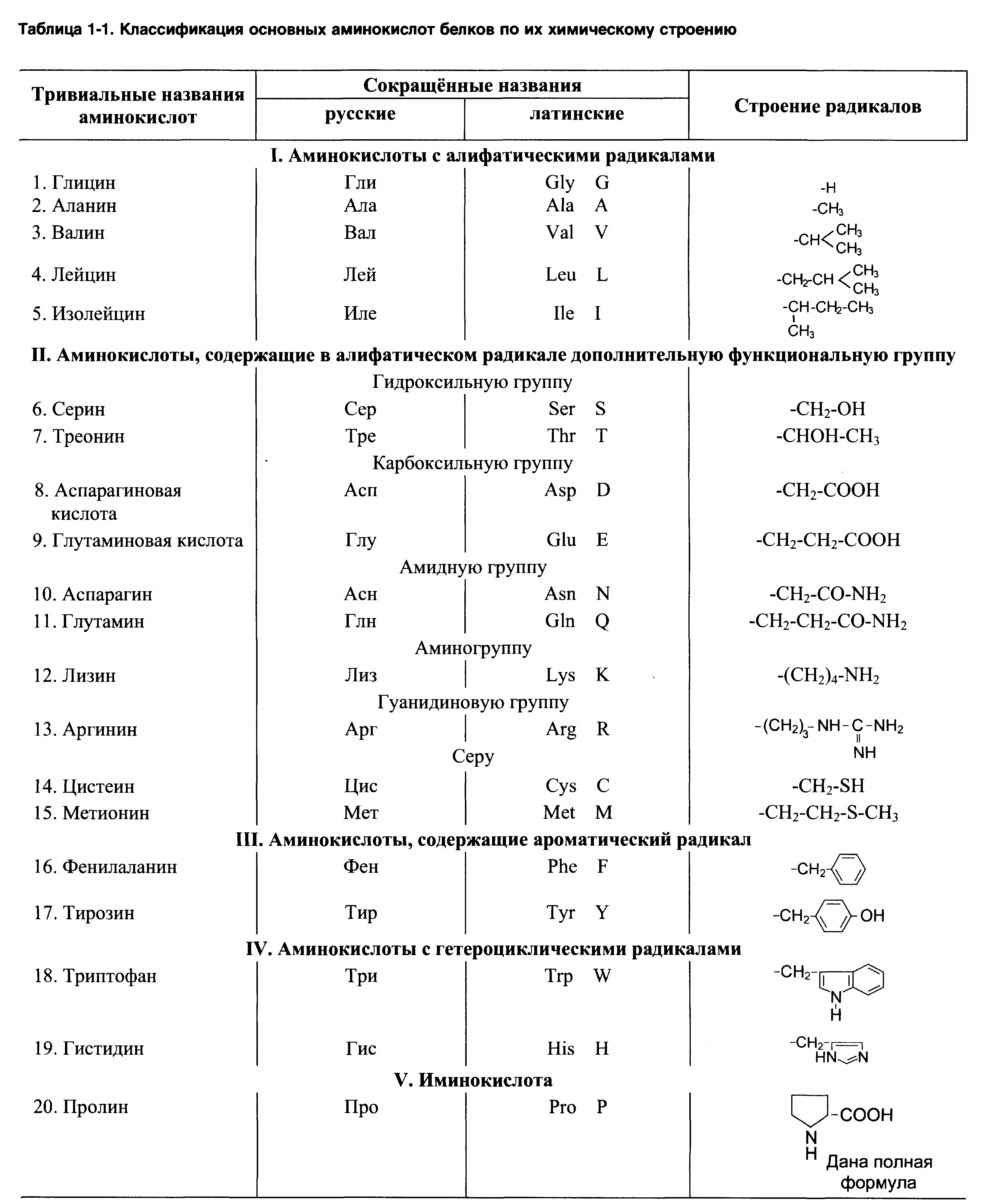
1. Какие соединения называются аминокислотами? Назвать их функциональные группы. На чем основана классификация аминокислот?
2. Привести структурные формулы наиболее часто встречающихся в живых организмах аминокислот, укажите характер их радикалов.
3. Какие виды изомерии характерны для аминокислот? Рассмотрите стереоизомерию аминокислот на примере аланина и треонина. Укажите число ассиметричных атомов, запишите возможные изомерные формы.
4. Чем обусловлены особенности свойств аминокислот: кристалличность, высокие температуры плавления, нелетучесть, которые отличают их от карбоновых кислот?
5. Запишите строение цвиттер-ионов для аминокислот валина, серина. Укажите, как изменится их заряд в сильнокислой и сильнощелочной среде.
6. Рассмотрите основные физико-химические свойства аминокислот: амфотерность, буферные свойства, изоэлектрическое состояние.
7. Как образуются ди-, три-, тетра-, ... и полипептиды и как они называются?
8. Характеристика пептидной связи.
9. Написать формулы и дать названия трипептидам, которые можно получить из следующих аминокислот: а) аланина, глицина, триптофана; б) лейцина, лизина, аланина; в) гистидина, цистеина, аргинина; г) метионина, валина, тирозина; д) фенилаланина, треонина, серина; е) аспарагина, изолейцина, метионина.
10. Основные биохимические реакции аминокислот: переаминирование, дезаминирование, декарбоксилирование и их биологическая роль.
Задания и упражнения: 1. Вычислите значения рН, для анализа, серина, глутаминовой кислоты, гистидина, исходя из величин рК аминокислот.
2. Сколько граммов NaOH нужно добавить к 500 мл гистидина (0,01 моль/л) в полностью протонированной форме, чтобы получить буфер с рН 7,0.
3. Вычислите значение рН; для глицина, лизина, треонина (табл. 1).
4. К 1 л раствора глицина (1,0 моль/л) в изоэлектрической точке добавлено 0,3 моля НС 1. Укажите рН полученного раствора.
5. К 1 л раствора глицина (1,0 моль/л) в изоэлектрической точке добавлено 0,3 моля NaOH. Укажите рН полученного раствора.
6. Раствор L-аланина (400 мл) был доведен до рН 8,0. Затем в этот раствор был добавлен избыток формальдегида. Для обратного титрования полученного раствора до рН 8,0 потребовалось 250 мл NaOH (0,2 моль/л). Сколько граммов L-аланина содержалось в исходном растворе?
7. Укажите суммарный заряд для глицина, аспарагиновой кислоты, лизина и гистидина при следующих рН: а) 1,0; б) 2,1; в) 4,0; г) 10 (—, 0 или +), исходя из данных табл. 1.
8. Укажите суммарный заряд для аланина, цистеина, глутаминовой кислоты, глицина при следующих рН: а) 1,0; б) 2,5; в) 4,2; г) 10 (—, 0 или +), исходя из данных табл. 1.
9. Укажите суммарный заряд (+, 0 или —) для лейцина, треонина, цистеина и лизина при следующих рН: а) 1,5; б) 6,0; в) 8,5; г) 11, исходя из данных табл. 1.
10. Вычислите значение рН (для лейцина, триптофана, аспарагиновой кислоты и аргинина, исходя из величин рК аминокислот (табл. 1)).
11. Смесь глицина, аланина, глутаминовой кислоты, лизина, аргинина и серина разделяли методом электрофореза на бумаге при рН 6,0. Укажите, какие соединения двигались к аноду — А (а), к катоду — К (б), оставались на старте — С (в).
12. Каково направление движения пептидов (остаются на старте, движутся к аноду или катоду) в процессе электрофореза при рН 2,0; 3,5; 6,5; 10: а) лиз-гли-ала-глу; б) глу-гли-ала-глу; в) гли-гли-ала-лиз?
13. Укажите направление движения пептида лиз-гли-ала-гли в процессе электрофореза на бумаге при рН 1,9; 3,0; 6,5; 10,0.
14. Укажите направление движения пептида гис-гли-ала-глу в процессе электрофореза на бумаге при рН 1,9; 3,0; 6,5; 10,0.
15. Укажите направление движения пептида арг-вал-ала-асп в процессе электрофореза на бумаге при рН 1,9; 3,0; 6,5; 10,0.
16. Укажите, каким образом действует отдельно трипсин (а) и пепсин (б) на пептид лиз-ала-гли-асп-ала-глу-сер-арг-гли.
17. Укажите, каким образом действует трипсин (а) и химотрипсин (б) на следующий пептид: тир-цис-лиз-ала-арг-арг-гли.
18. Укажите, каким образом действует трипсин (а) и пепсин (б) на следующий пептид: ала-фен-лиз-ала-глу-гли.
19. Какие пептиды образуются при обработке трипсином полипептида еал-лиз-глу-глу-фен-мет-арг-цис-глу-три-мет-гли?
20. Какие пептиды образуются при обработке химотрипсином полипептида ала-вал-лиз-глу-глу-фен-вал-мет-тир-цис-глу-три-мет-ели-глц-фен?
Образование пептидов и их номенклатура

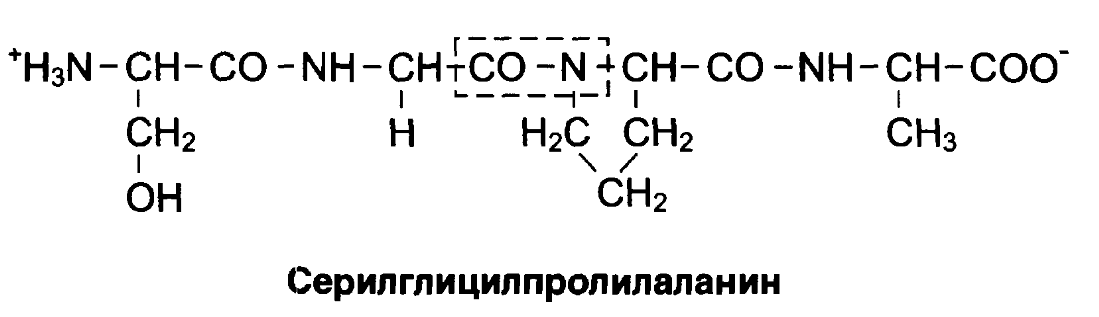
Схема В. Номенклатура пептидов
При написании формул пептидов необходимо:
-
выделять пептидные связи,
-
указывать N- и С-концы пептида,
-
уметь строить полное и краткое название пептида
-
указывать характер среды в водном растворе данного пептида.
Расчет изоэлектрической точки моноаминомонокарбоновых кислот осуществляется по формуле:
рI = (pKcoo- + pKNH3+) / 2
Значения pK карбоксильной и аминогруппы, а также дополнительных ионогенных групп, содержащихся в радикале, представлены в таблице 1.2
Таблица 1.2 Величины рК ионизированных групп некоторых аминокислот (250С)
|
Аминокислота |
рК1, α-СООН |
рК2,
α-NH |
рК3, R-группа |
|
Аланин |
2,34 |
9,69 |
– |
|
Аргинин |
2,17 |
9,04 |
12,48 (гуанидин) |
|
Аспарагин |
2,02 |
8,80 |
– |
|
Аспарагиновая кислота |
2,09 |
9,82
(NH |
3,86 (СООН) |
|
Валин |
2,32 |
9,62 |
– |
|
Гистидин |
1,82 |
9,17
(NH |
6,0 (имидазол) |
|
Глицин |
2,34 |
9,60 |
– |
|
Глутамин |
2,17 |
9,13 |
– |
|
Глутаминовая кислота |
2,19 |
9,67
(NH |
4,25 (СООН) |
|
Изолейцин |
2,36 |
9,68 |
– |
|
Лейцин |
2,36 |
9,60 |
– |
|
Лизин |
2,18 |
8,95 |
10,53
(ε-
NH |
|
Метионин |
2,28 |
9,21 |
– |
|
Оксипролин |
1,92 |
9,73 |
– |
|
Пролин |
1,99 |
10,96 |
– |
|
Серин |
2,21 |
9,15 |
– |
|
Тирозин |
2,20 |
9,11 |
10,07 (ОН) |
|
Треонин |
2,71 |
9,62 |
– |
|
Триптофан |
2,38 |
9,39 |
– |
|
Цистеин |
1,71 |
8,33 |
10,28 (SH) |
Пример 1: рассчитайте значение ИЭТ аминокислоты аланина.
Используя данные таблицы 1.2 находим, что значения pKcoo- и pKNH3+ составляют соответственно 2,34 и 9,69
Отсюда рIаланина = (pKcoo- + pKNH3+) / 2 = (2,34+9,69) / 2= 6,21
Пример 2: рассчитайте суммарный заряд аланина при рН равном 1,5 7,0 и 11,0. Определите направление перемещения аминокислоты под действием электрического поля в указанных условиях.
При значении рН<< рI аминокислоты превращаются в катион, имеют положительный заряд и под действием электрического поля перемещаются в сторону катода.
При значении рН>> рI аминокислоты превращаются в анион, имеют отрицательный заряд и под действием электрического поля перемещаются в сторону анода.
Следовательно, при рН 1,5 аланин является катионом и под действием электрического поля перемещаются в сторону катода. При рН 7,0, близком к значению рI данной аминокислоты, суммарный заряд равен 0. Аминокислота электрофоретически неподвижна. При рН 11,0 аланин является анионом и под действием электрического поля перемещаются в сторону анода.

В случае аминокислот, имеющих дополнительные ионогенные группы в радикале, для расчета суммарного заряда молекулы при данных условиях, значения рК каждой ионогенной группы сопоставляются со значением рН раствора:
- для групп, диссоциирующих по кислотному типу, диссоциацией практически пренебрегают, если рН < рК
- для групп, диссоциирующих по основному типу, диссоциацией практически пренебрегают, если рН > рК

