
- •Глава 14. Механизмы реактивности и проблемы сохранения здоровья
- •14.1. Общие механизмы неспецифических приспособительных реакций организма
- •14.2. Психофизиологические аспекты резистентности организма
- •Акцентуации характера
- •Типы акцентуированной личности (взрослые) по к. Леонгарду (1976)
- •Диагностика психологического стресса, помощь при остром стрессе
Глава 14. Механизмы реактивности и проблемы сохранения здоровья
14.1. Общие механизмы неспецифических приспособительных реакций организма
Современные подходы к вопросам укрепления здоровья и профилактики заболеваний базируются на глубоком понимании физиологических процессов, протекающих в организме.
Динамика здоровья человека находится в прямой связи с качественными и количественными изменениями внешнесредовых влияний, вызывающих ту или иную степень отклонения функций. Свойство организма как целого отвечать изменениями жизнедеятельности на воздействия окружающей среды характеризует его реактивность. А устойчивость - резистентность - к дестабилизирующим факторам окружающей среды определяет меру здоровья индивидуума.
Степень резистентности организма в значительной мере зависит от состояния его регуляторных систем и эффекторов на всех уровнях - от клеточного (ауто-паракринные механизмы регуляции) до системного (нейро-эндокринные механизмы регуляции). В связи с этим, анализ механизмов формирования здоровья предполагает исследование роли клеточных и системных механизмов регуляции в динамике приспособительных реакций, развивающихся в ответ на действие сильных и сверхсильных раздражителей.
Повышение эффективности в работе функциональных систем организма достигается благодаря совершенствованию межсистемных регуляторно-функциональных связей, в то время как явления дизрегуляции на любом уровне повышают риск развития патологии и составляют ее основу.
В современной физиологии, как и в клинической медицине, вопросам ауторегуляции функций в организме уделяется все больше внимания. Так, известный российский клиницист профессор А.П. Зильбер в «Этюдах критической медицины» (1997) пишет: « Медицина, как и все общество, идет по глубокой колее, и попытка выбраться из нее без гармоничного развития фундаментальных наук – биологии, биофизики, биохимии и других - обречена на неуспех. Однако в будущем, возможно и не столь отдаленном, осуществится постепенный переход в новую медицину, главным принципом которой будет неинвазивное восстановление ауторегуляции функций организма».
Человеческий организм представляет собой сложную саморегулирующуюся систему, существующую в единстве с окружающей ее средой. Известны и наиболее общие проявления приспособительных реакций в ответ на действие разнообразных внешних раздражителей. Еще в 1936 году Ганс Селье писал: «... когда живой организм сталкивается с агентом или ситуацией, которые влияют на него прямо (физически) или через интерпретацию (психологически), ... тело реагирует преимущественно стереотипно, т.е. идентичными биохимическим и физическими изменениями, в основном направленными на преодоление этих требований».
В качестве одного из наиболее универсальных механизмов неспецифической резистентности известен общий адаптационный синдром, описанный Г. Селье как стресс.
Физиологический стресс (от англ. stress - напряжение) – это реакция всего организма, охватывающая комплекс неспецифических изменений адаптивного характера, проявляющихся на вегетативном, гуморальном, биохимическом, а также поведенческом и психическом уровнях, и направленная на защиту от негативных последствий раздражителей (стрессоров) физической или психосоциальной природы.
В зависимости от продолжительности воздействия раздражителя стресс может быть острый и хронический. В том случае, когда ресурсы защиты от повреждающего фактора оказываются недостаточны, в организме происходят процессы, связанные с ущербом, с ослаблением компенсаторных возможностей и, как следствие, с развитием предболезненного и даже болезненного состояния. Такой чрезвычайный стресс называют дистрессом, или патологическим стрессом.
В роли физических стрессоров выступают такие факторы, как температурные, механические, химические, электромагнитные раздражители, значительно превышающие пороговые значения. При этом, в соответствии с правилом исходного уровня, раздражители одной и той же силы в зависимости от исходного физиологического состояния организма в целом, его клеток, тканей, органов и систем могут выступать в одних случаях как допороговые, а в других – как пороговые или сверхпороговые, оказывающие стрессирующее влияние.
Физическими стрессорами для человека могут также являться значительные суточные колебания напряженности геомагнитного поля, атмосферного давления, парциальной плотности кислорода в атмосфере, воздействие ионизирующей радиации, и др.
Психологический стресс (эмоциональный, информационный) могут вызвать соответственно неудовлетворенные биологические или социальные потребности, а также информационные перегрузки.
Существенная роль в развитии психологического стресса принадлежит второй сигнальной системе. Так для человека в роли стрессора может выступить слово, а порой даже просто интонация, с которой оно произносится.
Специалисты в области поведенческой медицины говорят об упреждающей роли психологического стресса. Особенно важно знание этого при работе с личностями, характеризующимися такими особенностями протекания психических процессов, как эмоциональная неустойчивость, повышенная тревожность и т.п. Поэтому диагностика психофизиологических особенностей человека, его личностных характеристик представляет собой важный аспект в профилактике развития дистресса (патологического стресса).
В эволюционном аспекте стресс-реакция, или общий адаптационный синдром, развивалась как биологическая реакция защиты, включающая стресс-реализующие и стресс-лимитирующие механизмы, направленные на сохранение гомеостаза и оптимизацию функций организма.
Стресс-реализующие механизмы общего адаптационного синдрома
Стресс-реакция включает три стадии: тревоги, резистентности и истощения.
Стадия тревоги (испуг, борьба, бегство - fright, fight, flight) заключается в экстренной мобилизации энергетических ресурсов организма за счет симпато-адреналовой активации и приведении его в состояние повышенной готовности. Она сопровождается формированием эмоциональной окраски происходящего (страх, ужас, гнев, агрессия). Продолжительность этой стадии - 6 - 48 часов.
Длительность первой фазы («испуга») стадии тревоги непродолжительна – секунды, иногда минуты. Однако за это время, в результате возникшей «вегетативной бури», характеризующейся значительным повышением симпатического тонуса, происходят существенные изменения в системах энергообеспечения: активация дыхания, кровообращения (повышение давления, перераспределение кровотока к мышцам, сердцу, мозгу и другим жизненно важным органам).
Вслед за кратковременной фазой «испуга» в стадию тревоги продолжает разворачиваться цепь событий, направленных на дальнейшую мобилизацию энергетических ресурсов, необходимых для обеспечения фаз «борьбы» и (или) «бегства». Происходит усиление метаболизма с преобладанием реакций катаболического ряда: в крови повышается уровень метаболических субстратов, таких, как глюкоза, свободные жирные кислоты, лактат.
В зависимости от преобладания адреналовой и норадреналовой активности конечные биологические эффекты на уровне поведенческих реакций и реакций тканей-мишеней могут различаться. Так, адреналин, как гормон мозгового вещества надпочечников, именуемый иногда гормоном тревоги или «гормоном кролика», дает более выраженную реакцию испуга, страха, ужаса. По некоторым данным, лица с преобладанием эффектов этого гормона хуже переносят стрессовые ситуации, в то время как в условиях спокойной повседневной деятельности они более продуктивны.
Преобладание норадреналового типа реактивности обеспечивает при стрессе поведенческие реакции борьбы. Недаром его называют также «гормоном льва». По мнению исследователей в области спортивной медицины эти лица лучше переносят состояния выраженного физического напряжения. Они обладают большей выносливостью и показывают более высокие спортивные результаты. Избыточная же продукция адреналина перед соревнованиями считается отрицательным прогностическим признаком.
Какой будет реакция конкретного индивидуума в ответ на действие раздражителей, зависит от его индивидуальных особенностей и исходного состояния.
В случае, когда стрессор продолжает действовать, а произошедших в первую фазу стресса изменений оказывается недостаточно для компенсации его дестабилизирующего воздействия, и при этом организм располагает необходимыми ресурсами компенсации, начинается следующая стадия – резистентности.
Стадия резистентности – это стадия развития повышенной устойчивости к действию данного стрессора и, что особенно важно, повышение устойчивости к множеству других раздражителей (перекрестная адаптация).
В качестве примера можно указать на факты снижения заболеваемости острыми респираторно-вирусными инфекциями у студентов в период сессии, при выполнении человеком важной для него срочной работы и т.д.
В стадию резистентности активируются такие стресс-реализующие системы, как гипоталамо-гипофизарно-надпочечниковая и гипоталамо-гипофизарно-тиреоидная.
Особое значение в реактивности организма принадлежит гипоталамо-гипофизарно-надпочечниковой оси, активируемой норадреналином адренергических нейронов коры, лимбической системы и ретикулярной формации.
Общая схема активации этой оси представлена на рисунке 14.1. Стрессоры опосредованно через органы чувств активируют норадренергические нейроны мозга. Выделяющийся при этом норадреналин, как нейротрансмиттер стимулирует выработку кортиколиберина и антидиуретического гормона (АДГ) в гипоталамусе. Кортиколиберин инициирует синтез АКТГ в гипофизе, под влиянием которого кора надпочечников начинает интенсивно секретировать в кровь кортизол, а мозговое вещество – катехоламины: адреналин и норадреналин. Физиологические реакции, развивающиеся при этом, направлены на дальнейшую мобилизацию энергетических ресурсов организма.
Поведенческие проявления активации адренергической стимуляции мозга характеризуются общим повышением возбудимости организма (доходящим в крайнем своем выражении до бессонницы), агрессивностью и развитием оборонительных реакций.
Вместе с тем кортиколиберин, воздействуя на другие гипоталамические нейроны, угнетает синтез рилизинг-факторов соматотропного гормона и гонадотропинов. Все это в совокупности с усиленной продукцией кортизола блокирует сексуальную активность у представителей обоего пола, а в женском организме, кроме того, тормозит процессы роста и овуляции яйцеклеток в яичниках (ановуляторные циклы у девушек и женщин).
 Стрессоры
Стрессоры
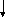


 Стрессирующие
сигналы цитокины
Стрессирующие
сигналы цитокины




Кора, лимбическая система,
ретикулярная формация



Н А-ергические
КЛ-ергические
КЛ-ергические НА-ергические
А-ергические
КЛ-ергические
КЛ-ергические НА-ергические
н

 ейроны
нейроны нейроны
нейроны гипоталамус
ейроны
нейроны нейроны
нейроны гипоталамус





 кортизол гипофиз
кортизол гипофиз

 АКТГ спинной
АКТГ спинной
мозг

кора мозговое в-во кортизол адреналин надпочечники








возбуждение, пищевое рост
поведенческая и половое и репродук-
активность, поведение тивная функция
агрессивность
Мобилизация
энергии, повышение
сердечно-сосудистой
активности

Местное висцеральные
повреждение иммунный функции
 воспалительный
воспалительный

 эффект
цитокины
эффект
цитокины
 стимуляция
стимуляция
 угнетение
угнетение
Рис. 14.1. Механизмы интегративного ответа при стрессе
Примечание: НА- норадреналин, КЛ- кортиколиберин, АКТГ – адренокортикотропный гормон
Кроме того, кортиколиберин угнетает аппетит и пищевое поведение, которые неактуальны в условиях существования немедленной угрозы организму при стрессе. Крайние проявления этой поведенческой реакции наблюдаются в виде неврогенной анорексии; для коррекции ее используются методы поведенческой медицины (в том числе психотерапевтические воздействия).
Один из промежуточных продуктов синтеза АКГТ – проопиомеланокортид-пептид вызывает анальгезию, а по механизму обратной связи блокирует усиление стресс-индуцированной секреции кортиколиберина и норадреналина.
Общие метаболические аспекты стадии резистентности при стрессе проявляются рядом взаимосвязанных реакций. В то время как катехоламины вызывают быструю активацию гликогенолиза (и, следовательно, гипергликемическую реакцию в плазме), глюкокортикоиды демонстрируют более медленные эффекты, обеспечивая механизмы доставки аминокислотных субстратов в ткани для осуществления процессов глюконеогенеза. В физиологических дозах глюкокортикоиды вызывают такие конечные биологические эффекты на уровне органов и тканей-мишеней, как мобилизация энергетических ресурсов за счет процессов глюконеогенеза и липолиза. Под действием кортизола происходит усиление катаболических процессов в неактуальных для жизнеобеспечения при стрессе тканях (например, в коже). В этих условиях катехоламины и глюкокортикоиды «смещают» метаболизм глюкозы в ЦНС, для нейронов которой данный моносахарид является основным источником энергии, и «удаляют» ее из периферических тканей. Синергизм действия рассматриваемых гормонов проявляется и в том, что адреналин обеспечивает быстрое поступление свободных жирных кислот к сердечной мышце, а кортизол облегчает этот метаболический эффект путем активации липазы и, следовательно, повышает в крови уровень соответствующих метаболитов. Совместно катехоламины и глюкокортикоиды повышают артериальное давление и сердечный выброс, улучшают доставку субстратов к тканям, обеспечивая, таким образом, жизненно важные функции.
Увеличивается при стрессе и синтез альдостерона корой надпочечников. Следующая за этим альдостерон обусловленная задержка натрия и воды является своего рода упреждающим механизмом защиты организма от возможной большой кровопотери в случае травматического повреждения тканей. Включение этого механизма, кроме того, вызывает спазм мелких сосудов и дальнейшее повышение артериального давления, что необходимо для обеспечения перераспределительных и защитных реакций системы кровообращения.
Активация синтеза гормона роста (СТГ) и тиреоидной оси (кора - гипоталамус - гипофиз - щитовидная железа), усиливая реакции катаболического ряда, значительно увеличивает энергообразование. Высокие уровни тиреоидных гормонов (Т3 и Т4) ведут к разобщению окисления и фосфорилирования в клетках. Это, с одной стороны повышает теплопродукцию, а с другой - снижает энергетический потенциал тканей. Формируются предпосылки клеточного гипоэргоза. Поэтому подобный механизм получения энергии не может использоваться организмом в течение продолжительного времени как малоэкономичный.
Уравновешивание ката- и анаболических процессов при стрессе обеспечивается снижением уровня СТГ и тиреоидных гормонов в условиях сохраняющейся повышенной продукции глюкокортикоидов надпочечниками.
Современные представления о взаимоотношениях в системе стрессор - иммунная реактивность – эндокринная система кратко можно представить в виде ряда последовательных взаимосвязанных и взаимообусловленных реакций. Так, локальное повреждение ткани при стрессе включает неспецифический иммунный ответ в виде продукции иммунными клетками разнообразных цитокинов. Эти «гормоны» иммунной системы стимулируют клеточную и гуморальную защиту, отражая, нейтрализуя или удаляя опасные микроорганизмы (или собственные поврежденные клетки) и чужеродные вещества. Однако, критическое возрастание в плазме таких цитокинов, как ИЛ-1, ИЛ-6, TNF, является стимулом к выделению гипоталамусом кортиколиберина, ведущего в конечном итоге к повышению уровня плазменного кортизола, угнетающего, в свою очередь, указанные выше цитокины. Таким образом, цитокины стимулируют центральные ответы, а кортизол ингибирует избыточную их продукцию.
Цитокины- это низкомолекулярные клеточные регуляторные медиаторы, обладающие пара-, аутокринным и эндокринным эффектами. Они синтезируются различными клетками: эндотелием сосудов, клетками крови, фибробластами и др. Конечные эффекты цитокинов реализуются опосредованно через клеточные рецепторы, что обусловливает их тканевую специфичность.
Выделяют три группы цитокинов по их функциональному значению (Barton E., e.a., 1998):
Иммунорегуляторные цитокины: интерлейкины – ИЛ-2, ИЛ-3; трансформирующий фактор роста бета – transforming growth factor beta - TGF.
Провоспалительные цитокины: ИЛ-1; ИЛ-6; хемокиновое семейство воспалительных цитокинов, включая ИЛ-8, белки хемотаксиса моноцитов – monocyte chemotactice protein – MCP-1, MCP-2, MCP-3; воспалительный белок макрофагов – macrophage inflammatory protein – MIP -1, MIP-1; регулятор-активатор нормальной Т–экспрессии и секреции – regulation-upon-activaqtion, normal T expressed and secreted –RANTES; фактор некроза опухоли альфа– tumor necrosis factor alpha-TNF.
Регуляторы роста и дифференциации лимфоцитов и моноцитов: ИЛ-3, ИЛ-7, гранулоцитарно макрофагальный колониестимулирующий фактор – granulocyte-macrophage colony stimulation factor – GM-CSF.
Цитокины реализуют свои эффекты, влияя на гены и как результат, участвуя в росте, дифференцировке клеток, их функциональной активности. В этом смысле цитокины играют ключевую роль как в механизмах неспецифических защитных реакций организма, в частности в иммунном ответе, так и в развитии многих патологических процессов. При этом существуют общие закономерности в проявлении цитокиновых эффектов.
Активация одного цитокина обязательно запускает цепь других цитокинов (каскадный эффект), что обеспечивает широкий спектр неспецифических защитных реакций.
Конечный эффект цитокинового каскада определяется исходным состоянием клеток-продуцентов и клеток-мишеней.
Каждый цитокин вызывает ряд эффектов в организме (множественность физиологических эффектов), что значительно повышает надежность неспецифической реактивности.
Следует помнить, что избыточная продукция цитокинов может привести к повреждающему эффекту не только на регулируемых тканях, но даже и на самой клетке, продуценте цитокина.
Понимание механизмов многочисленных цитокиновых эффектов в целостном организме облегчается знанием происхождения и функциональной роли цитокинов. Рассмотрим наиболее хорошо изученные из них.
Интерлейкины (ИЛ-1 – ИЛ-13). Это группа веществ, изначально ориентированная на обеспечение передачи информации с лейкоцита на лейкоцит. Повышение их синтеза наблюдается в ответ на повреждение тканей, воздействия вирусов или бактерий. Их основные эффекты связаны с развертыванием воспалительной реакции в организме.
Фактор некроза опухоли (Tumor necrosis factor -TNF). Синтезируется фибробластами, эндотелием, купферовскими клетками печени и другими клетками ретикулоэндотелиальной системы. Его исходная функция – защита организма от чужеродного антигена (бактерии, опухолевые клетки). Однако при стрессовых состоянияхTNF, кооперируясь с другими цитокинами, участвует в огромном количестве реакций. Его основные эффекты могут быть суммированы в виде следующих проявлений:
стимуляция эндотелия и макрофагов на выделение «патологического» оксида азота (NO), вызывающего стойкую вазодилатацию, усиливаемую интерлейкином-1, синтез которого, в свою очередь, инициируетсяTNF,
увеличение адгезии нейтрофилов к сосудистой стенке и облегчение их дальнейшей миграции в ткани при воспалении,
метаболические и структурные повреждения эндотелия,
увеличение проницаемости различных мембран,
стимуляция образования эйкосаноидов.
Даже непродолжительного действия избыточного TNFдостаточно для инициации полиорганной недостаточности. Патологические эффекты TNFпредупреждает его рецепторный конкурент - IL-1.
Интерфероны (IFN). Эту группу веществ начинают продуцировать пораженные клетки, чтобы уничтожить проникшие в них вирусы (ограничивая их размножение). Наряду с этим интерфероны, синтезируемые в избыточном количестве, стимулируют образование других цитокинов эндотелием сосудов, тем самым, запуская реакции организма при полиорганной недостаточности.
Фибронектин. Исходное назначение этого белка заключается в подготовке к уничтожению иммунореактивной системой инородных и собственных поврежденных клеточных структур. Он вызывает склеивание клеток между собой, а также адгезию подлежащего уничтожению материала к макрофагам, эндотелию и другим клеткам.
Трансформирующий фактор роста – TGF (,). TGR регулирует продукцию других цитокинов (ИЛ-1, ИЛ-6), синтезируемых Т-клетками.TGF регулирует экспрессию многих онкогенов, угнетает лимфоцитарный ответ на другие цитокины, ингибирует (?) пролиферацию эпидермальных клеток вилочковой железы. Синтезируясь многочисленными клетками,TGFстимулирует их рост.
Хемотаксические факторы (хемокины) – обеспечивают адгезию и агрегацию клеток.
Эйкосаноиды – вещества, являющиеся продуктами распада арахидоновой кислоты, входящей в состав липидов. По циклооксигеназному пути из нее образуются простациклины и тромбоксаны, по липооксигеназному - лейкотриены, по монооксидазному - эпоксиды и др. Совокупное действие эйкосаноидов может быть представлено следующими эффектами: повышение проницаемости клеточных мембран, бронхоконстрикция, воспалительная реакция, микротромбозы.
Цитокины, в нормальных условиях обеспечивают такие защитные реакции организма на клеточном уровне, как модуляция метаболизма с увеличением продукции энергии, защитная гипертермия, стимуляция регенерации. Однако при определенных условиях их избыточная продукция может выступить в роли мощного деструктивного фактора, ведущего к развитию синдрома полиорганной недостаточности (СПОН).
Установлено, что физиологически целесообразные реакции ауторегуляции, осуществляемые цитокинами, принимают уродливые патологические черты, ведущие к полиорганной недостаточности при избыточной продукции цитокинов в условиях гипоэргоза.
Стадия резистентности – это обратимая стадия. Если действие стрессора прекращается, организм постепенно возвращается к исходному уровню функционирования. Однако нередко продолжающаяся стрессорная стимуляция вынуждает центральные и периферические стресс-реализующие системы, а следом и висцеральные системы поддержания гомеостаза работать на пределе своих функциональных возможностей длительное время. В этом случае велик риск трансформации стадии резистентности в стадию истощения.
Стадия истощения – это, по сути конечный, негативный, исход стресса. В организме развиваются реакции повреждения. Наступающая атрофия коры надпочечников влечет растормаживание механизмов, блокирующих синтез гормона роста (СТГ) и тиреоидных гормонов. Развивающееся вслед за этим резкое увеличение продукции гормонов катаболического ряда (СТГ, ТТГ, Т3, Т4) вызывает опустошение энергетических ресурсов (гипоэргоз тканей). Вновь включаются механизмы стадии тревоги. Однако в истощенном организме уже нет ресурсов, которые могли бы быть мобилизованы, - наступает его гибель.
Своеобразной клинической моделью стадии истощения компенсаторных механизмов с развитием деструктивных процессов может служить синдром полиорганной недостаточности, наблюдаемый у терминальных больных. Он представляет собой те неспецифические реакции, которые сопровождают процессы танатогенеза. В тканях, находящихся в состоянии гипоэргоза, запускается механизм активации так называемого цитокинового каскада. Развивается гиперцитокинемия. В этих условиях включаются необычные пути продукции и действия цитокинов. Наблюдаются избыточное увеличение энергопродукции по типу «самосжигания» организма, гипервоспаление с явлениями капиллярной утечки жидкости и, как следствие, - интерстициальным отеком, трансформация физиологической регенерации в деструкцию тканей.
Узловыми элементами в развивающихся процессах цитокиновой гиперреактивности являются эндотелиальные клетки и тканевые макрофаги, повсеместное присутствие которых обусловливает полиорганной характер развивающихся нарушений. Соответственно в их формировании важная роль принадлежит эндотелию как к органу, имеющему в целостном организме свои специфические и весьма разнообразные функции:
регуляция просвета сосудов путем выработки сосудосуживающих и сосудорасширяющих факторов (органная регуляция кровотока в соответствии с его метаболическим потребностями),
регуляция активной проницаемости сосудистой стенки для пассажа жидкости и содержащихся в ней веществ из кровотока в ткани и обратно,
участие в процессах гемокоагуляции (через свертывающую, противосвертывающую и фибринолитическую функции),
участие в процессах атерогенеза,
участие в процессах адгезии, агрегации и трансформации клеток крови,
участие в иммунореактивных процессах, в том числе - воспалительной реакции, анафилаксии и других проявлениях гипериммунного ответа,
а также участие в индукции и распространении процессов канцерогенеза.
Перечисленные функции эндотелия опосредуются через секрецию им множества биологически активных веществ (БАВ), а также способность вследствие наличия специфических рецепторов воспринимать химические сигналы других секреторных клеток. Среди указанных факторов важная роль принадлежит оксиду азота – NO.
Оксид азота образуется в эндотелии под влиянием многих медиаторов и через систему гуанилатциклазы расслабляет гладкомышечные клетки сосудов.
В критических ситуациях NO секретируется макрофагами и вызывает при этом патологическое расширение сосудов, принципиально отличающееся от ауторегуляции кровотока.
Существует три пути образования NO с участием трех ферментов: NOS-I, NOS-II, NOS-III. Под влиянием NO-синтетазы (NOS-1 в эндотелии, NOS-III в нейронах) реализуются кальций зависимые пути, обеспечивающие процессы ауторегуляции сосудов малыми дозами оксида азота. Другие цитокины (например,TNFa) активируют NOS–II, запуская кальций независимый путь с образованием больших дозNO, направленных на обеспечение иммунной защиты организма, однако при этом резко падает сосудистый тонус (ситуация трудно корригируемой вазодилатации).
Рассмотренные выше механизмы резистентности организма и ауторегуляции на клеточном и тканевом уровне позволяют объяснить и процессы измененной функциональной активности (гиперфункции) на органном уровне как неспецифические проявления реактивности, ведущие к формированию так называемых переходных, или предболезненных (донозологических) состояний.
Стресс-лимитирующие механизмы общего адаптационного синдрома
Как уже говорилось, эволюция становления стресс-реакции сопровождалась формированием наряду со стресс-реализующими системами и ограничительных механизмов последствий гиперреактивности организма. К таким механизмам относят реакции, осуществляемые стресс-лимитирующими системами. На предотвращение чрезмерной гиперактивации, граничащей с патологией, направлена активация ГАМК-эргической системы, опиоидной системы, антиоксидантной системы, парасимптаического отдела вегетативной нервной системы (трофотропные механизмы).
ГАМК-эргическая система представлена гамма аминомасляной кислотой, которая в процессе ферментирования превращается в гамма оксимасляную кислоту (ГОМК), играющую роль тормозного медиатора в ЦНС. В силу этих ее свойств ГОМК может локализовать процессы возбуждения, развивающиеся при стрессе и таким образом предупредить или значительно снизить степень его негативных последствий.
Эндогенные опиаты, синтез которых происходит в нейронах ЦНС, в том числе в гипоталамусе и далее в гипофизе параллельно с синтезом АКТГ (-эндорфины), вызывают ряд эффектов. Так, благодаря им происходит ограничение развития негативных эмоциональных реакций (например, ярости, злобы, а следовательно и агрессивности). В норме эти поведенческие пептиды ответственны за формирование положительных эмоций (фактор подкрепления). Они обладают также антиноцицептивным эффектом. Их свойства нейромодуляторов лежат в основе повышения работоспособности и, следовательно, возможности выполнять длительную физическую работу. Хорошо известны модулирующие эффекты опиоидных пептидов на уровне вегетативной нервной системы (ВНС), предупреждающие развитие гиперсимпатикотоний.
Имеются индивидуальные особенности синтеза поведенческих пептидов типа эндогенных опиатов. Так, известно, что некоторые люди характеризуется более низкой чувствительностью к боли, они менее раздражительны и отличаются преобладанием положительного эмоционального настроя. Они же, как правило, менее склонны к формированию химической зависимости (алкоголизм, наркомания, табакокурение), а при наличии вредных привычек без особого напряжения могут бросить курить, имея в анамнезе достаточно большой стаж курильщика. Очевидно, высокий уровень эндорфинов у таких лиц обеспечивает и их высокую естественную резистентность.
Другим компонентом стресс-лимитирующей системы являются антиоксиданты- вещества, предупреждающие негативные последствия воздействия на клетки свободных радикалов (СР), обладающих высокой реагеноспособностью и в больших количествах образующихся в условиях стресс-обусловленного гиперметаболизма.
Последствия атаки клеток свободными радикалами проявляются токсическими эффектами, такими, как деградация белков клеточной мембраны, повреждение радикалами мембранного бислоя липидов, повреждение ядерной ДНК, активация внутриклеточных ферментов.
Антиоксиданты. В организме существует сложная система контроля механизмов свободнорадикального окисления. Она включает контроль за продукцией свободных радикалов, процессы ограничения цепной реакции свободнорадикального окисления, а также «ремонт» вызванных радикалами повреждений. В соответствии с этими функция выделяют группы антиоксидантов по механизму их действия:
первичные антиоксиданты, предупреждающие образование СР,
вторичные антиоксиданты, ограничивающие цепные реакции образования новых СР,
третичные антиоксиданты,ремонтирующие поврежденные биомолекулы.
К естественным антиоксидантам организма относятся белки: церулоплазмин, металлотионин, альбумин, трансферрин, ферритин, миоглобин, а также такие ферменты, как супероксидисмутаза, глютатионпероксидаза, глютатионредуктаза, каталаза, металлоэнзимы. Роль факторов защиты клеток от повреждающего действия СР выполняют малые молекулы типа глютатиона, аскорбиновой кислоты (витамин С), альфа-токоферола (витамин Е), билирубина, мочевой кислоты, бета-каротинов и флавоноидов. В качестве актиоксидантов, восстанавливающих поврежденные молекулы и структуры клеток, выступают ДНК-восстанавливающие ферменты и метионин сульфоксид редуктаза.
Трофотропные механизмы защиты от негативных проявлений стресс-реакции связанны с активацией парасимпатической нервной системы. Так, если сама стресс-реакция сопровождается активацией симпатического отдела вегетативной нервной системы, то парасимпатический отдел ВНС компенсаторно снижает степень негативных проявлений этой реакции.
Факторы риска развития нарушений в процессе реализации неспецифических защитных механизмов
Рассмотренные выше механизмы развития общего адаптационного синдрома направлены на оптимизацию функций организма в условиях дестабилизирующего влияния факторов внешней среды – стрессоров. У лиц с низкой резистентностью при этом возможно развитие нарушений от предболезненных состояний до самой болезни.
Система кровообращения. Гиперкатехоламинемия, которая сопровождает все стадии общего адаптационного синдрома, может провоцировать развитие нарушений кровообращения у лиц с низким уровнем резистентности. К группе риска при этом следует отнести тех, кто имеет наклонность к сосудистым спазмам, повышенную адренергическая чувствительность тканей, особенно на фоне гипертиреоза, повышенную тревожность, слабый тип ВНД, патологию сердечно-сосудистой системы.
Гиперлипидемию, развивающуюся при повышении активности коры надпочечников (физиологический гиперкортицизм) и направленную на повышение энергообеспечения организма, в сочетании артериальной гипертензией, особенно на фоне гипокинезии следует расценивать как фактор риска развития метаболического синдрома, характерного для атеросклероза.
Негативные последствия гиперактивации цитокинового каскада при стрессе могут проявляться такими нарушениями в сердечно-сосудистой системе, как угнетение инотропной функции миокарда вследствие выработки миокардиодепрессивного фактора, усиление тромбообразования под влиянием фактора агрегации тромбоцитов, повышение сосудистой проницаемости (интерстициальный отек) и вазодилатация, обусловленные провоспалительными цитокинами и высоким уровнем синтеза оксида азота.
Система дыхания. В системе дыхания стрессорное повреждение легких опосредуется через их недыхательные функции, представленные рядом процессов. Это – очистка крови от механических примесей (в том числе и процессы ферментативной деструкции), участие в механизмах гемостаза и фибринолиза, метаболизм белков и жиров, регуляция кислотно-основного баланса, терморегуляция, поддержание водного баланса, контроль цитокинов и других БАВ (их синтез и инактивация), участие в регуляции гемодинамики (продукция ангиотензина II), экскреторная функция (выведение продуктов метаболизма, в т.ч. и многих медикаментов). Участие легких во многих метаболических процессах делает их чрезвычайно уязвимыми при дестабилизации этих функций.
Длительный стресс с его гиперметаболизмом, сопровождается усилением перекисного окисления с образованием большого количества СР, способных оказывать повреждающее действие на клеточные мембраны альвеолоцитов, ответственных за синтез сурфактанта. Это оказывается возможным при недостатке антиоксидантов в организме. Снижение уровня сурфактанта, в свою очередь, выступает фактором риска нарушения дыхательной функции легких вследствие дестабилизации альвеол.
Развивающаяся при стрессе гипоксия клеток и их гипоэргоз влекут за собой увеличение циркулирующих в крови цитокинов, деструкция которых происходит в легких. Это, несомненно, повышает вероятность развития нарушений в системе дыхания. Так, под избыток провоспалительных цитокинов инициирует воспалительный процесс, увеличение в крови циркулирующих эйкосаноидов может провоцировать бронхоспастические реакции, а нейропептиды типа VIP вызывать нарушения вентиляционно-перфузионных соотношений в легких.
Система пищеварения. Гастродуоденальная зона чаще всего страдает от нарушений микроциркуляции. Ухудшение кровоснабжения стенки пищеварительного канала на фоне торможения синтеза и секреции факторов защиты слизистой желудка (бикарбонаты и мукоид) и активация таких повреждающих агентов, как ионы водорода, пепсин, создает предпосылки развития язвенной болезни. Нарушения микроциркуляции в тонком и толстом кишечнике могут явиться причиной изменения проницаемости слизистой и транслокации бактерий и собственных цитокинов в кровь, обусловливая состояние эндотоксемии. Кроме того, в результате симпатоадреналовой активации кишечник оказывается в состоянии не только ишемии, но и дискинезии. Дискинетические нарушения кишечника, снижая скорость пассажа пищи по нему, ведут к изменению условий функционирования нормальной микрофлоры и создают предпосылки для развития патогенных микроорганизмов, поступающих с пищей. Нарушения нормального микробиоценоза кишечника – фактор риска развития дисбактериоза со всеми его осложнениями.
Повышение уровня провоспалительных цитокинов, а также растормаживание гипериммунных реакций в условиях истощения глюкортикоидной функции надпочечников (снижение ингибирующего влияния роль кортизола на синтез иммунорегулирующих и провоспалительных цитокинов) при длительном стрессе способно индуцировать такие патологические процессы, как воспаление слизистой, образование аутоантител к антигенам поверхности эпителиоцитов, гиперплазию слизистой желудочно-кишечного тракта. При этом повышается риск развития язвенной болезни желудка, хронического гастрита, энтероколита, а также предраковых заболеваний опухолевого характера (полипы, гиперплазии слизистой).
Иммунная система. Длительная гиперреактивность организма в ответ на действие стрессоров, сопровождающаяся симптомами физиологического гиперкортицизма, является у отдельных лиц фактором риска развития инфекционных заболеваний или активации имеющихся очагов хронической инфекции вследствие вторичной слабости у них иммунного ответа.
В некоторых случаях стресс может оказаться пусковым моментом в развитии аутоиммунной патологии (гастриты, энтероколиты, сахарный диабет и др.). Этому способствует низкий уровень глюкокортикоидной реактивности при стрессе: недостаток ингибирующего влияния гормонов коры надпочечников на иммунную систему. Эта же категория лиц относится к группе риска развития системного воспалительного ответа при гиперпродукции цитокинов: избыточное увеличение энергопродукции по типу «самосжигания» организма, гипервоспаление с явлениями капиллярной утечки жидкости, и, как следствие, интерстициальным отеком.
Эндотелиальные факторы, образующиеся в повышенных количествах в условиях стресс-обусловленного гипоэргоза, превращаясь из факторов защиты в факторы полома, способны инициировать процессы, растормаживающие механизмы канцерогенеза.
Репродуктивная система. Активированный норадреналином повышенный синтез кортиколиберина гипоталамусом при стрессе оказывает тормозящее влияние на образование гонадотропных гормонов гипофиза (ФСГ и ЛГ), что следует рассматривать как фактор риска снижения фертильности у женщин (подавление процессов роста и овуляции яйцеклеток) и мужчин (угнетение сперматогенеза).
Метаболические нарушения. Гипергликемия, как стресс-обусловленное проявление гиперметаболизма, вследствие стимулирующего влияния на бета-клетки поджелудочной железы, у лиц с генетической предрасположенностью к сахарному диабету существенно повышает его риск развития. Этому может способствовать и истощение (или исходная недостаточность) глюкокортикоидной активности надпочечников, как фактора сдерживания гипериммунного ответа.
Нервная система и поведенческие реактивность. Активирующее влияние стрессоров способно при их длительном или чрезмерном воздействии на кору головного мозга привести к настолько выраженному повышению возбудимости, что происходит нарушение циркадианных ритмов сон-бодроствование: повышается утомляемость, растет раздражительность. Ингибирующее влияние кортиколиберина на центры аппетита и пищевого поведения при длительных стрессовых ситуациях может вызвать развитие неврогенной анорексии, особенно у лиц со слабым типом нервной системы. Эти же факторы вызывают нарушения полового поведения, снижение либидо с явлениями фригидности у женщин и импотенции у мужчин.
