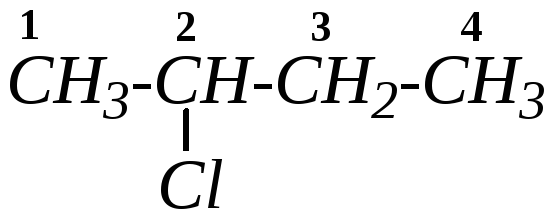- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Вопросы и упражнения
3.2. Галогеналканы
Галогеналканы, или алкилгалогениды, — это галогенопроизводные предельных углеводородов (алканов), то есть это продукты замещения одного или нескольких атомов водорода в молекуле алкана атомом (или атомами) галогена.
3.2.1. Классификация, номенклатура, изомерия
В зависимости от числа атомов галогена и от их природы галогеналканы можно разделить на
моногалогеналканы, содержащие один атом галогена, и
ди-, три- и полигалогеналканы, в молекулах которых несколько атомов галогена.
Моногалогеналканы классифицируют на первичные, вторичные и третичные в зависимости от природы атома углерода, у которого находится галоген.
Среди дигалогеналканов выделяют геминальные, в которых атомы галогена находятся у одного атома углерода, и вицинальные с расположением атомов галогена у соседних углеродных атомов, например,
|
CH3-CH2-CHCl2 1,1-дихлорпропан (геминальный) |
CH3-CHCl-CH2Cl 1,2-дихлорпропан (вицинальный) |
В зависимости от природы атомов галогена различают фтороалканы, хлороалканы, бромоалканы и йодоалканы. (А такие полигалогеналканы, как, например, CClF3, могут быть одновременно отнесены и к фтороалканам, и к хлороалканам.)
Для названия галогеналканов применяются как заместительная, так и радикало-функциональная номенклатуры ИЮПАК. Для низших и наиболее распространённых представителей приемлемыми являются и тривиальные названия, например, фтороформ, хлороформ, бромоформ, йодоформ, фторотан. В заместительной номенклатуре наличие атома галогена в молекуле обозначается приставкой, например, хлор(о)-. При этом соединительная гласная «о» при написании и при произношении часто опускается. Пример:
|
|
2-хлоробутан (или 2-хлорбутан) |
По радикало-функциональной номенклатуре к названию углеводородного радикала добавляется название галогена в анионной форме. Например, название этого же соединения по радикало-функциональной номенклатуре — втор-бутилхлорид.
Принципиального отличия в существовании того или иного вида изомерии у галогеналканов от алканов нет. Так, структурная изомерия галогеналканов представлена изомерией углеродного скелета и изомерией положения атома галогена. При этом среди дигалогенопроизводных вицинальные изомерны геминальным. Стереоизомерия связана как с наличием асимметрического атома углерода (в упомянутом выше 2-хлоробутане такой атом углерода есть, а значит, существуют оптические изомеры), так и с возможностью существования различных конформеров (относительно каждой углерод-углеродной связи).
3.2.2. Строение и свойства
В молекулах галогеналканов связь атома углерода с галогеном полярна:

В зависимости от природы галогена от фтора к йоду полярность связи C–Hal уменьшается (так как уменьшается электроотрицательность галогена), но возрастает её поляризуемость и увеличивается длина (так как увеличивается радиус атома галогена), а прочность связи при этом уменьшается (табл. 3.1).
Таблица 3.1
Характеристика связей C–Hal в молекулах галогеналканов
|
Связь |
Длина, нм |
Энергия диссоциации, кДж/моль |
|
C—F C—Cl C—Br C—I |
0.142 0.177 0.191 0.213 |
448 326 285 213 |
Поскольку в молекулах имеются центры с повышенной и пониженной электронной плотностью, межмолекулярное притяжение галогеналканов сильнее, чем межмолекулярное притяжение алканов, поэтому температуры кипения галогенопроизводных в целом выше, чем незамещённых углеводородов. Среди моногалогенопроизводных только фторо-, хлоро- и бромометаны — газы, остальные — жидкости и твёрдые вещества. Температуры кипения зависят от природы галогена и увеличиваются от фторопроизводных к йодопроизводным, так как с увеличением геометрических размеров молекул и их поляризуемости возрастают силы сцепления между молекулами. Температуры кипения зависят также от строения углеводородного радикала и уменьшаются от первичных к третичным по той причине, что молекулы становятся более компактными и уменьшается возможность для взаимодействия между их отдельными атомами и группами.
Так как поляризуемость связи C–I наибольшая, то при растворении йодоалканов в полярных растворителях эта связь легко поляризуется вплоть до гетеролитического разрыва, то есть до гетеролитической диссоциации йодоалкана: R–I R+ + I¯. При этом химические свойства соединений сильно зависят от их поляризуемости.
Галогеналканы бесцветны (только полийодпроизводные имеют желтую окраску), со своеобразным сладковатым запахом, нерастворимы в воде, но растворяются в органических растворителях, а некоторые из них сами являются прекрасными растворителями.
Химическая активность галогеналканов обусловлена взаимодействием структурных составляющих молекулы. Реакции нуклеофильного замещения и отщепления являются важнейшими среди химических свойств галогеналканов, хотя далеко не единственными среди них. Рассмотрение химических свойств начнём с примеров наиболее характерных SN- и Е-реакций.
3.2.2.1. Примеры реакций нуклеофильного замещения
1) Гидролиз галогеналканов — это превращение их в спирты по схеме:
R-Hal + H2O R-OH + HHal
Возможно протекание реакции как в нейтральной, так и в кислой и щелочной средах. Механизм реакции: SN1 или SN2 — определяется, в основном, структурой субстрата, а также другими факторами. Например, щелочной гидролиз бромэтана (SN2-механизм):

Кислотный гидролиз 2-бром-2-метилпропана (SN1-механизм):


2) Алкоголиз галогеналканов — это взаимодействие галогеналканов с алкоголятами металлов (реакция Вильямсона*), приводящее к образованию простых эфиров:
R-Hal + R-O¯Na+ R-O-R + NaHal
Реакция осуществляется по одному из механизмов нуклеофильного замещения. В ней нуклеофильной частицей является алкоголят-анион R-O¯. При этом при синтезе смешанных эфиров (с разными R и R) необходимо осуществить правильный выбор галогеналкана и алкоголята (RHal и R-O¯ или RHal и R-O¯ — в зависимости от структуры углеводородных радикалов) для того, чтобы реакция протекала с наибольшей скоростью.
3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
R-Hal
+ NН3
[R-NН3]+Hal¯
![]() R-NН2
+
NН4Hal
R-NН2
+
NН4Hal
Это также типичная SN-реакция. Образовавшийся первичный амин R-NН2 также является нуклеофилом и может вступать в реакцию с галогеналканом R-Hal с образованием вторичного амина R2NН и далее — до третичного амина R3N и солей четвертичного аммония [R4N]+Hal¯. (Такие превращения аминов ещё известны как алкилирование аминов по Гофману — см. также свойства аминов в главе 3.7.3.3.)
4) Замена одного атома галогена на другой. При реакции галогеналканов с галогеноводородом или с галогенид-ионом, где атом галогена отличается от субстратного по своей природе, происходит превращение одного галогеналкана в другой, например:
R-Br + I¯ R-I + Br¯
Скорость и направление реакции сильно зависят от природы обменивающихся атомов галогена и условий проведения реакции (в частности, природы растворителя), так как нуклеофильность галогенид-ионов уменьшается в ряду I¯>Br¯>Cl¯>F¯(гл. 3.1.1), кислая среда и протонные растворители в большей степени способствуют замещению атома фтора, а высокополярные апротонные растворители, наоборот, атома йода.
5) Взаимодействие с цианидами — это взаимодействие галогеналканов с солями синильной кислоты, приводящее к образованию органических цианидов (нитрилов) или изоцианидов. Цианид-ион является амбидентным нуклеофилом, то есть, способен проявлять свои нуклеофильные свойства, как за счёт атома углерода, так и за счёт атома азота:
¯:CN :C=N: ¯
В SN1-реакции с карбокатионом преимущественно взаимодействует реакционный центр с наибольшей электронной плотностью (т.е. реакция осуществляется по наиболее электроотрицательному атому). При SN2-процессе реагирует атом с большей нуклеофильностью (т. е. в данном случае с наибольшей поляризуемостью). Таким образом, изменяя механизм реакции, можно изменять относительную реакционную способность двух реакционных центров.
В данном случае азот является более жёстким, а углерод — более мягким нуклеофильным центром. Следовательно, азот будет предпочтительно взаимодействовать с сильно полярным (жёстким) кислотным центром (положительно заряженный атом углерода в карбокатионе) — механизм SN1. Это приводит к образованию изоцианидов (изонитрилов):
R+ + :C=N: ¯ R-N=С:
Углерод, как относительно мягкий центр нуклеофильной частицы, будет предпочтительно взаимодействовать с атомом углерода значительно менее поляризованной молекулы субстрата (механизм SN2):

При этом образуются цианиды (нитрилы).
6) Взаимодействие с нитритами. Нитрит-анион, так же как и рассмотренный выше цианид-анион, является амбидентным нуклеофилом. Поэтому его взаимодействие с галогеналканами может привести либо к нитросоединениям, либо к эфирам азотистой кислоты:
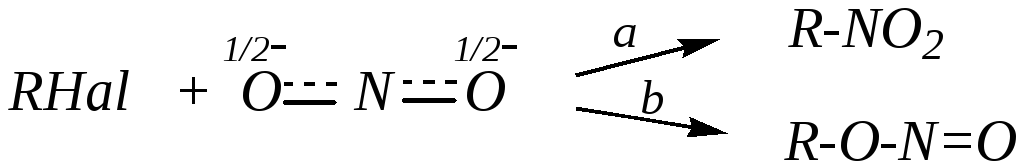
в зависимости от того, с каким нуклеофильным центром в нитрит-анионе происходит взаимодействие галогеналкана. Если внешние факторы способствуют протеканию реакции по SN2-механизму, то субстрат реагирует преимущественно с мягким нуклеофильным центром — атомом азота; это приводит к образованию нитросоединений (путь а). Если же в субстрате достаточно полярная связь С–Hal и возможна его диссоциация по условиям проведения процесса (механизм SN1), то карбокатион субстрата будет взаимодействовать с более жёстким нуклеофильным центром — атомом кислорода; это приводит к образованию алкилнитритов (эфиров азотистой кислоты) (путь b).
Определённую роль при этом может играть также и катион металла. Так, катион Ag+ способствует отщеплению галогенид-иона, то есть диссоциации исходного галогеналкана и образованию карбокатиона. Таким образом, применение нитрита серебра в качестве реагента повышает вероятность образования эфиров азотистой кислоты. Катион Na+, напротив, не способствует отщеплению галогенид-иона. Поэтому замена нитрита серебра на нитрит натрия в этой реакции приведёт к уменьшению доли алкилнитрита и увеличению доли нитросоединения в качестве продукта реакции.
Рассмотренные здесь реакции нуклеофильного замещения галогеналканов могут использоваться для получения других функциональных производных алканов: спиртов, простых эфиров, аминов, органических цианидов и изоцианидов, нитроалканов и алкилнитритов.
3.2.2.2. Пример реакции отщепления
Дегидрогалогенирование галогеналканов. Взаимодействие галогеналканов с твёрдой или спиртовой щёлочью протекает по схеме:
R-CH2-CH2Cl + KOH R-CH=CH2 + KCl + H2O
Возможен как механизм Е1, так и Е2. Нуклеофильное содействие может осуществляться и другими нуклеофильными реагентами. Возможна реакция отщепления для галогеналканов при действии, например, алкоголят-ионов. При этом для вторичных и третичных алкилгалогенидов наблюдается отщепление как по правилу Зайцева (с образованием термодинамически наиболее устойчивого алкена), так и по правилу Гофмана (с разрывом наиболее полярной С–Н-связи). Для реакций галогеналканов это зависит от основности атакующего нуклеофила и его пространственного объёма.
Данная реакция может применяться как способ получения алкенов.
помимо SN- и Е-реакций, для галогеналканов характерны некоторые радикальные реакции, такие как, например, образование металлорганических соединений, и реакции восстановления.
3.2.2.3. Радикальные реакции
1. Образование литийорганических соединений:
R-Cl + 2 Li R-Li + LiCl
Реакция начинается с одноэлектронного переноса, то есть с передачи атомом лития одного валентного электрона алкилхлориду:
RCl + Li [RCl]־+ Li+
Образовавшийся анион-радикал распадается на хлорид-ион и алкил-радикал, который затем взаимодействует со вторым атомом лития:
[RCl]־R + Cl¯
R + Li R-Li
2. Образование реактива Гриньяра*. Реактивами Гриньяра называют магнийорганические соединения — галогениды алкилмагния, которые получают в среде диэтилового эфира, являющегося для них хорошим растворителем, например, по схеме:
R-Cl + Mg R-MgCl
хлорид алкилмагния
Реактивы Гриньяра нашли широкое применение в синтезе представителей различных классов органических соединений. Например, их гидролиз приводит к образованию алканов
R-MgCl + H2O R-H + Mg(OH)Cl
и может в некоторых случаях использоваться как способ получения предельных углеводородов; окисление с последующим гидролизом может использоваться как способ получения первичных спиртов:
R-MgHal
![]() [R-O-O-MgHal]
[R-O-O-MgHal]
![]() 2ROMgHal
2ROMgHal
![]()
2ROH + 2Mg(OH)Hal;
карбоксилирование с последующим гидролизом — как способ получения карбоновых кислот:

Французский химик В. Гриньяр за открытие магнийорганических соединений, названных впоследствии его именем, был удостоен Нобелевской премии по химии в 1912 г.
3. Реакция Вюрца. Здесь по радикальному механизму протекает образование натрийорганического соединения (аналогично литийорганическому), а дальнейшее его взаимодействие со следующей молекулой галогеналкана с образованием алкана — это уже нуклеофильное замещение:
(SR) R-Cl + 2Na R-Na + NaCl
(SN) -R:Na + +RCl R-R + NaCl
Поэтому в ряде случаев реакция Вюрца используется как способ получения алканов.
4. Восстановление йодоалканов йодоводородом. Реакция происходит при нагревании йодоалканов с йодоводородной кислотой:
R-I + HI RH + I2
Вследствие высокой поляризуемости связь C–I может претерпевать гомолитический разрыв, и реакция с йодоводородом протекает по радикальному механизму:
R-I R + I
R + H-I RH + I
Йодоводородом можно восстанавливать и другие галогеналканы, но в этом случае сначала происходит нуклеофильное замещение:
R-X + HI R-I + HX,
а затем уже восстановление.