
- •Лекция 4 Окислительно-восстановительное титрование
- •4.1. Сущность метода
- •4.2. Классификация редокс-методов
- •4.3. Условия проведения окислительно-восстановительного титрования
- •4.4. Виды окислительно-восстановительного титрования
- •4.5. Индикаторы окислительно-восстановительного титрования
- •4.6. Графический метод изображения процесса окисления — восстановления
4.6. Графический метод изображения процесса окисления — восстановления
Подобно тому, как процессы кислотно-основного титрования могут быть представлены графически в виде кривой титрования, изображающей изменение величины рН титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи, процессы окислительно-восстановительного титрования можно также представить графически в виде кривой титрования, изображающей изменение окислительно-восстановительного потенциала Етитруемого раствора по мере приливания к нему стандартного (титрованного) раствора окислителя или восстановителя.
Каждый процесс окисления—восстановления характеризуется своей кривой титрования, изображающей изменение окислительно-восстановительного потенциала в процессе титрования. Как видно из уравнения:
![]()
величина потенциала Езависит от величины нормального окислительно-восстановительного потенциала данной системыЕи от количественного соотношения концентраций окислителя и восстановителя. Например, потенциал раствора, содержащего одновременно соли двух- и трехвалентного железа, будет тем выше, чем больше отношение
-
[Fe3+](окислитель)
[Fe2+] (восстановитель)
При титровании железа (II) перманганатом в кислой среде, согласно схеме
-
 Fe2+
Fe2+KMnO4
Fe3+
[Fe3+] увеличивается по мере приливания титранта и одновременно уменьшается [Fе2+]. Следовательно, изменяется отношение [Fe3+]/[Fe2+]. По мере увеличения этого отношения окислительно-восстановительный потенциал тоже увеличивается.
Это постепенное увеличение потенциала происходит неравномерно. Вблизи точки эквивалентности наблюдается наиболее резкое (скачкообразное) изменение потенциала, объясняемое более резким изменением соотношения [Fe3+]/[Fe2+], которое достигает превышения начального отношения в миллион раз.
По величине нормальных потенциалов можно рассчитать величину константы равновесия данной окислительно-восстановительной реакции, а зная ее величину, можно вычислить отношение равновесных концентрации и рассчитать значение потенциалов в процессе титрования. В точке эквивалентности раствор характеризуется определенным окислительно-восстановительным потенциалом. Конец титрования может быть определен при помощи индикатора, изменяющего свою окраску при этом окислительно-восстановительном потенциале.
Изменение окислительно-восстановительного потенциала раствора в процессе титрования. Если опустить в раствор, содержащий Fe3+иFе2+-ионы, пластинку из инертного металла (например, платины) и соединить такой электрод с каким-либо другим окислительно-восстановительным (или ред-окс) электродом, то образуется гальванический элемент. При этом происходит окислениеFе2+вFе3+или восстановлениеFе3+вFе2+.
Окисление Fе2+вFе3+происходит в том случае, когда второй электрод в гальваническом элементе является положительным, т. е. когда в реакцию вступает более сильный окислитель, чемFе3+. ВосстановлениеFе3+вFе2+наблюдается тогда, когда указанный электрод является отрицательным, т. е. когда в реакцию вступает более сильный восстановитель, чемFе2+.
Таким образом, непременным условием протекания какой-либо окислительно-восстановительной реакции является наличие системы двух пар окислителей Окисл.1 и Окисл.2 и восстановителей— Восст.1 и Восст.2.
В начале титрования, когда имеется избыток восстановителя, величину окислительно-восстановительного потенциала, меняющуюся по мере изменения концентрации, вычисляют по формуле:
![]()
где [0кисл.2] и [Восст.2] относятся к титруемому веществу (восстановителю). В точке эквивалентности потенциал раствора вычисляют на основании величины нормальных потенциалов восстановителя и окислителя и константы равновесия данной реакции. После точки эквивалентности величину потенциала определяют по избытку прибавляемого окислителя по формуле:
![]()
где [0кисл.1] и [Восст.1] относятся к титрованному раствору (окислителю). При титровании окислителя восстановителем вычисления проводят аналогично.
Рассмотрим в качестве примеров титрование ионов железа(II) сульфатом церия(IV) и титрование ионов железа(II) перманганатом калия в сернокислой среде.
Титрование соли железа(II) сульфатом церия(IV).
а) Расчет величины потенциала в начале титрования
Когда идет речь об окислительно-восстановительном потенциале, то имеется в виду не отдельный элемент или его ионы, а система, характеризующаяся определенным равновесием. Например:
|
Fe3+ + e‑⇆ Fе2+ |
(а) |
|
Fe2+ + 2e‑⇆ Fе0 |
(б) |
|
Fe3+ + 3e‑⇆ Fе0 |
(в) |
|
[Fе(СN6)3+] +е‑⇆[Fe(CN)6]4‑ |
(г) |
|
[FeF6]3‑ + e‑⇆ Fe2+ + 6F‑ |
(д) |
Вследствие этого для систем, выражающих различное состояние данного элемента, может быть не одно, а несколько значений нормального потенциала. Так, для железа, в соответствии с уравнениями а, б, в, г, д существуют различные значения нормального потенциала.
При титровании солей железа (II) сульфатом церия (IV) ионы железа (II) окисляются до ионов железа (III), в результате возникает система, выражаемая следующим уравнением
Fe2+ ‑e‑⇆Fе3+
Если для титрования взято 100 мл 0,1 и. раствора соли железа (II), то при прибавлении первой капли (~0,001 мл) 0,1 и. стандартною раствора сульфата церия образуется эквивалентное количество Fe2+ -ионов. Поэтому в начале титрования отношение концентраций ионов [Fe3+]/[Fe2+], определяющее потенциал системы, можно считать равным:
-
[Fe3+]
0,001
10-5
[Fe2+]
100
Потенциал системы:
![]() 0,771 + 0,059 lg10-5
0,771 + 0,059 lg10-5
0,771 ‑ 0,059 5 0,771 ‑ 0,295 0,476 B
Реакция окисления железа (II) церием (IV) идет согласно уравнению:
Се4+ + Fe2+ = Се3+ + Fe3+
EFe3+/Fe2+ = 0,77l B, ECe4+/Ce3+ = 1,45 B
Реакция обратима, и во время титрования, после каждого прибавления стандартного раствора сульфата церия, устанавливается равновесие:
окислитель1(Ce4+) + восстановитель2(Fe2+)⇆
⇆ восстановитель (Се3+) + окислиnель (Fe3+)
Окислительно-восстановительные потенциалы обеих систем
+ Fe3++ е⇆Fe2+Се4++ е⇆Се3+
при установившемся равновесии равны друг другу. Поэтому расчет потенциала в каждый данный момент титрования после установления равновесия может быть сделан по одному из следующих уравнений:
![]()
![]()
б) Расчет величины потенциала в процессе титрования до точки эквивалентности.
При приливании к 100 мл 0,1 н. раствора соли железа(II) 0,1 мл 0,1 н. раствора сульфата церия(IV) происходит окисление ионов Fe2+в Fe3+в количестве, эквивалентном его количеств содержащемуся в 0,1 мл 0,1 н. раствора. В этот момент, если не учитывать разбавление раствора, отношение:
-
[Fe3+]
=
0,1
= 10-3
[Fe2+]
100
Следовательно:
![]() = 0,771 +0,059lg 10-3
= 0,771 ‑0,059•3 = 0,594 B
= 0,771 +0,059lg 10-3
= 0,771 ‑0,059•3 = 0,594 B
При приливании 1 мл стандартного раствора сульфата церия образуется эквивалентное количество ионов Fe3+и
-
[Fe3+]
=
1
= 10-2
[Fe2+]
100
тогда
![]() = 0,771 +0,059lg 10-2
= 0,771 ‑0,059•2 = 0,653 B
= 0,771 +0,059lg 10-2
= 0,771 ‑0,059•2 = 0,653 B
При приливании к 100 мл 0,1 н. раствора соли железа(II) 10 мл 0,1 н. раствора сульфата церия (IV)
-
[Fe3+]
=
10
10-1
[Fe2+]
90
Следовательно
![]() 0,771 +0,059lg 10-1
0,771 ‑0,059
0,712 B
0,771 +0,059lg 10-1
0,771 ‑0,059
0,712 B
После добавления 50 мл раствора сульфата церия половина ионов железа (П) будет окислена и [Fe3+] = [Fe2+]; тогда
![]() = 0,771 +0,059lg1 = 0,771 = 0,771B
= 0,771 +0,059lg1 = 0,771 = 0,771B
После прибавления 90 мл раствора сульфата церия неокисленными останутся ионы железа(П) в количестве, соответствующем 10 мл раствора:
-
[Fe3+]
=
90
10
[Fe2+]
10
![]() = 0,771 +0,059lg 10 = 0,771 +0,059 = 0,830 B
= 0,771 +0,059lg 10 = 0,771 +0,059 = 0,830 B
После прибавления 99 мл раствора сульфата церия:
-
[Fe3+]
=
99
100
[Fe2+]
1
![]() = 0,771 +0,059lg 100 = 0,771 +0,0592
=
= 0,771 +0,059lg 100 = 0,771 +0,0592
=
= 0,771 + 0,118 = 0,889 B
После прибавления 99,9 мл раствора сульфата церия:
-
[Fe3+]
=
99,9
1000
[Fe2+]
0,1
![]() = 0,771 +0,059lg 1000 = 0,771 +0,0593
=
= 0,771 +0,059lg 1000 = 0,771 +0,0593
=
= 0,771 + 0,177 = 0,948 B
в) Расчет величины потенциала в точке эквивалентности
В точке эквивалентности, т.е.в момент, когда 100 мл 0,1 н раствора сульфата церия прибавлено к 100 мл 0,1 н раствора соли железа(П), в растворе устанавливается следующее равновесие
[Ce3+] = [Fe3+] [Ce4+] = [Fe2+]
или
-
[Ce4+]
=
[Fe2+]
[Ce3+]
[Fe3+]
![]()
![]()
Для установившегося равновесия ЕСе4+/Се3+.=ЕFе3+/Fе2+. = Е можно написать
![]()
-
2Е = 1,45 + 0,771 + 0,059lg
[Ce4+][Fe3+]
[Ce3+][Fe2+]
Так как
-
[Ce4+]
=
[Fe2+]
[Ce3+]
[Fe3+]
то выражение под знаком логарифма равно единице:
2Е= 1,45 + 0,771
-
Е =
1,45 + 0,771
= 1,110 В
2
Таким образом, в точке эквивалентности Е= 1,110 В
Для точки эквивалентности согласно формуле 6:
-
 [Восст.1]
[Восст.1]=
[Окисл.2]
=КОкисл./Восст.
[Окисл.1]
[Восст.2]
а согласно формуле 5:
-
lgКОкисл./Восст.=
n(Ео1 ‑ Ео2)
0,059
Для нашего случая титрования (n= 1)
-
lgKОкисл./Восст. =
1,45 ‑ 0,771
= 11,5
0,059
KОкисл./Восст. 41011
Поэтому в точке эквивалентности
-
 [Ce3+]
[Ce3+]=
[Fe3+]
=41011 6,4105
[Ce4+]
[Fe2+]
Это означает, что реакция будет идти практически до конца слева направо и что в момент равновесия в точке эквивалентности [Fe2+] в титруемом растворе будет более чем в миллион раз меньше [Fe3+], т. е. ионы железа(П) будут практически полностью оттитрованы (окислены).
г) Расчет величины потенциала после точки эквивалентности.
Расчет производят, пользуясь уравнением:
![]()
Нормальный потенциал этой системы ECe4+/Ce3+ равен 1,45 В. Прибавление избытка 0,1 мл 0,1 н раствора соли церия(IV) создает отношение
-
[Ce4+]
=
0,1
= 10-3
[Ce3+]
100
![]() = 1,45 + 0,059lg10-3=
= 1,45 + 0,059lg10-3=
= 1,45 ‑ 0,0593 = 1,273 В
Прибавление 1 мл 0,1 н раствора сульфата церия создает отношение:
-
[Ce4+]
=
1
= 10-2
[Ce3+]
100
![]() = 1,45 + 0,059lg10-2=
= 1,45 + 0,059lg10-2=
= 1,45 ‑ 0,0592 = 1,332 В
Прибавление 10 мл 0,1 н раствора сульфата церия создает отношение:
-
[Ce4+]
=
10
= 10-1
[Ce3+]
100
![]() = 1,45 + 0,059lg10-1=
= 1,45 + 0,059lg10-1=
= 1,45 ‑ 0,059 = 1,391 В
Другими словами, в начальный период после достижения точки эквивалентности значение потенциала (подобно его значению в точке эквивалентности) продолжает резко повышаться при добавлении первых капель раствора сульфата церия, а затем значение потенциала изменяется в меньшей степени. Полученные данные расчетов приведены в табл. 4.1. При титровании применяют индикатор ферроин.
Таблица 4.1.
Титрование 100 мл, 0,1 н. раствора ионов железа(II) 0,1 н. раствором ионов церия (IV)
|
Прибавлено 0,1 н. раствора сульфата церия, мл |
Осталось ионовFe2+, % |
Соотношение концентраций ионов |
Значение потенциала, В |
E/C | |
|
|
До точки эквивалентности [Fe3+]/[Fe2+] |
|
| ||
|
1 капля (0,001 мл |
100 |
0,001/100 = 10-5 |
0,476 |
| |
|
0,1 |
99,9 |
0,1/99,9 = 10-3 |
0,594 |
0,118/0,1 = 1,18 | |
|
1 |
99 |
1/99 = 10-2 |
0,653 |
0,059/0,9 = 0,065 | |
|
10 |
90 |
10/90=10-1 |
0,712 |
0,059/10 = 0,006 | |
|
50 |
50 |
50/50 = 1 |
0,771 |
0,059/40 = 0,0015 | |
|
90 |
10 |
90/10 10 |
0,830 |
0,059/70 = 0,0015 | |
|
99 |
1 |
99/1 102 |
0,889 |
0,059/9 = 0,0065 | |
|
99,9 |
0,1 |
99,9/0,1 103 |
0,948 |
0,059/0,9 = 0,065 | |
|
|
В точке эквивалентности [Сe3+] = [Fe3+]; [Сe4+] = [Fe2+] | ||||
|
100 |
0 |
[Сe3+]/[Сe4+] = [Fe3+]/[Fe2+] = = 6,4105 |
0,771+1,45 2 =1,110 |
0,162/0,1 =1,63 | |
|
|
После точки эквивалентности [Сe4+]/[Сe3+] избыток ионов церия(IV) | ||||
|
100,1 |
0,1 |
0,1/100,1 10-3 |
1,273 |
0,163/0,1 = 1,63 | |
|
101,0 |
1 |
1/101,0 10-2 |
1,332 |
0,059/0,9 = 0,065 | |
|
110 |
10 |
10/110 10-1 |
1,391 |
0,059/9 = 0,0065 | |
Построение кривых титрования.Если на оси абсцисс откладывать содержание (в процентах) остающегося в растворе (в разные моменты титрования) восстановителя или окислителя или количество прибавленного стандартного раствора (в миллилитрах), а на оси ординат — отвечающие им значенияЕ(в милливольтах), то можно построить кривую, представляющую ход измененияЕ в процессе окисления—восстановления.
На рис. 4.1. показана наиболее характерная часть кривой титрования 0,1 н. раствора сульфата железа(II) 0,1 н. раствором сульфата церия(IV) (10% остатка Fe2+-ионов и 10% избытка стандартного раствора Се(SО4)2]. Как видно из рис. 4.1., кривая окислительно-восстановительного титрования напоминает кривые, получаемые в методе нейтрализации. В начале титрования, когда в титруемом растворе находится значительное количество восстановителя, кривая изменяется плавно, даже при добавлении значительных количеств реактива величинаЕизменяется медленно. Вблизи точки эквивалентности наблюдается резкое изменение потенциала даже при прибавлении малых количеств реактива. По резкому скачку кривой титрования устанавливают точку эквивалентности, которая не всегда лежит на середине скачка. Характер кривых в методах окисления—восстановления не зависит от разбавления раствора, если стехио-метрические коэффициенты у окислителя и восстановителя одинаковы.
Например, в системе Fe3+ ⇆Fe2+и Се4+ ⇄Се3+при разбавлении раствора соотношения концентраций остаются те же. Если же стехиометрические коэффициенты различны, то разбавление раствора сказывается на отношениях окисленной и восстановленной форм, и потенциал раствора несколько изменится.
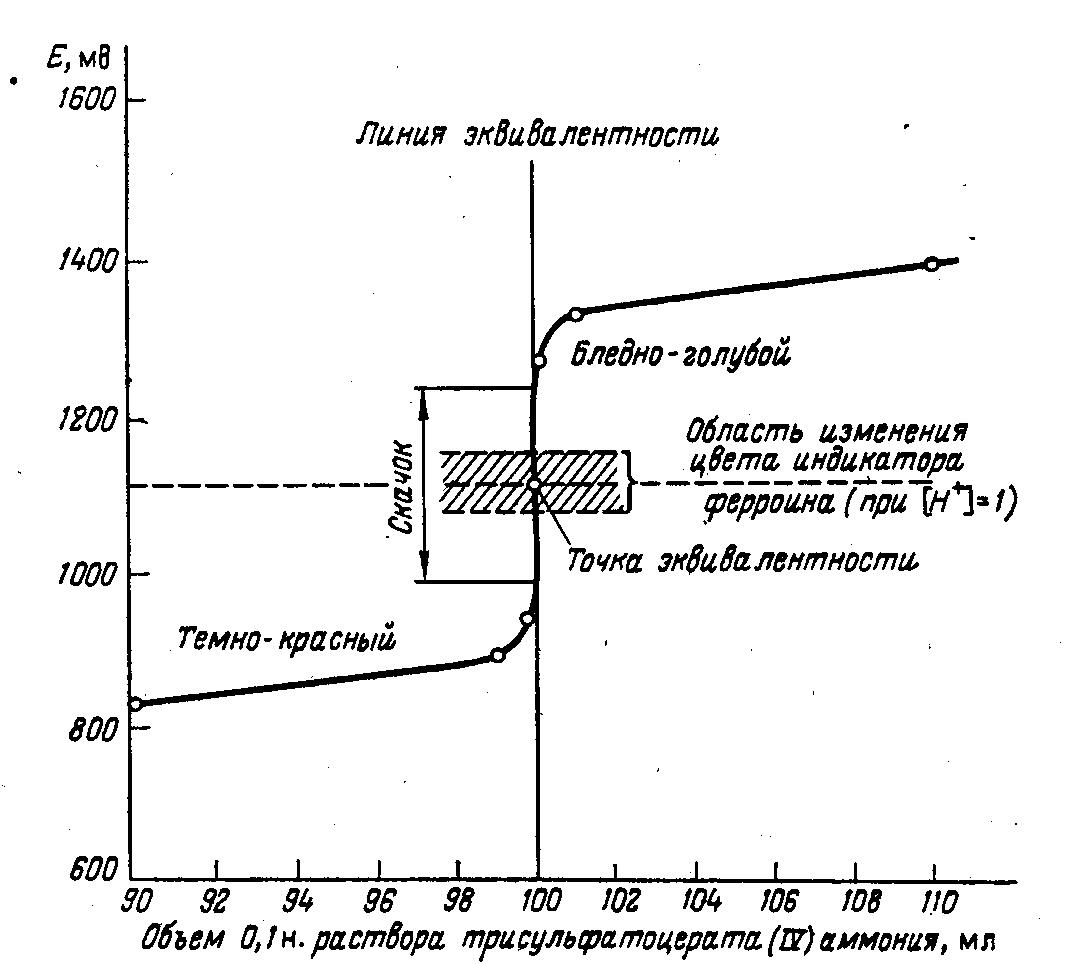
Рис. 4.1. Кривая титрования 0,1 н. раствора соли железа (II) 0,1 н. раствором сульфата церия (IV).
