
7.1.3. Классификация электродов
Рассмотрим классификацию электродов в соответствии с характером протекающих на них электрохимических процессов и их конструктивными особенностями.
Электроды, на которых протекают окислительно-восстановительные процессы, называются металлическими. В зависимости от природы частиц — переносчиков заряда они подразделяются на инертные и активные. Активные электроды, в свою очередь, делятся на электроды первого и второго рода.
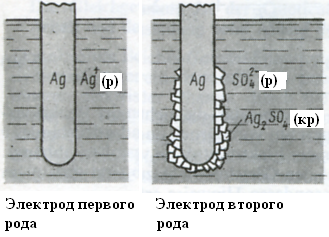
Рис. 7.3. Электроды первого и второго рода
Инертным называется электрод, роль которого сводится к переносу электронов между частицами, находящимися в растворе. Таким электродом может служить платиновая проволока, погруженная в раствор соответствующего состава, например, содержащего ионы Fe2+ и Fe3+.
Подобный электрод в принципе возможно себе представить применительно и к другим окислительно-восстановительным системам: Sn4+/Sn2+, Pb4+/Pb2+, Cr2O72-, H+/Cr3+, MnO2, H+/Mn2+ (две последние системы являются рН-зависимыми).
Роль активных электродов — перенос ионов через границу раздела фаз.
Такие электроды, состоящие из металла, погруженного в раствор соли этого металла, называются электродами первого рода. Например, в ячейке, изображенной на рис. 3.1, имеются два электрода первого рода — Аg/Аg+ и Zn/Zn2+.
Электроды второго рода — это системы, в которых происходит перенос не собственных катионов материала электрода, а анионов, образующих с ионами металла малорастворимые соединения или устойчивые комплексы.
К электродам второго рода, в основе действия которых лежит образование малорастворимого соединения, относятся, в частности, упоминавшиеся ранее хлоридсеребряный и каломельный электроды. Они имеют большое практическое значение, поскольку повсеместно используются в качестве электродов сравнения.
В качестве примера рассмотрим принцип работы каломельного электрода. Каломельный электрод состоит из ртути, покрытой слоем каломели Hg2Cl2 и погруженный в раствор KCl. Для электродов сравнения, как правило, используют насыщенный раствор KCl. Схематически конструкция такого электрода изображена на рис. 3.2. Контакт электрода с анализируемым раствором может осуществляться посредством мембраны или диафрагмы.
Потенциал каломельного электрода определяет следующая электродная реакция:
Hg2Cl2 + 2e ⇄ 2Hg + 2Cl-
Для вывода уравнения, описывающего равновесный потенциал каломельного электрода, необходимо принять во внимание как собственно потенциалопределяющую стадию, так и равновесие осадок-раствор с участием хлорида ртути (I).
12.1.3. Теоретические основы потенциометрии.
Метод потенциометрии основан на измерении напряжения на электродах ячейки в отсутствие тока. В этом случае один из электродов является неполяризуемым индикаторным электродом, а другой — электродом сравнения (обычно используют насыщенный каломельный или хлоридсеребряный электрод).
Рассмотрим общий принцип потенциометрического анализа на примере определения ионов Аg+ при помощи серебряного индикаторного электрода (электрод первого рода). Устройство соответствующей ячейки показано на рис. 7.4.

Рис. 7.4. Ячейка для потенциометрического определения Ag+ с помощью серебряного электрода. Электрод сравнения – насыщенный каломельный электрод. Напряжение измеряют вольтметром при отсутствии тока.
Измеряемое вольтметром напряжение на электродах ячейки в соответствии с уравнением Нернста в общем случае равно
Е
= Е
+
![]() ln
ln![]()
В данном случае активность восстановленной формы (металлическое серебро) постоянна и может быть принята равной единице, поэтому
Е
= Е
+
![]() ln
ln![]()
![]()
При комнатной температуре (25°С) значение предлогарифмического коэффициента в уравнении Нернста в данном случае (перенос одного электрона) равно 59,16 мВ. При переносе двух или трех электронов оно равно, соответственно, 29,5 в 19,7мВ. Однако случай переноса трех электронов в потенциометрическом анализе практически не встречается.
12.2. Оборудование для потенциометрии
12.2.1. Измерения рН с помощью стеклянного электрода
Едва ли не самое известное применение прямой потенциометрии состоит в измерении рН при помощи стеклянного электрода. Стеклянный электрод состоит из корпуса, в который налит буферный раствор. В этот раствор погружен внутренний электрод сравнения - чаще всего хлоридсеребряный (рис.7.5). Нижняя шарообразная часть корпуса сделана из очень тонкого стекла и обычно называется стеклянной мембраной. Однако это не мембрана в обычном смысле слова, поскольку она непроницаема для компонентов раствора.
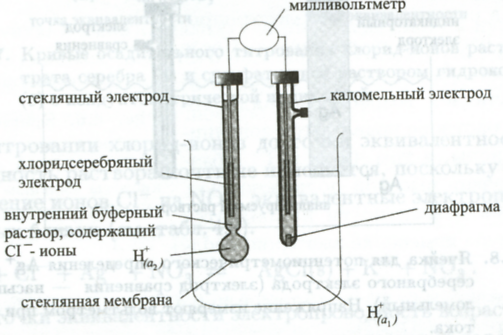
Рис. 7.5. Потенциометрическое измерение при помощи стеклянного электрода и каломельного электрода сравнения.
При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на ионы Н+. Для того, чтобы мембрана электрода приобрела способность к такому обмену, ее следует предварительно вымочить в кислом растворе.
Равновесное значение потенциала стеклянного электрода зависит от активностей ионов Н+ в анализируемом растворе (а1) и внутреннем растворе электрода (а2). В первом приближении эта зависимость имеет вид
Е
=
![]() ln
ln![]()
Поскольку активность ионов Н+ во внутреннем растворе (а2) постоянна, то
Е
= Еconst
+
![]() ln
а1
ln
а1
Подставляя численные значения параметров и переходя от натуральных логарифмов к десятичным, при 25°С имеем:
E(25C) = Еconst – 59,16pH (мВ)
Величина Еconst зависит от значения рН внутреннего раствора, а также от потенциала асимметрии стеклянной мембраны. На практике угол наклона градуировочной зависимости может отличаться от теоретического значения 59,16 мВ. В этих случаях в уравнение вводят эмпирическую поправку k — коэффициент крутизны:
E(25C) = Еconst – k59,16pH (мВ)
Для нахождения постоянного члена Еconst и коэффициента крутизны k: измеряют значения рН стандартных буферных растворов с известными величинами рН и сравнивают измеренные значения с теоретическими (рис. 7.6). При наличии расхождений между ними прибор соответствующим образом подстраивают. Необходимо использовать по меньшей мере два стандартных раствора, покрывающих весь диапазон значений рН. Часто градуировку проводят по нейтральному фосфатному буферу (рН = 6,86), а второй буфер выбирают в кислой или щелочной области, в зависимости от требу емого диапазона рН.
Стеклянные электроды позволяют с высокой точностью измерять значения рН от 1 до 10. На краях этого диапазона рН наклон градуировочной зависимости несколько ниже теоретического. При рН < 1 возникает кислотная погрешность, величина которой зависит от сорта стекла, использованного для изготовления мембраны. При рН > 10 электрод становится чувствительным к ионам щелочных металлов, вследствие чего возникает щелочная погрешность. Существуют сорта стекла (в частности, на основе Li2O – BaO – La2O3 – SiO2), для которых рабочий диапазон рН более широкий как в кислой, так и в щелочной области. С другой стороны, чувствительность стеклянной мембраны к ионам натрия и калия можно использовать для создания специальных сортов стекол и разработке на их основе электродов для определения этих ионов.
