
Методичка по Термодинамике и теплотехнике
.pdfкажущуюся молекулярную массу смеси и газовую постоянную, отнесённую к одному нормальному кубическому метру.
Задача 3-9. Дымовые газы имеют массовый состав: m(CO2) = 16,1 %; m(O2) = 7,5 % и m(N2) = 76,4 %. Рассчитать энтальпию hСМ этих газов, отнесённую к одному килограмму смеси при температуре 1073 К, отсчитанную от 273
К. Пример 3-1. Воздух имеет примерно следующий массовый состав: m(O2) = 23,2 %; m(N2) = 76,8 %. Определить объёмный состав воздуха, кажущуюся молярную массу, газовую постоянную смеси и парциальные давления кислорода и азота, если давление воздуха по барометру B = 760 ммHg.
Решение.
Объёмный состав воздуха:
|
|
|
|
|
|
|
|
m O2 |
|
|
|
|
|
|
|
|
|
|
|
23,2 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
μ O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
τ O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3,2 |
10 2 |
0,21. |
||||||||||||||
|
|
m |
O2 |
|
|
|
m |
N2 |
|
|
|
23,2 |
|
|
76,8 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
3,2 10 2 |
2,8 10 2 |
|
|
|||||||||||||||||||||
|
|
|
|
|
μ O2 |
|
|
μ N2 |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
τ(N2) = 1 – τ(O2) = 1 – 0,21 = 0,79. |
|
|
|||||||||||||||||||||||||
Кажущаяся молярная масса: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
μ |
СМЕСИ |
|
k τμ |
τ |
|
O |
2 |
|
μ |
|
O |
2 |
τ |
|
N |
2 |
μ |
|
N |
2 |
0,21 3,2 10 2 |
кг/моль |
||||||||||
|
|
i i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
i 1 0,79 2,8 10 2 кг/моль 2,88 10 2 кг/моль. |
|
||||||||||||||||||||||||||||
Газовая постоянная смеси: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
k |
|
|
|
|
|
m O2 R O2 m N2 R N2 |
|
||||||||||||||||||
|
|
|
RÑÌ ÅÑÈ miRi |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
0,232 259,82 0,768 296,75 288,18Дж/кг×К. |
|
||||||||||||||||||||||||||||
Парциальные давления кислорода и азота:
P(O2) = τ(O2) × B = 0,21 × 760 = 159,6 ммHg. P(N2) = B – P(O2) = 760 ммHg – 159,6 = 600,4 ммHg.
Глава 4. Теплоёмкость.
Краткая теоретическая часть.
Отношение теплоты δq, полученной единицей количества вещества к изменению температуры dt называют удельной теплоемкостью.
|
CX |
|
|
q |
|
|
|
(4.1) |
||
|
|
dt |
|
|
|
|
||||
|
|
|
|
|
X |
|
|
|
||
Поскольку количество теплоты δq зависит от характера процесса, то и те- |
||||||||||
плоемкость системы Сх так же зависит от условий протекания процесса. |
|
|||||||||
Теплоемкость в зависимости от количества вещества может быть |
||||||||||
массовой – С, объемной С’ и мольной µс. Их соотношения: |
|
|||||||||
C C |
C ' |
C |
|
|
C ' C H |
(4.2) |
||||
22,4 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
Физический смысл теплоемкостей вещества при V=const и p=Const, сле- |
||||||||||
дует из рассмотрения дифференциальных соотношений термоденемики: |
|
|||||||||
C |
U |
|
|
и |
C |
P |
|
|
h |
(4.3) |
V |
|
|
|
|
|
|
|
|
|
|
|
T |
V |
|
|
|
|
|
|
T P |
|
|
- 11 - |
|
|
|
|
|
|
|
|
|
www.mitht.ru/e-library
|
а для идеального газа –C |
|
|
dU |
|
|
|
и |
C |
P |
|
|
dh |
|
(4.4) |
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
V |
|
|
|
|
|
|
|
|
|
|
|
|
dT P |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
а это свидетельствует о том, что изменения внутренней энергии и энталь- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
пии определяются как |
|
|
|
|
|
|
|
|
|
dU CV |
dT и dH CP dT |
|
|
|
|
|
|
(4.5) |
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
т.е. независимо от характера процесса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
Соотношения между Сv и Сp могут быть: |
|
|
|
|
|
|
|
|
Cv=R/(K-1) |
|
(4.5) |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cp=Cv+R Cp/Cv |
=K |
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
Теплоемкость, определяемая по уравнению (4.1) при заданных парамет- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
рах состояния (p, V, T) |
называемая истинной и может быть выражена как: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
где CX0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cx Cx0 |
Cx |
|
|
|
|
|
|
|
|
|
|
|
|
|
(4.7) |
|
|||||||||||||||
|
|
– теплоемкость газа в разряженном состоянии (при p→0) и зави- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
сит только от температуры, |
а |
Cx – |
определяет зависимость теплоемкости от |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
давления и объема. |
|
|
|
|
|
|
|
|
|
|
|
в интервале температур от t1 до t2 выражается |
||||||||||||||||||||||||||||||||||||||||||
|
Средняя теплоемкость Cхm |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
как: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
Xm |
|
t |
2 |
= |
|
|
|
|
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
t |
2 |
- t |
|
|
|
|
|
|
|
|
|
|
|
|
(4.8) |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Если принять, что один из пределов1, например t1=0°C, то можно рассчи- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
тать средние теплоемкости газов в интервале температур от t1 |
=0°C до t2 |
=х°C и |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
представить их значения в табличной форме, см. приложение, таблицы 2-6. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Количество теплоты, передаваемое системе или отдаваемое ею можно |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
найти по следующим формулам: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
2 |
t |
|
C |
|
|
|
V |
|
|
|
|
|
|
|
|
2 |
t |
|
|
C' |
t |
|
|
|||||||||||||||||||||||||||
|
Q |
P |
M C |
P |
|
|
2 |
P |
|
|
|
|
1 t |
|
|
C' |
|
|
|
|
2 |
1 |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
0 |
1 |
|
|
|
Н |
|
|
|
|
P |
|
0 |
|
|
|
P |
0 |
|
1 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
t2 t |
|
|
|
|
|
|
|
|
|
t1 t |
|
|
|
|
|
|
|
|
|
|
|
|
|
t2 |
|
|
|
|
|
|
|
|
t1 t |
. |
(4.9) |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
Q |
V |
M C |
V |
|
2 |
C |
V |
|
|
|
|
|
V |
|
C' |
|
|
|
t |
2 |
C' |
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
1 |
|
|
|
Н |
|
|
|
|
V |
|
|
0 |
|
|
|
|
V |
|
0 |
|
1 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В соответствии с молекулярно-кинетической теорией газов мольная теп- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
лоёмкость при V = const пропорциональна числу степеней свободы, выражен- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ному в джоулевом |
|
|
эквиваленте, |
|
|
и |
|
для |
|
|
|
|
одного |
моля |
газа |
равна |
||||||||||||||||||||||||||||||||||||||
|
μCV = 3 × 4,19 = 12,5 Дж/(кмоль×К). Тогда, в соответствии с законом Майера, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
μCP = 5 × 4,19 = 20,8 Дж/(кмоль×К), что позволяет в зависимости от атомности |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
газа и их степеней свободы представить их значения в следующем виде: |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4.1. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
атомность газа |
|
|
|
|
|
|
|
|
|
|
|
μCV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μCP |
|
|
|||||||
|
|
Ккал/(Кмоль×К) |
|
КДж/(Кмоль×К) |
|
|
|
|
Ккал/(Кмоль×К) |
|
КДж/(Кмоль×К) |
|
|||||||||||||||||||||||||||||||||||||||||||
|
одноатомный |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
20,8 |
|
||||||
|
двухатомный |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
20,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
29,1 |
|
||||||
|
Трёх- и много- |
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
29,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
37,4 |
|
|||||||
|
атомный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 12 -
www.mitht.ru/e-library
Для приближённых расчётов количества теплоты при не очень высоких температурах можно принять CX = const. В таком случае уравнения(4.9) примут вид:
|
QP M |
μCP t2 t1 VН |
μCP |
t2 t1 |
|
|
|
μ |
22,4 |
. |
(4.10) |
|
|
μCV t2 t1 VН |
μCV |
||
QV M |
t2 t1 |
|
|||
|
|
μ |
22,4 |
|
|
|
|
|
Задачи для самостоятельной работы. |
|
|
|
|
|||||
|
Задача |
4-1. Воздух, имеющий объём V |
= |
15 м3 |
при температуре |
|||||||
t1 = 1500°С и давлении P = 760 ммHg, охлаждается изобарически до температ- |
||||||||||||
ры t2 = 250°С. Определить отводимое тепло QP |
, если: 1. считать теплоёмкость |
|||||||||||
постоянной; |
2. использовать формулу μCP |
= 6,949 |
+ |
0,000576 |
× t, |
|||||||
Ккал/(Кмоль×К). |
|
|
|
|
|
|
|
|
|
|||
|
Задача 4-2. Расход воздуха измеряется с помощью электрического нагре- |
|||||||||||
вателя, установленного в воздухопроводе. Температура воздуха перед нагрева- |
||||||||||||
телем и за ним измеряется с помощью двух термометров. Определить часовой |
||||||||||||
расход воздуха G кг/ч, если при включении электрического нагревателя мощ- |
||||||||||||
ностью 0,75 кВт температура воздуха перед нагревателем T1 = 288 К, а за на- |
||||||||||||
гревателем T2 |
= 291,1 К. Определить также скорость потока воздуха за нагрева- |
|||||||||||
телем, если давление его (принимаемое неизменным) P = 870 ммHg, а диаметр |
||||||||||||
воздухопровода d = 90 мм. |
|
|
|
|
атмосфере чистого |
|||||||
|
Задача 4-3. В результате полного сгорания углерода в |
|||||||||||
кислорода |
в |
сосуде |
образовался |
углекислый |
газ |
при |
давлении |
равном |
||||
P = 6,04 бар и температуре равной T1 = 1673К. Какое количество тепла выде- |
||||||||||||
лится при остывании углекислого газа до температуры T2 = 293К? Определить |
||||||||||||
также какое давление установится в этом сосуде и какое давление имел кисло- |
||||||||||||
род в сосуде до сгорания, если температура его равнялась 10°С. Объём |
сосуда |
|||||||||||
принять неизменным и равным 5л. |
|
|
|
|
|
|
|
|
||||
|
Задача 4-4. Найти количество тепла необходимое для нагревания 1 н.м3 |
|||||||||||
газовой смеси состава: τ(CO2) = 14,5 %; τ(O2) = 6,5 %; τ(N2) = 79,0 % от 200 до |
||||||||||||
1200 °С при P = const и нелинейной зависимости теплоёмкости от температуры. |
||||||||||||
|
Задача 4-5. В закрытом сосуде ёмкостью равной V = 0,5 м3 содержится |
|||||||||||
диоксид углерода при давлении равном P = |
6 |
бар и температуре |
равной |
|||||||||
T = 800 К. Как изменится давление |
газа, если от него |
отнять 100 кал? Принять |
||||||||||
зависимость C = f(T) линейной. |
|
|
|
|
|
|
|
|
||||
|
Задача 4-6. Сосуд ёмкостью равной V = 90 л содержит воздух при давле- |
|||||||||||
нии равном P = 8 бар и температуре равной T = 303 К. Определить количество |
||||||||||||
тепла, которое необходимо сообщить воздуху, чтобы повысить его давление |
||||||||||||
при V = const до 16 бар. Принять зависимость C = f(T) нелинейной. Ответ дать в |
||||||||||||
кал.3 |
Задача 4-7. Какое количество тепла необходимо затратить, чтобы нагреть |
|||||||||||
2 м |
воздуха при постоянном избыточном давлении равном Pати = 2 бар от на- |
|||||||||||
чальной температуры равной t1 = 100 °С до конечной температуры равной |
||||||||||||
t2 = 500 °С? Какую работу при этом совершит воздух? Давление воздуха по ба- |
||||||||||||
рометру принять равным 760 ммHg. |
|
|
|
|
|
|
|
|
||||
|
Задача 4-8. При изобарическом нагревании от начальной температуры |
|||||||||||
равной T1 |
= 313 К до конечной температуры равной T2 = 1023 К однородный |
|||||||||||
газ совершает работу l |
= 184 кДж/кг. Определить какой это газ, |
какое количест- |
||||||||||
во тепла ему сообщено и как при этом изменилось его давление. |
|
|
|
|||||||||
Задача 4-9. В процессе подвода тепла при постоянном давлении температура 0,9 н.м3 азота повышается от начальной температуры равной T1 = 288 К до
- 13 -
www.mitht.ru/e-library
конечной температуры равной T2 = 1873 К. Определить изменение энтальпии азота и долю тепла, пошедшую на увеличение внутренней энергии.
Задача 4-10. В цилиндре с подвижным поршнем заключён кислород в количестве равном V = 0,3 н.м3 при температуре равной T1 = 318 К и давлении равном P1 = 776 ммHg. Некоторое количество тепла сообщается кислороду при P = const, а затем производится охлаждение до начальной температуры (318 К) при V = const. Определить количество подведённого тепла, изменения энтальпии, внутренней энергии и произведённую работу для обоих процессов, если известно, что в конце изохорического охлаждения давление кислорода равно P3 = 0,588 бар. Изобразите состояния газа в P-V и T-S координатах.
Пример. Воздух в количестве 6 м3 при давлении P1 = 3 бар и температуре t1 = 25°C нагревается в процессе P=const до t2 = 130°C. Определить количество подведенного тепла, считая C=const и С=f(t).
Решение.
QP MCP (t2 t1) VH CP' (t2 t1);
QP M(CPm t2 CPm t1) VH (CPm' t2 CPm' t1);
M (P1 V1 ) / (R T1) (3 105 6 28,96) / (8314 298) 21кг
VH (P1 V1 TH ) / (PH T1) (3 105 6 273) / (1,013 105 298) 16,3нм3
QP 21 (29,33/ 28,96) (130 25) 16,3 (29,33/ 22,4) (130 25) 2235,3кДж
QP 21 (1,0079 130 1,0042 25) 16,3 (1,3026 130 1,298 25) 2224,4кДж
Расхождение 0,48%.
Глава 5. Термодинамические процессы с идеальным газом.
Краткая теоретическая часть.
Термодинамический процесс – это взаимодействие термодинамической системы с окружающей средой в результате которого она переводится из начального состояния в конечное.
Если термодинамическую систему в которой протекает процесс можно вернуть в начальное состояние так, что во внешней среде не произойдёт никаких изменений, то мы имеем дело с обратимым процессом. Если же начальное состояние термодинамической системы без изменений во внешней среде невосстановимо, то мы имеем дело с необратимым процессом.
Только обратимые процессы могут быть изображены графически на диаграммах состояния, так как на них каждая точка представляет равновесное состояние.
В случае, когда теплота передаётся термодинамической системе, её принято считать положительной. Если же теплота отводится от системы, то её считают отрицательной.
В случае, когда работа совершается над системой, её принято считать отрицательной. Если же работа совершается системой, то её считают положительной.
Группа процессов, являющаяся при определённых условиях обобщающей для всех процессов и характеризующаяся постоянством теплоёмкости называются политропными.
Для всех термодинамических процессов устанавливается общий метод исследования, заключающийся в следующем:
1. выводится уравнение процесса;
2. устанавливается зависимость между основными параметрами состояния термодинамической системы;
3. определяется теплоёмкость процесса;
- 14 -
www.mitht.ru/e-library
4.определяются изменения функций состояния: внутренней энергии, энтальпии, энтропии;
5.вычисляются функции процесса: теплота и работа;
6.даётся графическая интерпретация термодинамических процессов в P-V и T-S координатах.
Основные соотношения характеристик процессов, согласно пп 1-5, представлены в таблице 5.1 – 5.3, а их графическая интерпретация на рис. 5.1
Таблица 5.1. Основные соотношения. Теплоёмкость.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение |
|
Связь между пара- |
|
Теплоёмкость, |
|
|
|||||||
|
Процесс |
|
процесса и |
|
|
|
||||||||||
|
|
показатель |
|
метрами состояния |
|
кДж/(кг×К) |
|
|
||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
политропы |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
PVn = const |
|
(V2/V1) = (P1/P2)1/n |
|
|
n k |
|
|
||||||
|
|
|
|
(T2 |
/T1) = (P2/P1)(n – |
|
|
|
|
|||||||
|
политропный |
|
n = ± ∞ |
|
|
|
|
1)/n |
|
|
|
CП CV n 1 |
|
|
||
|
|
|
|
|
|
|
(T2/T1) = (V1/V2)n – 1 |
|
|
|
|
|
||||
|
изохорный |
|
V = const |
|
|
P1/P2 = T1/T2 |
|
|
CV |
|
|
|||||
|
|
n = ± ∞ |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
изобарный |
|
P = const |
|
V1/V2 = T1/T2 |
|
|
CP |
|
|
||||||
|
|
n = 0 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
изотермический |
|
PV = const |
|
|
P1/P2 = V2/V1 |
|
|
± ∞ |
|
|
|||||
|
|
|
n = 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PVk = const |
|
(V2/V1) = (P1/P2)1/k |
|
|
|
|
|
||||||
|
адиабатный |
|
|
(T2 |
/T1) = (P2/P1)(k – |
|
|
0 |
|
|
||||||
|
|
n = k |
|
|
|
|
1)/k |
|
|
|
|
|
|
|||
|
|
|
|
|
(T2/T1) = (V1/V2)k – 1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.2. |
||
|
|
|
|
|
|
|
|
|
Изменения функций состояния. |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Процесс |
|
|
u, кДж/кг |
|
h, кДж/кг |
|
s, кДж/кг×К |
|
|
||||||
|
политропный |
|
|
CV |
T |
|
|
|
CP |
T |
|
CПln(T2/T1) |
|
|
||
|
изохорный |
|
|
CV |
T |
|
|
|
CP |
T |
|
CVln(T2/T1) |
|
|
||
|
изобарный |
|
|
CV |
T |
|
|
|
CP |
T |
|
CPln(T2/T1) |
|
|
||
|
изотермический |
|
0 |
|
|
|
|
0 |
|
|
|
Rln(V2/V1) |
|
|
||
|
адиабатный |
|
|
CV |
T |
|
|
|
CP |
T |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.3. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Функции процесса. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Процесс |
|
|
|
|
l, кДж/кг |
|
|
|
q, кДж/кг |
|
|
||||
|
политропный |
|
|
(P1v1 – P2v2)/(n – 1) |
|
|
|
CП |
T |
|
|
|||||
|
изохорный |
|
|
|
|
0 |
|
|
|
|
|
CV |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 15 - |
|
|
|
|
|
|
|
|||
www.mitht.ru/e-library

|
|
|
|
|
|
изобарный |
P v = R T |
CP T |
|
|
изотермический |
P1v1ln(V2/V1) |
T s = RTln(V2/V1) |
|
|
адиабатный |
(P1v1 – P2v2)/(k – 1) |
0 |
|
|
|
|
|
|
Рис. 5.1.
Политропные процессы.
Задачи для самостоятельной работы.
|
Задача 5-1. В замкнутом помещении объёмом V = 25 м3 находится воздух |
|||
при давлении равном P1 = 730 ммHg и температуре равной T1 = 283 К. В ре- |
||||
зультате подвода тепла давление воздуха в помещении возросло до P2 = 2,3 бар. |
||||
Определить количество подведённого тепла QV, изменения внутренней энергии |
||||
U и энтальпии |
H. |
|
|
|
|
Задача 5-2. 6 кг азота совершают в процессе изобарического расширения |
|||
работу LP = 343 кДж. Определить изменение внутренней энергии азота |
U, ес- |
|||
ли его начальная температура равна T1 = 373 К. |
|
|
||
Pати |
Задача 5-3. Оксид углерода находится при избыточном давлении равном |
|||
= 3,92 бар и занимает объём равный V = 5 м3. Барометрическое давление |
||||
при этом равно B = 755 ммHg. Определить изменение внутренней энергии U и |
||||
количество затраченной работы LP, если оксид углерода будет изобарически |
||||
охлаждён от начальной температуры равной T1 = 573 К до конечной темпера- |
||||
туры равной T2 |
= 373 К. |
|
кисло- |
|
|
Задача 5-4. Как изменится внутренняя энергия и энтальпия 20 н.м3 |
|||
рода при изобарическом нагревании от 373 К до 1173 К, если давление состав- |
||||
ляет 9,8 бар? Какова совершённая газом работа? |
|
|
||
|
Задача 5-5. 0,6 н.м3 воздуха при изобарическом подводе тепла совершают |
|||
работу равную LP = 15,68 кДж. Определить конечную температуру и объём |
||||
воздуха, если в начальном состоянии его температура и давление были соответ- |
||||
ственно равны: T1 = 293 К, P1 = 4,42 бар. |
|
|
||
|
Задача 5-6. Азот, имеющий начальный объём равным v1 = 1,9 м3/кг и на- |
|||
чальную температуру равной T1 = 473 К, нагревается при постоянном давлении |
||||
до состояния, когда его объём становится равным v2 |
= 5,7 м3/кг. Определить |
|||
конечную температуру. |
= 353 К и давлении рав- |
|||
ном |
Задача 5-7. Кислород при температуре равной T1 |
|||
B = 320 |
ммHg сжимается при T = const до |
избыточного давления |
||
Pати |
= 12 бар. Во сколько раз уменьшится объём кислорода, если барометриче- |
|||
ское давление равно B = 745 ммHg. |
|
|
||
|
|
- 16 - |
|
|
www.mitht.ru/e-library
Задача 5-8. 10 кг |
кислорода расширяются при |
температуре |
равной |
|||
T = 423 К = const от начального давления 14,7 бар и |
производят |
работу |
||||
2969,4 кДж. Определить давление в конце расширения и изобразить процесс в |
||||||
P-V и T-S координатах. |
|
|
|
|
|
|
Задача 5-9. Баллон с водородом, имеющем начальную температуру 278 К |
||||||
вносится в помещение с температурой 298 К. Определить изменения |
H, |
S, а |
||||
также количество тепла, полученное газом после выравнивания температуры, |
||||||
если начальное давление газа в баллоне 120 бар, а объём |
баллона |
40 дм3. Изо- |
||||
бразить процесс в P-V и T-S координатах. |
|
|
|
|
азота |
|
Задача 5-10. В цилиндре с подвижным поршнем заключено 3,5 м3 |
||||||
при давлении 1,47 бар. В процессе изотермического сжатия отводится 461 кДж |
||||||
тепла. Определить давление и объём азота в конце сжатия. |
|
|
|
|
|
|
Задача 5-11. 0,4 кг воздуха при начальной температуре 573 К и давлении |
||||||
1,98 бар расширяются изотермически до удельного объёма 1,68 м3/кг, а затем |
||||||
сжимаются изобарически, и, путём изохорического нагревания возвращаются в |
||||||
исходное состояние. Определить для каждого процесса |
H, |
U и |
S, а также |
|||
теплоту и работу. Определить также параметры P, V и T для всех точек и изо- |
||||||
бразить процессы в P-V и T-S координатах. |
|
|
|
|
|
|
Задача 5-12. 0,3 н.м3 |
воздуха изотермически сжимаются от начального со- |
|||||
стояния P1 = 7,35 бар; T1 |
= 573 К до конечного состояния P2; V2. Определить |
|||||
значения P2 и V2, если известно, что в процессе изотермического сжатия было |
||||||
отведено 167,6 кДж тепла. Определить также изменение внутренней энергии и |
||||||
энтальпии воздуха. |
|
|
|
|
|
|
Задача 5-13. 1 н.м3 воздуха адиабатически расширяется от начального со- |
||||||
стояния 1 (P1 = 6 ата; t1 = 300 °С) до состояния 2, причём v2 |
= 3v3. Затем он |
|||||
сжимается изотермически до начального значения удельного |
объёма v3 |
= v1. |
||||
Определить параметры P, V и T точек 1, 2 и 3 и суммарную работу произведён- |
||||||
ную газом. Представить процесс в P-V и T-S координатах. |
|
|
|
|
|
|
Задача 5-14. Работа, затраченная на адиабатическое сжатие 3 кг воздуха, |
||||||
составляет – 471 кДж. Начальное состояние воздуха характеризуется парамет- |
||||||
рами T1 = 288 К и P1 = 1 бар. Определить конечную температуру и изменения |
||||||
внутренней энергии. |
|
|
|
|
|
|
Задача 5-15. При адиабатном расширении 1 кг воздуха (k = 1,4) темпера- |
||||||
тура его падает на 120 градусов. Определить работу расширения и количество |
||||||
тепла, которое нужно подвести к воздуху, чтобы ту же работу получить при |
||||||
изотермическом сжатии. |
|
|
|
|
|
|
Задача 5-16. 1 кг воздуха при давлении равном P1 = 4 бар и температуре |
||||||
равной T1 = 373 К расширяется до конечного давления P2 |
= 1 бар. Определить |
|||||
конечную температуру, количество тепла и совершённую работу, если расширение происходит: 1. изохорно; 2. изотермически; 3. адиабатно; 4. политропно с показателем политропы n = 1,2. Изобразить процессы в P-V и T-S координатах.
Задача 5-17. В баллоне ёмкостью 100 л находится воздух при давлении равном P1 = 50 бар и температуре равной T1 = 293 К. Давление окружающей среды P2 = 1 бар. Определить полезную работу, которая может быть произведена воздухом при его расширении до давления окружающей среды по изотерме и по адиабате, а также конечную температуру воздуха в баллоне после адиабатного расширения.
Задача 5-18. 1 кг воздуха при температуре равной T1 = 290 К сжимается адиабатно до объёма, составляющего 1/5 часть от начального, а затем расширяется изотермически до начального объёма. Определить работу, произведённую воздухом в результате обоих процессов. Изобразить процессы в P-V и T-S координатах.
- 17 -
www.mitht.ru/e-library

|
Задача 5-19. При политропном расширении 1 киломоль газа его объём |
||||||||
увеличился на 20 %, а абсолютная температура уменьшилась на 12 %. Опреде- |
|||||||||
лить показатель политропы, величину работы LП, если начальная температура |
|||||||||
равна T1 = 490 К. |
|
|
|
|
|
|
|
|
|
|
Задача 5-20. К 1 кг воздуха при его сжатии в политропном процессе под- |
||||||||
ведено 50 кДж/кг тепла. Определить показатель политропы, изменение внут- |
|||||||||
ренней энергии и работу сжатия, если температура воздуха увеличилась в про- |
|||||||||
цессе на 100 К. |
|
|
|
|
|
|
|
|
|
2 |
Задача 5-21. В цилиндре, площадь поперечного сечения которого равна 1 |
||||||||
дм |
, под поршнем находится ½ киломоль азота при температуре 336 К. Пор- |
||||||||
шень находится под постоянной внешней нагрузкой равной P = 2 кН. Газу из- |
|||||||||
вне сообщается тепло равное Q = 6300 кДж, вследствие чего он расширяется и |
|||||||||
отодвигает поршень. Определить параметры P, v, T в конце процесса, измене- |
|||||||||
ние внутренней энергии |
U, изменение энтальпии |
H, а также работу расши- |
|||||||
рения, совершённую газом. |
|
|
|
|
|
|
|||
|
Задача 5-22. 1 кг азота в начальном состоянии имеет параметры: P1 = 25 |
||||||||
бар и T1 = 973 К. После политропного расширения |
с показателем |
политропы n |
|||||||
= 1,18 давление азота становится равным 1 бар. Определить U и |
H процесса, |
||||||||
а также количество тепла qП |
и работу расширения lП. |
|
|||||||
|
Пример 5-1. Воздух, имеющий объём равный V1 = 0,01 м3 при давлении |
||||||||
равном P1 = 10 бар и температуре равной T1 = 298 К расширяется в цилиндре с |
|||||||||
подвижным поршнем до давления P |
2 = 1 бар. Определить конечный объём, |
||||||||
температуру, работу расширения, подведённое тепло, изменение внутренней |
|||||||||
энергии, энтальпии и энтропии, если |
расширение |
происходит: 1. |
изотермиче- |
||||||
ски; 2. адиабатически; 3. политропно с показателем политропы n = 1,3. Изобра- |
|||||||||
зить процессы в P-V и T-S координатах. |
|
|
|||||||
|
Решение. |
|
расширение |
|
|
|
|||
|
а) Изотермическое |
|
|
|
|||||
|
Объем в конце расширения |
|
|
||||||
|
|
|
V V (P / P ) 0,01 10 /1 0,1м3 |
|
|||||
|
|
|
|
2 |
1 |
2 |
1 |
|
|
|
Работа расширителя |
|
|
|
|
|
|||
|
L PV ln(P / P ) 10 105 0,01 ln10 23000Дж 23КДж |
||||||||
|
1 |
1 |
1 |
2 |
|
|
тепла |
|
|
|
Количество подведенного |
|
|
||||||
|
|
|
|
|
|
QT |
L 23КДж |
|
|
|
Так как T1 = T2 = 298К, то h 0 и U 0 . Изменение энтропии |
||||||||
|
|
S Q /T 23КДж/ 298К 0,07718КДж / К |
|
||||||
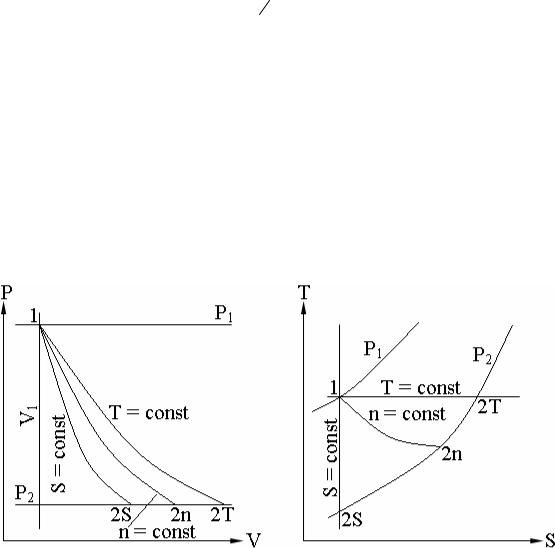
б) Адиабатическое расширение. Масса газа в цилиндре
M (P1 V1 ) / (R T1) (10 105 0,01 29) / (8314 298) 0,117кг.
Конечный объем
V2 V1(P1 / P2 )1k 0,01 10 11,14 0,05188м3 .
Температура воздуха в конце процесса
T2 T1 (P2 / P1)k 1k 298 (1/10)0,286 154,3K .
Работа газа при расширении
L (P1V1) / (к 1) 1 (P2 / P1)k 1k (10 105 0,01) / (1,4 1) 1 (1/10)0,286 12КДж
Изменение в процессе составило:энтальпии
h CP (T2 T1) 1,056 (154,3 298) 151,75КДж/ кг;H M h 0,117 ( 151,75) 17,5КДж ;
внутренней энергии
- 18 -
www.mitht.ru/e-library
u CV (T2 T1) 0,7123 (154,3 298) 102,36КДж/ кг;
U M u 11,98КДж.
При определении изменения функций состояния, ввиду небольшого изменения температуры в процессе, зависимостью теплоемкости от температуры пренебрегаем.
В случаях, когда изменение теплоемкости от температуры велико, следует пользоваться их значениями, приведенными в таблицах, см. приложение.
в) Политропное расширение, n=1,3. Конечный объем
V2 V1(P1 / P2 )1n 0,01 100,769 0,0589м3
Конечная температура
T2 (P2 V2 M) / M R (1 105 0,0589 29) / (0,117 8314) 175,2K
Работа газа при расширении
|
PV |
|
|
P |
|
n 1 |
|
|
10 105 0,01 |
|
|
1 |
0,23 |
|
||||
|
n |
|
|
|
|
|||||||||||||
L |
1 1 |
1 |
|
2 |
|
|
|
|
1 |
|
|
|
|
|
13,7КДж |
|||
P |
1,3 1 |
10 |
||||||||||||||||
|
n 1 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подведенное тепло удельное и полное равно: |
|
|
||||||||||||||||
qП CV (n k) / (n 1) (T2 T1) 0,71 (1,3 1,4) / (1,3 1) (175,2 298) 29,16КДж / кг QП MqП 0,117 29,16 3,41КДж
U CV M (T2 T1) 0,7123 0,177 (175,2 298) 10,234КДжH CP M (T2 T1) 1,056 0,117 (175,2 298) 15,17КДж
Графически процессы в PV и TS координатах изображены на рис. 5.2
Рис. 5.2.
Глава 6. Второе начало термодинамики.
Краткая теоретическая часть.
Первый закон термодинамики, являясь частным случаем общего закона сохранения и превращения энергии констатирует наличие процессов превращения видов энергии и ее сохранение, но не устанавливает условий, при которых эти превращения возможны.
Второй закон термодинамики устанавливает, что самопроизвольные процессы возможны лишь в том случае, когда в системе нет равновесия и что эти процессы всегда протекают в направлении, при котором система при-
- 19 -
www.mitht.ru/e-library
ближается к равновесному состоянию, т.е. он указывает направленность про-
цесса.Теплота и работа являются формами передачи энергии: первая, связанная с движением молекул и атомов – микроскопическая форма передачи энергии, а вторая, связанная с перемещением тела или его частей – макрофизической. Теплота и работа не являются равноценными формами передачи энер-
гии. Работа полностью превращается в теплоту.
Превращение теплоты в работу, например, в тепловых машинах, проис-
ходит только при наличии разности температур между источником теплоты и теплоприемником, причем не вся теплота превращается в работу.
Все виды энергии в конечном счете превращаются в теплоту, которая затем рассеивается в окружающей среде. Мера этого рассеивания или обесценивания энергии называется энтропией.
Таким образом, для превращения теплоты в работу необходимо иметь два источника теплоты: один – с высокой температурой, а другой – с низкой температурой, и работа тепловой машины должна быть цикличной, т.е. рабочее тело, совершая ряд процессов должно возвращаться в исходное состояние, рис. 6.1.
Цикл, в результате которого получается положительная работа называет-
ся прямым циклом или циклом теплового двигателя; в нем работа расшире-
ния больше работы сжатия.
Циклы, в результате которых расходуется работа, называются обратными; в них работа сжатия больше работы расширения и они используются в хо-
лодильных установках и тепловых насосах.
Циклы тепловых машин характеризуются термическим коэффициен-
η |
qВЫС qНИЗ |
l |
|
1 |
qНИЗ |
. |
(6.1) |
|||||||
|
|
|
|
|||||||||||
T |
|
|
qВЫС |
|
qВЫС |
|
qВЫС |
|
||||||
|
|
|
|
|
|
|||||||||
а обратных циклов – коэффициентом эффективности: |
|
|||||||||||||
|
ε |
Х |
|
|
|
qНИЗ |
|
|
qНИЗ |
; |
|
(6.3) |
||
|
|
qВЫС qНИЗ |
|
|||||||||||
|
|
|
|
|
l |
|
|
|
|
|||||
|
ε |
Т |
|
|
|
qВЫС |
|
|
qВЫС . |
(6.4) |
||||
|
qВЫС qНИЗ |
|||||||||||||
|
|
|
|
l |
|
|
|
|
||||||
Цикл, который позволяет получить наибольшие коэффициенты (см. фор-
мулы (6.1) – (6.3)), вошел в историю как цикл Карно и он состоит из двух изотерм и двух адиабат.
Задачи для самостоятельного решения.
Задача №6-1. Машина, в цилиндре которой 1 кг воздуха, работает по циклу Карно в пределах температур Т1 = 523 К и Т2 = 303 К. Максимальное давление Р1 = 10 бар, а минимальное – Р2 = 1,2 бар. Определить параметры состояния воздуха в характерных точках цикла, количество подведенного и отведенного тепла, работу и термический КПД цикла.
Задача №6-2. К газу в круговом процессе подведено 250 кДж тепла, а термический КПД цикла равен 0,46. Определить работу цикла.
Задача №6-3. Сравните между собой два цикла, каждый из которых состоит из трех процессов: изотермического, адиабатного и изохорного (см. рис. 6.1).
- 20 -
www.mitht.ru/e-library
