
1090
.pdf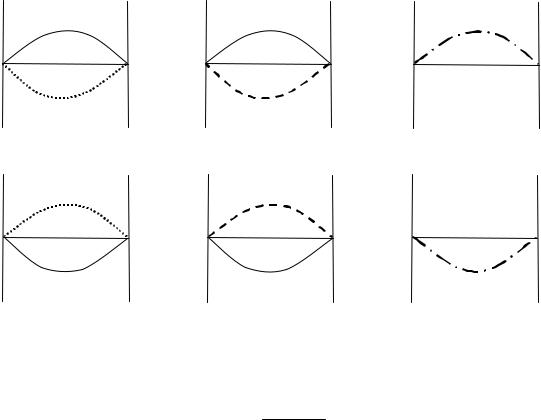
ные растворы gЕ(х)=0 (рис. 4). Для обозначения граничных линий будем использовать косую черту между номерами соседних секто-
ров (например, II/III, V/VI и т.д.).
(а) |
|
(б) |
|
фЕ |
(в) |
фЕ |
|
фЕ |
|
|
|
0 |
1 |
0 |
1 |
0 |
1 |
II/III |
|
Ia/II |
|
|
Iб/VI |
фЕ |
|
фЕ |
|
фЕ |
|
0 |
1 |
0 |
1 |
0 |
1 |
V/VI |
IVa/V |
III/IVб |
Рис. 4. Бинарные растворы, соответствующие граничным элементам плоскости энергетического баланса:
а) атермические; б) регулярные; в) компенсированные.
 hЕ
hЕ  T sЕ gЕ
T sЕ gЕ  hЕ= T sЕ
hЕ= T sЕ
Компенсированные, атермические и регулярные растворы ма-
ло распространены. Компенсированные растворы (III/IVб, VI/Iб)
проявляют себя как идеальные системы, однако их образование со-
провождается тепловыделением (теплопоглощением) и изменением энтропии. Парожидкостное равновесие таких систем подчиняется закону Рауля. Это единственный класс растворов, в котором невоз-
можно существование азеотропов. Границе подсекторов IVа и IVб, Iа и Iб отвечает условие для избыточной молярной теплоемкости:
cPE(х) 0.
11
http://www.mitht.ru/e-library
В таблице 1 представлены знаки и соотношения величин фЕ
на различных элементах ПЭБ при Р=const, T=const и условии сохра-
нения знаков величин на всем концентрационном диапазоне.
Таблица 1. Соотношение знаков и величин избыточных термодинамических функций бинарных растворов на плоскости энергетического баланса.
Элемент |
|
|
Знаки избыточных |
|
Соотношение |
||||||||
ПЭБ |
|
термодинамических функций |
величин |
||||||||||
Iб |
|
E |
Е |
Е |
|
Е |
Е |
|
|
Е |
E |
||
|
g >0 |
h >0 |
T s >0 |
ср |
< 0 |
h >T s > g |
|||||||
Iа / Iб |
|
E |
Е |
Е |
|
Е |
E |
|
|
|
Е |
||
|
g >0 |
h >0 |
T s >0 |
ср |
= 0 |
g |
|
= T s |
|
||||
Iа |
|
E |
Е |
Е |
|
Е |
Е |
|
E |
Е |
|||
|
g >0 |
h >0 |
T s >0 |
ср |
> 0 |
h > g >T s |
|||||||
Iа / II |
|
E |
Е |
Е |
|
Е |
|
|
E |
|
Е |
||
|
g >0 |
h >0 |
T s =0 |
ср |
> 0 |
g |
|
= h |
|
|
|||
II |
|
E |
Е |
Е |
|
Е |
|
|
E |
|
Е |
||
|
g >0 |
h >0 |
T s <0 |
ср |
> 0 |
g |
|
> h |
|
|
|||
II / III |
|
E |
Е |
Е |
Е |
E |
|
|
|
E |
|||
|
g >0 |
h =0 |
T s <0 |
ср |
> 0 |
g = |
T s |
|
|
||||
III |
gE>0 |
hЕ<0 |
T sЕ<0 |
срЕ> 0 |
hE < T sE |
||||||||
|
|
|
|
|
|
||||||||
III / IVб |
gE=0 |
hЕ<0 |
T sЕ<0 |
срЕ> 0 |
hE = T sE |
||||||||
|
|
|
|
|
|
||||||||
IVб |
gE<0 |
hЕ<0 |
T sЕ<0 |
срЕ> 0 |
hE > T sE > gE |
||||||||
|
|
|
|
|
|
||||||||
IVб / IVа |
gE<0 |
hЕ<0 |
T sЕ<0 |
срЕ= 0 |
gE = T sЕ |
||||||||
|
|
|
|
|
|
||||||||
IVa |
gE<0 |
hЕ<0 |
T sЕ<0 |
срЕ< 0 |
hE > gE > T sE |
||||||||
|
|
|
|
|
|
||||||||
IVa / V |
gE<0 |
hЕ<0 |
T sЕ=0 |
срЕ< 0 |
gE = hE |
||||||||
|
|
|
|
|
|
||||||||
V |
gE<0 |
hЕ<0 |
T sЕ>0 |
срЕ< 0 |
gE > hE |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
V / VI |
|
E |
Е |
Е |
Е |
E |
|
|
|
E |
|||
|
g <0 |
h =0 |
T s >0 |
ср |
< 0 |
g |
= T s |
||||||
VI |
|
E |
Е |
Е |
Е |
|
E |
|
|
|
E |
||
|
g <0 |
h >0 |
T s >0 |
ср |
< 0 |
h < T s |
|
||||||
VI / Iб |
|
E |
Е |
Е |
Е |
|
E |
|
|
|
E |
||
|
g =0 |
h >0 |
T s >0 |
ср |
< 0 |
h |
|
|
= T s |
|
|||
Ид. |
gE=0 |
hЕ=0 |
T sЕ=0 |
срЕ= 0 |
|
|
|
|
|
|
|
||
раствор |
|
|
|
|
|
|
|
|
|
|
|
|
|
Если зависимость фЕ(х) имеет два экстремума, т.е. является зна-
копеременной и пересекает границу секторов, то говорят о гибрид-
ном растворе (рис. 5). Здесь нулевое значение избыточной функции
12
http://www.mitht.ru/e-library

наблюдается при единственном составе. Различные концентраци-
онные области таких систем относятся к соседним элементам плос-
кости энергетического баланса. Будем обозначать их следующим образом: Ia–Ia/II–II (или Ia–II), II–II/III–III (или II–III) и т.п.
(а) |
|
(б) |
|
|
(в) |
|
фЕ |
|
фЕ |
фЕ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
0 |
1 |
0 |
1 |
|
1 |
|
|
|
|
||||
|
|
|
||||
|
II |
II/Ia Ia |
|
|
|
|
|
|
|
IVб |
IVб/III III |
|
|
|
|
III III/II II |
|
|
|
|
|
||||
фЕ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фЕ |
|
|
|
|
|
|
|
|||
|
|
|
фЕ |
|
|
|||||||
0 |
|
|
1 |
0 |
1 |
|
|
|
|
|
|
|
|
|
|
0 |
|
|
1 |
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
IVa IVa/V V |
V V/VI VI |
VI VI/Iб Iб |
|
Рис. 5. Знакопеременные концентрационные зависимости избыточных термодинамических функций:
а) T sЕ(х); б) hЕ(х); в) gЕ(х).
hЕ |
T sЕ |
|
gЕ |
hЕ= T sЕ |
|
Следует упомянуть и о существовании концентрационных за-
висимостей фЕ(х) с тремя экстремумами, которые здесь не рас-
сматриваются. Такие экспериментальные данные получены, в ос-
новном, для избыточных изобарных молярных теплоемкостей.
Избыточные термодинамические функции можно выразить че-
рез коэффициенты активности компонентов i в жидкой фазе:
13
http://www.mitht.ru/e-library

gЕ = |
|
RT (x1 ln 1 |
+ x2 ln 2), |
|
|
|
|
|
|
(8) |
|||||||||||
hE RT2 |
|
ln |
1 |
|
|
|
|
ln |
2 |
|
|
|
|
|
|
|
|
|
|||
x |
|
|
x |
|
|
, |
|
|
|
|
|
(14) |
|||||||||
|
T |
|
T |
|
|
|
|
|
|
||||||||||||
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||
|
ln |
1 |
|
|
ln |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
sE RT x |
|
x |
|
|
|
|
|
R x ln |
|
x |
|
ln |
|
. |
(15) |
||||||
T |
|
2 T |
|
|
|
|
|||||||||||||||
1 |
|
|
|
|
|
1 |
|
|
|
1 |
|
2 |
|
2 |
|
|
|||||
Поэтому характер изменения величин |
ln i |
T |
может дополнить |
||||||||||||||||||
анализ поведения растворов и при изменении температуры (табл.
2).
Таблица 2. Изменение коэффициентов активности в бинарных неидеальных смесях разных классов.
Класс |
|
|
|
Значения величин |
|
|
|
|||
эквивалентности |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
ln 1 |
ln 2 |
ln 1/ T |
ln 2/ T |
gЕ |
hE |
sE |
||
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
Iб, Iб/Ia, Ia |
>1 |
>1 |
>0 |
>0 |
<0 |
<0 |
>0 |
>0 |
>0 |
|
|
|
|
|
|
|
|
|
|
|
|
Ia /II |
>1 |
>1 |
>0 |
>0 |
<0 |
<0 |
>0 |
>0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
II |
>1 |
>1 |
>0 |
>0 |
<0 |
<0 |
>0 |
>0 |
<0 |
|
|
|
|
|
|
|
|
|
|
|
|
II / III |
>1 |
>1 |
>0 |
>0 |
0 |
0 |
>0 |
0 |
<0 |
|
|
|
|
|
|
|
|
|
|
|
|
III |
>1 |
>1 |
>0 |
>0 |
>0 |
>0 |
>0 |
<0 |
<0 |
|
|
|
|
|
|
|
|
|
|
|
|
III / IVб |
1 |
1 |
0 |
0 |
>0 |
>0 |
0 |
<0 |
<0 |
|
|
|
|
|
|
|
|
|
|
|
|
IVб, IVб/IVa, IVa |
<1 |
<1 |
<0 |
<0 |
<0 |
<0 |
<0 |
<0 |
<0 |
|
|
|
|
|
|
|
|
|
|
|
|
IVa/V |
<1 |
<1 |
<0 |
<0 |
<0 |
<0 |
<0 |
<0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
V |
<1 |
<1 |
<0 |
<0 |
<0 |
<0 |
<0 |
<0 |
>0 |
|
|
|
|
|
|
|
|
|
|
|
|
V/VI |
<1 |
<1 |
<0 |
<0 |
0 |
0 |
<0 |
0 |
>0 |
|
|
|
|
|
|
|
|
|
|
|
|
VI |
<1 |
<1 |
<0 |
<0 |
<0 |
<0 |
<0 |
>0 |
>0 |
|
|
|
|
|
|
|
|
|
|
|
|
VI/Iб |
1 |
1 |
0 |
0 |
<0 |
<0 |
0 |
>0 |
>0 |
|
|
|
|
|
|
|
|
|
|
|
|
Представленные на рисунках 1, 2 ,4 и 5 примеры концентраци-
онных зависимостей избыточных функций относятся к гомогенным жидким растворам. В расслаивающихся смесях концентрационные зависимости избыточных функций (например, энтальпии) имеют
14
http://www.mitht.ru/e-library

линейный участок, соответствующий области сосуществования двух
жидких фаз (рис. 6).
Е |
фЕ |
ф |
|
х1 ''
0 |
1 |
|
х1 '
0 |
х1 |
' |
х1 |
'' |
1 |
Рис. 6. Избыточные функции расслаивающихся смесей. х1 ', х1 '' – границы расслаивания
Условие появления критической точки при постоянных Р, Т:
|
2 gE kp |
|
RT |
|
|
|
2 gE kp |
|
RT |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x2 |
x x |
|
0 |
или |
x2 |
x x |
< 0 |
(16) |
||||||
|
|
2 |
|
|
||||||||||
|
1 |
|
1 |
|
|
|
1 |
|
1 2 |
|
|
|||
означает, что в расслаивающихся смесях gЕ(х)>0. Условие (16)
может быть выражено в терминах избыточных энтальпии и энтро-
пии для верхней критической точки растворимости (ВКТР) как
|
2 hE kp |
|
|
2 sE kp |
|
R |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
x2 |
0, |
x2 |
x x |
. |
(17) |
|||||||
|
|
|
|
|||||||||
|
1 |
|
|
|
1 |
|
1 |
2 |
|
|
||
Таким образом, избыточная энтропия может принимать как положи-
тельные, так и отрицательные значения, а величина избыточной эн-
тальпии должна быть строго положительной. Этим условиям отве-
чают растворы, относящиеся к классам эквивалентности I, I–II и II.
Для реализации нижней критической точки растворимости
(НКТР) должны выполняться следующие условия:
|
2 hE kp |
|
|
2 sE kp |
|
R |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
x2 |
0, |
x2 |
x x |
. |
(18) |
|||||||
|
|
|
|
|||||||||
|
1 |
|
|
|
1 |
|
1 |
2 |
|
|
||
15
http://www.mitht.ru/e-library
Знаки обеих избыточных функций строго отрицательны. Это усло-
вие выполняется для растворов, относящихся к сектору III плоско-
сти энергетического баланса. Системы с двумя критическими точка-
ми растворимости (ВКТР, НКТР) характеризуются знакопеременны-
ми зависимостями hЕ(х ), т.е. относятся к гибридным растворам II–
III.
Увеличение взаимной растворимости жидкостей при повыше-
нии температуры (системы с ВКТР) – более распространенный слу-
чай (спирты – н-алканы, вода – высшие спирты, вода – н-алканы и др.). Системы с НКТР, в которых при увеличении Т взаимная рас-
творимость уменьшается (вода – триэтиламин), и системы с замкну-
тыми областями расслаивания с двумя критическими точками (вода
– никотин, вода – 2-бутоксиэтанол, вода – тетрагидрофуран), доста-
точно редки.
3. Влияние температуры на избыточные термодинамические функции
Под воздействием температуры происходят различные преоб-
разования структуры растворов, что находит отражение в измене-
нии избыточных термодинамических функций в соответствии с уравнениями (10) – (15). При этом возможно либо количественное изменение абсолютных величин фЕ(х) в пределах одного класса эквивалентности растворов, либо «перемещение» системы по плос-
кости энергетического баланса из одного класса в другой.
Этот переход может осуществляться по двум вариантам: че-
рез состояние, при котором для всех составов раствора реализует-
ся нулевое значение избыточной функции (рис. 7а), и через «гиб-
ридный» раствор, в котором ее нулевое значение наблюдается при единственном составе (рис. 7б). Оба варианта могут реализоваться для любой избыточной термодинамической функции. Отметим, что
16
http://www.mitht.ru/e-library

преобразование концентрационных зависимостей фЕ(х) бинарного раствора через состояние фЕ(х)=0 среди реальных объектов встре-
чаются крайне редко и более характерно для избыточных молярных теплоемкостей срЕ(х).
(а)
фЕ |
фЕ |
фЕ |
0 |
1 |
0 |
1 |
0 |
1 |
Iа |
|
Iа / Iб |
|
|
Iб |
(б)
фЕ |
|
|
фЕ |
|
|
фЕ |
|
|
|
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
1 |
|
1 |
|
|
|
|
|
1 |
||
|
|
|
|
|
0 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
III – III/II – II |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
Рис. 7. |
Возможные преобразования зависимостей фЕ(х) |
|
|||||||||||
под влиянием температуры: а) срЕ (х) 0 срЕ (х)=0 срЕ(х) 0 ;
б) hЕ(х) 0 hЕ(х)><0 hЕ(х)>0.
 hЕ
hЕ  T sЕ gЕ
T sЕ gЕ  срЕ=0
срЕ=0
Возможные варианты эволюции зависимостей фЕ(х, Т) полу-
чены при рассмотрении локальных закономерностей концентраци-
онных зависимостей избыточных термодинамических функций в ок-
рестности точек чистых компонентов с использованием парциаль-
ных величин. Избыточные парциальные молярные функции ф1Е , ф2E
при постоянных температуре и давлении определяются по уравне-
ниям:
17
http://www.mitht.ru/e-library

|
|
Е |
фЕ х |
|
фЕ |
, |
|
|
|
Е |
фЕ х |
фЕ |
(19) |
|||
|
ф |
|
ф |
|||||||||||||
|
|
|
|
х |
|
х |
||||||||||
1 |
2 |
|
|
|
|
|
2 |
1 |
|
|||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
и связаны соотношением |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Е |
х |
|
Е |
х фЕ . |
|
(20) |
|||||
|
|
|
|
ф |
ф |
|
||||||||||
|
|
|
|
1 |
1 |
|
|
2 |
2 |
|
|
|
|
|||
Определение парциальных величин в точках чистых компонен-
тов дает исчерпывающую информацию об изменении самих парци-
альных термодинамических функций, а также их производных по со-
ставу, что позволяет в рамках одного класса эквивалентности сис-
тем выделить их геометрические типы.
При варьировании температуры возможны два варианта по-
следовательных переходов геометрических типов концентрацион-
ных зависимостей избыточных парциальных молярных функций,
различающиеся очередностью реализации условий (21)–(24):
|
|
|
|
|
1Е |
х1 х 0 0 |
(21) |
||||
ф |
|||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
Е |
|
0 |
(22) |
||
|
|
ф |
(х 0) |
||||||||
1 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2Е(х 0) |
0 |
(23) |
|||
|
|
|
ф |
||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2Е |
х1 х |
0 0. |
(24) |
||||||
ф |
|||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
На рис. 8 представлен вариант с последовательной реализа-
цией граничных условий (21) (22) (23) (24). Выполнение условий
(21) и (24) соответствует границе перехода от зависимости моно-
тонного вида к экстремальному, причем для обоих компонентов экс-
тремумы появляются одновременно при одной и той же концентра-
ции. Выполнение условий (22) и (23) отвечает границе перехода к знакопеременной зависимости фЕ(х), характеризующейся разны-
ми знаками второй производной избыточной функции по составу.
Такие зависимости наблюдаются в некотором диапазоне темпера-
тур и область их существования ограничена с двух сторон условия-
ми:
18
http://www.mitht.ru/e-library

. |
(a ) |
|
|
|
|
(б) |
|
|
|
|
|
(в) |
||||||
|
|
Еi |
|
|
|
|
|
Е |
|
|
|
|
|
|
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
0 |
|
i |
|
|
|
0 |
|
|
i |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Е |
|
|
|
Е |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
x1 |
|
|
|
x1 |
|
|
|
|
x1 |
|
|
|
|
(г) |
|
|
|
(д) |
|
|
|
|
(е) |
|
|
|
Е |
|
|
|
Е |
|
|
|
|
Е |
||
|
|
|
|
|
|||||||||
|
|
i |
|
|
|
i |
|
|
|
|
i |
||
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е |
|
Е |
|
|
Е |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x1 |
|
|
|
|
|
|
x1 |
|
|
|
|
|
|
|
x1 |
|||||
|
|
|
(ж) |
|
|
|
|
|
|
(з) |
|
|
|
|
|
|
|
(и) |
|||||
|
|
Еi |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
||
|
0 |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е |
|
|
|
|
Е |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
i |
|
|
|
|
i |
||||||||||||
Е |
Е |
|
|
|
|
|
|
Е |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
x1 |
|
|
|
|
|
|
x1 |
|
|
|
|
|
|
|
x1 |
|||||
Рис. 8. Эволюция концентрационных зависимостей полных фЕ
и парциальных фiE избыточных функций бинарных растворов. (пояснения в тексте)
19
http://www.mitht.ru/e-library
|
2 фЕ |
|
|
2 фЕ |
|
|
|||
|
|
|
0, |
|
|
|
0. |
(25) |
|
x2 |
x2 |
||||||||
|
|
|
|
||||||
|
1 |
x 0 |
|
|
1 |
x |
0 |
|
|
|
|
1 |
|
|
|
2 |
|
|
|
Подчеркнем, что на рис. 8 представлен теоретически возмож-
ный вариант полной эволюции концентрационной зависимости од-
ной из избыточных функций бинарного раствора, когда под влияни-
ем температуры меняется ее знак. Анализ политермических данных
фЕ(х, Т) конкретных смесей показывает, что такой сценарий эволю-
ции встречается достаточно редко. В большинстве случаев на прак-
тике реализуются преобразования геометрической формы кривых
фЕ(х) от симметричной (рис. 8 а, и) к асимметричной (рис. 8 в, ж)
или переход от знакопостоянной (рис. 8 г, е) к знакопеременной
(рис. 8 д) зависимости.
4. Бинарные растворы на плоскости энергетического баланса
Для отнесения конкретной системы к классу эквивалентности необходимы экспериментальные данные по парожидкостному рав-
новесию и теплотам смешения. Результаты калориметрических из-
мерений регулярно публикуются в специальной и справочной лите-
ратуре. Избыточная молярная энергия Гиббса определяется из дан-
ных парожидкостного равновесия бинарных систем, которые доста-
точно широко представлены в базах данных. Возможен также рас-
чет величин gЕ(х) по параметрам модельных уравнений при кон-
кретной температуре. Значения избыточной энтропии определяются по уравнению (7).
В таблице 3 приведены примеры бинарных гомогенных сме-
сей, относящиеся к различным классам эквивалентности, причем растворы с отрицательными величинами избыточной энергии Гиб-
бса (сектора IV VI) менее распространены. Необходимо отметить
20
http://www.mitht.ru/e-library
