
органика
.pdf
ацетон, трет-бутилметилкетон реакционная способность уменьшается.
H |
CH3 |
CH3 |
(CH3)3C |
||||||||
C |
|
O |
C |
|
O |
C |
|
O |
C |
|
O |
|
|
|
|
||||||||
|
|
|
|
||||||||
H |
H |
CH3 |
CH3 |
||||||||
2.2.1. Реакции с О-нуклеофилами
а) Гидратация
При взаимодействии альдегидов и кетонов с водой в обратимом процессе образуется гидрат – геминальный диол, который в большинстве случаев является очень нестабильным соединением, поэтому данное равновесие сильно смещено влево.
OH
R C=O  H2O
H2O  R C OH
R C OH
R' R'
Однако для некоторых карбонильных соединений это равновесие смещено вправо. Так, в водном растворе формальдегид практически полностью находится в гидратной форме (в отличие, например, от ацетона, в водном растворе которого гидратной формы чрезвычайно мало), а трихлоруксусный альдегид (хлораль) при взаимодействии с водой практически необратимо превращается в очень устойчивый даже в кристаллическом виде хлоральгидрат.
H2O
CH2=O  CH2(OH)2
CH2(OH)2
Cl3CCH=O + H2O 
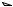 Cl3CCH(OH)2
Cl3CCH(OH)2
хлораль хлоральгидрат
б) Взаимодействие со спиртами – реакция ацетализации
61
www.mitht.ru/e-library

Спирты, как и вода, могут присоединяться по карбонильной группе альдегидов и кетонов, однако продукт присоединения молекулы спирта – так называемый полуацеталь – неустойчив. Если же проводить реакцию с избытком спирта в кислой среде, то образуется устойчивый продукт – ацеталь.
OH
R C=O + R" OH 
 R C OR"
R C OR"
R' R'
|
|
|
|
|
|
|
|
|
|
полуацеталь |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OR" |
||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||||||||||
R |
|
C=O + 2R" |
|
OH |
|
|
|
|
|
R |
|
C |
|
OR" |
|||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
R' |
|||||||
ацеталь
Приведем механизм реакции ацетализации на примере взаимодействия уксусного альдегида и метилового спирта в присутствии какой-либо сильной кислоты с образованием диметилацеталя уксусного альдегида.
|
CH3CH=O H |
|
|
H |
HO CH3 |
|
CH3CH OH |
CH3CH=O |
CH3CH OH |
_ H |
|
|
H O CH3 |
OCH3 |
|
|
CH3CH OH |
|
|
Протонирование карбонильной группы уксусного альдегида приводит к образованию катиона, в котором положительный заряд делокализован. По сравнению с уксусным альдегидом этот катион более электрофилен, и нуклеофильное присоединение молекулы метанола к нему происходит значительно легче. Аддукт является сильной кислотой, и при отщеплении от него протона образуется полуацеталь (1-метоксиэтанол). Далее через протонированную форму этого полуацеталя происходит отщепление воды с образованием карбокатиона, к которому присоединяется следующая молекула метанола. При депротонировании продукта присоединения образуется диметилацеталь уксусного альдегида (1,1-
диметоксиэтан).
62
www.mitht.ru/e-library

|
H |
|
H |
|
HO CH3 |
|
|
|
_H O |
||
CH3CH OH |
|
CH3CH O H |
CH3CH |
||
OCH3 |
|
OCH3 |
2 |
OCH3 |
|
|
|
||||
|
H |
|
|
|
|
|
CH3CH OCH3 _ |
H |
CH3CH OCH3 |
||
|
OCH3 |
|
OCH3 |
||
|
|
|
|||
Весь процесс ацетализации обратим, поэтому эффективно провести взаимодействие альдегида или кетона со спиртом до ацеталя можно только, смещая равновесие вправо, например, удаляя образующуюся воду из сферы реакции. Обратная реакция представляет собой кислотный гидролиз ацеталя. Следовательно, в кислой водной среде ацетали неустойчивы, поскольку подвергаются гидролизу.
H
CH3CH OCH3 + H2O 
 CH3CH=O + 2CH3OH
CH3CH=O + 2CH3OH
OCH3
В щелочной среде ацетали устойчивы, поскольку гидролиз в этой среде произойти не может.
2.2.2. Реакции с S-нуклеофилами
Атом серы в аналогах спиртов – меркаптанах (тиолах) – является более сильным нуклеофилом, поэтому меркаптаны легче присоединяются к альдегидам и кетонам. При этом образуются продукты, аналогичные полуацеталям и ацеталям, например, при взаимодействии бензальдегида с двумя эквивалентами метантиола (метилмеркаптана) в кислой среде образуется диметилтиоацеталь бензальдегида.
CH=O |
H |
CH(SCH3)2 + H2O |
+ 2CH3SH |
Альдегиды и кетоны легко реагируют с гидросульфитом натрия, образуя так называемые бисульфитные производные, кото-
63
www.mitht.ru/e-library
рые представляют собой хорошо кристаллизующиеся соединения и поэтому могут быть использованы для выделения и очистки альдегидов и кетонов.
SO3Na CH3CCH3 NaHSO3 CH3CCH3
O OH
бисульфитное производное ацетона (2-гидрокси-2-пропансульфонат натрия)
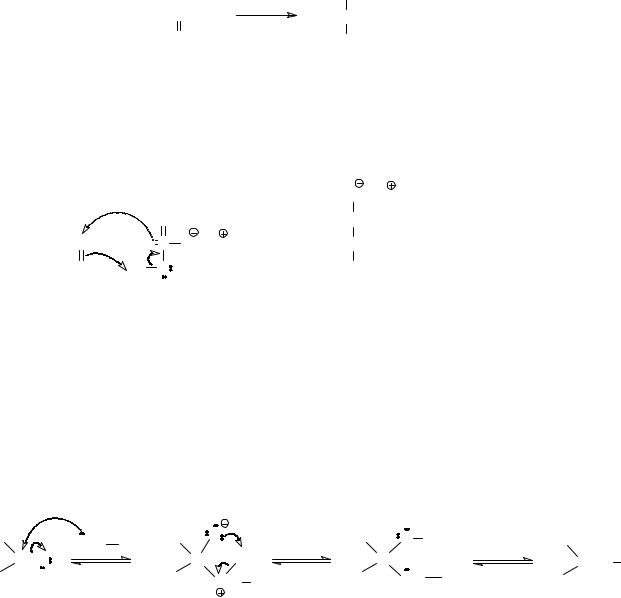
Механизм реакции – нуклеофильное присоединение бисуль- фит-аниона:
O Na




 O O
O O S
S O
O
CH3CCH3 + 

 S O Na
S O Na  CH3CCH3
CH3CCH3
O |
H O |
OH |
2.2.3. Реакции с N-нуклеофилами
Многие N-нуклеофилы, с которыми вступают в реакции альдегиды и кетоны, содержат аминогруппу, и их строение может быть отражено общей формулой NН2-Y. Механизм, по которому происходит присоединение таких нуклеофилов, выглядит в общем виде следующим образом.
R |
NH2 Y R |
|
O |
R |
O H |
R |
|
R' C=O |
R' |
C |
H |
R' |
C |
_H O R' C=N Y |
|
NH Y |
|||||||
|
|
|
|
NH Y |
2 |
Нуклеофильное присоединение приводит к аддукту, представляющему собой биполярный ион, в котором бывший нуклеофильный атом азота, отдавший пару электронов на образование новой связи, заряжен положительно, а принявший при гетеролитическом разрыве π-связи пару электронов бывший электрофильный атом углерода карбонильной группы заряжен отрицательно. После внутримолекулярного переноса протона (в результате кислотноосновного взаимодействия) образуется неустойчивый геминальный аминоспирт, дегидратация которого и дает конечный продукт реак-
64
www.mitht.ru/e-library
ции. В таблице приведены нуклеофильные реагенты и продукты реакции, а также их названия.
В качестве иллюстрации к этой таблице рассмотрим некоторые примеры. Так, при взаимодействии пропаналя с аммиаком об-
разуется имин пропаналя.
NH3
CH3CH2CH=O  _H2O CH3CH2CH=NH
_H2O CH3CH2CH=NH
Бензальдегид с анилином очень легко образуют основание Шиффа – так называемый бензилиденанилин (или бензальанилин).
CH=O H2N |
CH=N |
+ |
_H O |
|
2 |
ТАБЛИЦА Некоторые Ν-нуклеофилы и продукты их взаимодействия с
альдегидами и кетонами
Нуклеофил |
|
|
|
|
|
|
|
|
|
Продукт |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Формула |
Название |
Формула |
Название |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NН3 |
аммиак |
R |
C=N |
|
|
|
|
|
H |
имин |
||
R' |
|
|
|
|
|
|||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
алкиламин |
R |
|
|
|
|
|
|
|
|
|
N-алкилимин |
R"NН2 |
|
|
|
|
|
|
|
|
|
(азометин, ос- |
||
(первичный |
|
C=N |
|
|
|
|
R" |
|||||
R' |
|
|
|
нование Шиф- |
||||||||
|
амин) |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
фа) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NН2ОН |
гидроксиламин |
R |
C=N |
|
|
|
|
OH |
оксим |
|||
R' |
|
|
||||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NН2NН2 |
гидразин |
R |
C=N |
|
|
|
|
NH2 |
гидразон |
|||
R' |
|
|||||||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
65
www.mitht.ru/e-library

При взаимодействии с гидроксиламином ацетон превращается в ацетоноксим, а реакция ацетофенона с гидразином приводит к образованию гидразона ацетофенона:
CH3 |
|
CCH3 |
NH2OH |
|||||||
|
|
CH3 |
|
|
|
CCH3 |
||||
|
|
|||||||||
|
|
|||||||||
|
|
|
|
|||||||
O |
|
N |
|
OH |
||||||
|
|
|||||||||
C=O |
+ H N |
|
NH |
|
|
|
|
|
C=N |
|
NH2 |
|
|
|
2 |
2 |
_H2O |
|
|
|
|
|
|
||
|
|
|
|
|
CH3 |
|||||||
CH |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
Широкое использование для идентификации альдегидов и кетонов нашли 2,4-динитрофенилгидразоны, которые получают взаимодействием альдегидов и кетонов с 2,4-динитрофенилгидразином.
|
|
|
NO2 |
|
|
|
|
NO2 |
|||||
CH3CH=O + H2NNH |
|
|
|
|
|
|
|
CH3CH=NNH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
NO2 |
_H2O |
|
|
|
NO2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
2.2.4.Реакции с С-нуклеофилами
Вкачестве С-нуклеофилов в реакциях с альдегидами и кетонами выступают соединения, являющиеся С-Н-кислотами, т.е. соединения, способные в присутствии основания дать заметные концентрации сопряженного основания, которое и является С- нуклеофилом. Поэтому практически все реакции альдегидов и кетонов с С-нуклеофилами происходят в присутствии основного катализатора.
а) Этинилирование альдегидов и кетонов. Ацетилен и другие алкины, имеющие концевую тройную связь, проявляют С-Н- кислотные свойства, поэтому в присутствии оснований они могут реагировать с альдегидами и кетонами. Так, по реакции Реппе ацетилен присоединяется к формальдегиду в присутствии ацетиленида меди (основный катализатор) с образованием 2-пропин-1-ола и далее 2-бутин-1,4-диола:
|
CH |
|
|
CH |
|
|
|
CH |
|
CH |
|
|
|||
CH =O |
|
|
HOCH C |
|
CH |
|
HOCH C |
|
CCH OH |
||||||
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||||
2 |
CuC |
|
|
CCu |
2 |
|
|
CuC |
|
|
CCu |
2 |
2 |
||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
66
www.mitht.ru/e-library
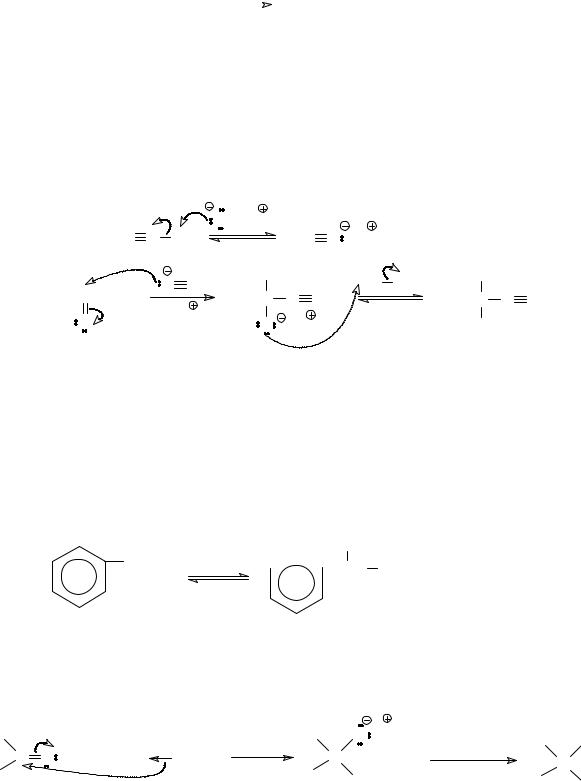
Известная реакция Фаворского, лежащая в основе синтеза изопрена, является нуклеофильным присоединением ацетилена к ацетону.
CH CCH |
CH |
|
CH |
|
CH3 |
||||
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
CH3 |
CC |
|
CH |
|||||
|
|
|
|
||||||
|
|
|
|
||||||
3 |
|
3 |
KOH |
|
|||||
|
|
|
|
||||||
O |
|
|
|
|
OH |
||||
Механизм этой реакции включает генерирование С- нуклеофильой частицы в результате кислотно-основного взаимодействия ацетилена как кислоты с гидроксидом калия, последующее присоединение ацетиленид-аниона к карбонильной группе и протонирование образовавшегося алкоксид-аниона (гидролиз).
|
CH C H |
OH K |
CH C K |
|
|
|
_H O |
|
|||
|
|
2 |
|
|
CH3 |
|
|
CH3 |
H OH |
||
|
C CH |
|
CH C C CH |
||
CH3CCH3 |
CH C C CH |
|
|||
O |
K |
3 |
|
_KOH |
3 |
O |
K |
OH |
|||
б) Взаимодействие с синильной кислотой. Циановодород присоединяется по карбонильной группе альдегидов и кетонов в присутствии цианидов металлов как катализаторов. Механизм этой реакции аналогичен взаимодействию кетонов с ацетиленом. Продуктами присоединения являются так называемые циангидрины. Бензальдегид реагирует с синильной кислотой с образованием циангидрида бензальдегида (или 2-гидрокси-2-фенилэтаннитрила):
OH
CH=O HC N
N 
 CH C
CH C N
N
KCN
в) Реакция Гриньяра. Реакция альдегидов и кетонов с магнийорганическими соединениями также относится к нуклеофильному присоединению (см. Способы получения спиртов).
R |
+ |
|
|
R |
O |
MgX |
H2O |
R |
OH |
C O |
R" |
MgX |
C |
|
|
||||
R' |
|
|
|
R' |
R" |
|
_Mg(OH)X |
R' C |
R" |
г) Альдольно-кротоновая конденсация. В альдольно-
кротоновую конденсацию вступают альдегиды и кетоны, имеющие в α-положении к карбонильной группе атом водорода. Так, например,
67
www.mitht.ru/e-library
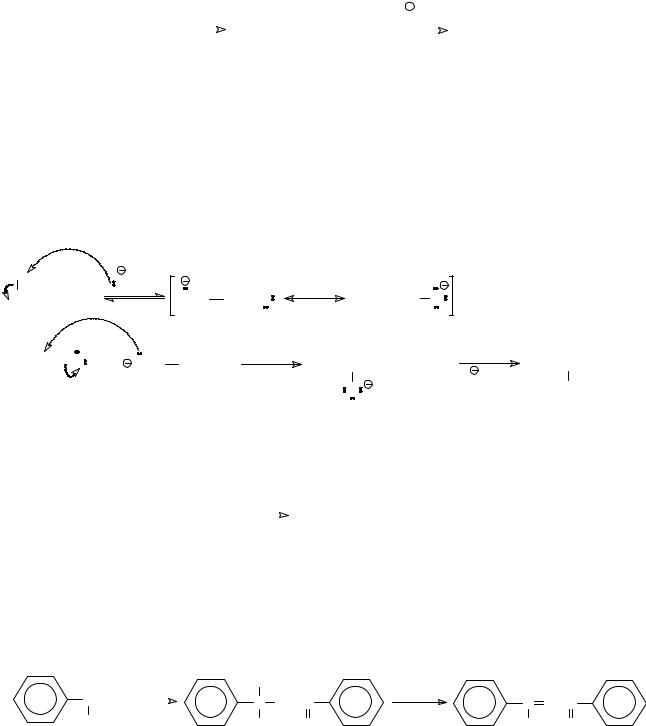
в присутствии едкого натра в качестве катализатора уксусный альдегид превращается в соединение, которое получило название альдол (альдегидоспирт). Последний при дегидратации в кислой среде образует кротоновый альдегид (2-бутеналь).
|
NaOH |
|
|
|
|
|
|
2CH3CH=O |
CH CHCH CH=O |
H |
, t |
CH CH=CHCH=O |
|||
|
_H2O |
||||||
|
|
3 |
|
2 |
3 |
||
|
|
OH |
|
|
|||
|
|
|
|
|
|
||
Механизм этой реакции также включает стадию генерирования С-нуклеофила из молекулы уксусного альдегида, имеющего в α- положении атом водорода и обладающего поэтому С-Н-кислотными свойствами. Образовавшийся карбанион, как нуклеофил, присоединяется к карбонильному атому углерода, а последующее протонирование алкоксид-аниона приводит к продукту альдольной конденсации.
H |
OH |
|
|
|
|
CH2CH=O |
CH CH=O |
CH2=CH O |
|
|
|
_H2O |
|
|
|||
|
2 |
|
|
|
|
CH3CH=O + CH2 |
CH=O |
H2O |
CH3CHCH2CH=O |
||
CH3CHCH2CH=O _ |
OH |
||||
|
|
|
O |
OH |
|
|
|
|
|
||
Бутаналь в щелочной среде также образует продукт альдольной конденсации:
|
|
|
NaOH |
|
|
|
|
CH2CH3 |
|
|
|
|
|
|
|
|
|||
2CH CH CH CH=O |
|
CH CH CH CHCHCH=O |
|||||||
|
|||||||||
3 |
2 |
2 |
3 |
2 |
2 |
|
|
||
|
|||||||||
|
|
|
|
|
|
OH |
|||
Следующий пример иллюстрирует альдольно-кротоновую конденсацию ароматического кетона (ацетофенона), альдол которого самопроизвольно дегидратируется до ненасыщенного кетона.
C=O NaOH |
OH |
|
|
C CH2C |
_ H O |
C CHC |
|
CH3 |
CH3 O |
2 |
CH3 O |
|
Таким образом, в основе альдольной конденсации лежит взаимодействие карбонильной группы одной молекулы альдегида или кетона (карбонильная компонента) с С-нуклеофилом, обра-
68
www.mitht.ru/e-library

зующимся под действием основания из второй молекулы альдегида или кетона (метиленовая или С-Н-кислотная компонента).
Все рассмотренные примеры альдольно-кротоновой конденсации представляют собой самоконденсацию альдегида или кетона. Возможно протекание альдольно-кротоновой конденсации и между молекулами двух различных соединений. Однако направленной такая перекрестная конденсация может быть только в некоторых случаях.
Один из участников реакции не является енолизующимся альдегидом или кетоном, т.е. в этой компоненте отсутствует атом водорода в α-положении. Это соединение, таким образом, может выполнять только роль карбонильной компоненты. Например, взаимодействие пропаналя с формальдегидом в щелочной среде протекает как направленная альдольно-кротоновая конденсация, поскольку в молекуле формальдегида нет атома водорода в α-положении и этот альдегид может выступать только как карбонильная компонента, а пропаналь – как метиленовая (С-Н- кислотная).
CH2=O + CH3CH2CH=O NaOH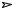 HOCH2CHCH=O
HOCH2CHCH=O
CH3
В реакциях альдольной конденсации с участием формальдегида происходит гидроксиметилирование (т.е. замещение атома водорода на группу НОСН2) метиленовой компоненты по α- положению. При наличии нескольких атомов водорода в этом положении и избытке формальдегида может произойти замещение всех этих атомов на гидроксиметильную группу, например:
|
|
|
|
HOCH2 |
|||||
CH |
|
CH=O |
+ 3CH =O |
NaOH |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|||||||||
|
HOCH C CH=O |
||||||||
3 |
|
|
2 |
||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOCH2 |
|||||
Кроме формальдегида, карбонильной компонентой в перекрестной альдольно-кротоновой конденсации выступает и бензальдегид. Особенностью этого альдегида является то, что даже в щелочной среде в качестве продукта реакции сразу образуется продукт кротоновой конденсации, т.е. самопроизвольно происходит дегидратация альдола. Так, например, при взаимодействии бензальдегида с ацетоном в соотношении 2:1 в присутствии едкого натра образуется 1,5-дифенил-1,4-пентадиен-3-он.
69
www.mitht.ru/e-library
|
CH=O + |
CH CCH |
NaOH |
|
|
|
CH=CHCCH=CH |
+ |
2H2O |
||
2 |
|
3 3 |
|
||
|
O |
O |
|
|
|
|
|
|
|
Если обе компоненты имеют атомы водорода в α-положении, но вещества различаются по реакционной способности в реакциях нуклеофильного присоединения, то более реакционноспособное соединение будет выступать в роли карбонильной компоненты. Поэтому, если в перекрестной альдольно-кротоновой конденсации принимают участие альдегид и кетон, то альдегид будет реагировать как карбонильная компонента, а кетон – как метиленовая, например:
|
C=O NaOH |
OH |
|
CH2CH=O + |
CH2CH |
CH2C |
|
|
CH3 |
|
O |
д) Реакция Перкина. При взаимодействии бензальдегида и других ароматических альдегидов с ангидридом уксусной кислоты в присутствии ацетата калия в качестве катализатора происходит реакция, аналогичная альдольно-кротоновой конденсации, где в качестве С-Н-кислотной компоненты фигурирует уксусный ангидрид. При этом после гидролиза смешанного ангидрида образуются коричная и уксусная кислоты.
|
|
O CH COOK |
|
O |
|
CH=O |
+ CH3C |
3 |
CH=CHC |
H2O |
|
O |
O |
||||
|
CH3C |
CH3C |
|||
|
O |
|
|||
|
|
|
|
 CH=CHCOOH + CH3COOH
CH=CHCOOH + CH3COOH
2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
Альдегиды и кетоны, имеющие в α-положении к карбонильной группе атомы водорода, вступают с галогенами в реакцию галоге-
70
www.mitht.ru/e-library
