
Полимеризация
.docxМосковская Государственная Академия
Тонкой Химической Технологии
им. М.В Ломоносова
Кафедра ХиФП
Отчёт по лабораторной работе
«Полимеризация»
Студент: Воскобоев А.А.
Группа: ХТ-414
Руководитель: Емельянов С.В.
Москва 2009
Введение.
Полимеризация (греч. polymeres - состоящий из многих частей) — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле полимера. Общая схема полимеризации:
n M ![]() Mn
Mn
Число n в формуле полимера (Mn) называется степенью полимеризации.
По числу участвующих в реакции мономеров, полимеризацию разделяют на гомополимеризацию (один мономер) и сополимеризацию (два и более), в зависимости от природы активного центра подразделяют на радикальную полимеризацию, в которой активным центром является свободный радикал (макрорадикал), и ионную полимеризацию, где активные центры-ионы, ионные пары или поляризованные молекулы (Анионная полимеризация, Катионная полимеризация, Координационно-ионная полимеризация).
Механизм полимеризации обычно включает в себя ряд связанных стадий:
* инициирование - зарождение активных центров полимеризации
* рост (продолжение) цепи - процесс последовательного присоединения молекул мономеров к центрам
* обрыв цепи - гибель активных центров
Инициирование — превращение небольшой доли молекул мономера в активные центры, способные присоединять к себе новые молекулы мономера. Для этого в систему вводят специальные вещества (называется инициаторами или катализаторами П. в зависимости от того, входят их частицы в состав образующегося полимера или нет). П. можно также вызвать действием ионизирующего излучения, света или электрического тока.
Рост цепи состоит из ряда многократно повторяющихся однотипных реакций присоединения молекул мономера (М) к активному центру (М*):
М* + М → М*2; М*2 + М → М*3... М*n + M → M*n+1
В результате исходный низкомолекулярный активный центр вырастает в макромолекулу.
Обрыв цепи — дезактивация активного центра при его взаимодействии с др. активным центром, каким-либо посторонним веществом или вследствие перегруппировки в неактивный продукт. При передаче цепи активный центр с растущей макромолекулы переходит на какую-либо другую частицу Х (мономер, растворитель, полимер и т.д.), начинающую рост новой макромолекулы:
М*n + Х → Mn +Х*
X* + M → XM*
Цель работы:
Получение стирола путём блочной полимеризации стирола под действием катализатора катионного типа и выделение его из реакционной системы осаждением.
Теоретические основы.
Катионная полимеризация:
-
Получение катализатора
-
Инициирование цепи
СН2═СН(С6Н5) + Н+[Ci4SnOH]- →CH3− C+ (С6Н5) H [Ci4SnOH]-
-
Рост цепи:
CH3− C+(С6Н5) H[Ci4SnOH]- + n СН2═СН(С6Н5) → CH3− CH(С6Н5) – [CH2− CH(С6Н5) ]n− CH2− C+(С6Н5) H[Ci4SnOH]-
-
Обрыв цепи:
CH3− CH(С6Н5) – [CH2− CH(С6Н5) ]n− CH2− C+(С6Н5) H[Ci4SnOH]- → Н+[Ci4SnOH]- + CH3− CH(С6Н5) – [CH2− CH(С6Н5) ]n− СН═СН(С6Н5)
Анионная полимеризация:
Инициирование цепи:

Рост цепи:
 Обрыв цепи происходит
точно так же как и в катионной полимеризации.
Обрыв цепи происходит
точно так же как и в катионной полимеризации.
Радикальная полимеризация:

Стадия
инициирования:

Стадия
роста:

Стадия
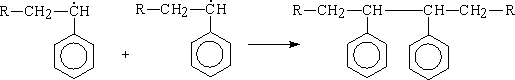
обрыва: Диспропорционирования
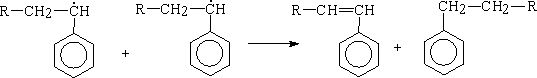
Рекомбинация р Рр
Объекты и методы исследования.
Объекты:
Гидроксид натрия
Наименование едкий натр, каустик, каустическая сода, едкая щелочь
Химическая формула Na-OH
Молярная масса 39.9971 г/моль
Температура плавления 323 °C
Температура кипения 1403 °C
Плотность вещества 2,02 г/см3
Растворимость в воде — 108,7 (20 °C) г/100 мл
ромбическая модификация до 299 °C
Хлорид олова(IV) (тетрахлорид олова, оловянное масло) — SnCl4.
Тяжелая бесцветная (иногда желтоватая) жидкость удельного веса 2,28, кипит около 114 °C, затвердевает около −33 °C. На воздухе она дымит.
Изопропиловый спирт

Систематическое наименование Пропан-2-ол
Химическая формула CH3CH(OH)CH3
Молярная масса 60,10 г/моль
Физические свойства: Состояние (ст. усл.) жидкое
Плотность 0,7851 г/см³
Термические свойства: Температура плавления -89,5 °C
Температура кипения 82,4 °C
Химические свойства pKa 16,5
Растворимость в воде неограниченная г/100 мл
Стирол

Химическая формула C8H8
Молярная масса 104.15 г/моль
Плотность 0.909 г/см³
Температура плавления -30 °C
Температура кипения 145 °C
Полистирол — продукт полимеризации стирола (винилбензола) относится к полимерам класса термопластов.
Имеет химическую формулу вида: [-СН2-С(С6Н5)Н-]n-
Фенильные группы препятствуют упорядоченному расположению макромолекул и формированию кристаллических образований. Это жёсткий, хрупкий, аморфный полимер с высокой степенью оптического светопропускания, невысокой механической прочностью, выпускается в виде прозрачных гранул цилиндрической формы. Полистирол имеет низкую плотность (1060 кг/м3), термическую стойкость (до 105 °С), усадка при литьевой переработке 0,4-0,8%. Полистирол обладает отличными диэлектрическими свойствами и неплохой морозостойкостью (до -40°C). Имеет невысокую химическую стойкость (кроме разбавленных кислот, спиртов и щелочей).
Методы исследования:
Перед проведением полимеризации стирол очищаем от ингибитора полимеризации. Для этого стирол встряхиваем в делительной воронке с 10% раствором гидроксида натрия. После этого готовим раствор 1 мл тетрахлорида олова в 30 мл дихлорэтана в конической колбе. Далее в стеклянную ампулу наливаем пипетко 4 мл стирола, помещаем её в сосуд Дьюара с охлаждающей смесью -17 С. Добовляем 3 мл раствора из колбы. Проводим полимеризацию 15 минут. К концу полимеризации реакционная смесь загустевает. Переносим смесь в фарфоровую чашку и промываем её изопропанолом. После отжимаем смесь и сушим.
Обсуждение результатов.
Расчет выхода:
Теоретическая масса
Mтеор=Vст*ρст=4 мл*0,906 г/мл=3,6 г
Mпр=3,1 г
η=3,1/3,6*100%=86%
Вывод:
В результате опыта получен полистирол методом растворной полимеризации. Для получения полистирола был использован катионный катализатор тетрахлорид олова. Полимеризация проводилась при -16 0С. Выделили 3,1 г полистирола, учитывая теоретический выход следует, что наш выход составил η=86%.
