
Экспериментальная часть.Выделение и очистка белка pkb5
.docxТема: Выделение и очистка белка pkb5
Экспериментальная часть
Штаммы и среды.
В работе использовали штамм E.coliBL21(DE3)pLysS, с плазмидой pET32a:Pkb5 (рис), содержащей каталитический домен протеинкиназы pkb5 Bifidobacterium longum.
Для выращивания клеток E.coli использовали питательные среды LB и TB.
Таблица 1-Питательные среды, использованные для выращивания E.coli
|
Название |
Состав (на 1 литр) |
|
LB агаризованная |
25 г сухой среды LB растворяли в дистиллированной H2O, рН 7,2-7,4 доводили NaOH; добавляли 2,0% агара |
|
TB |
24 г дрожжевого экстракта, 12 г бакто-триптона, 4 мл глицерина растворяли в дистиллированной H2O (900 мл), рН 7,2-7,4 доводили KOH. Отдельно готовили следующий раствор; 12,54 г K2HPO4, 2,31 г KH2PO4 доводили до 100 мл дистиллированной H2O; после автоклавирования объединяли растворы |
Среды стерилизовали в автоклаве при избыточном давлении 0,8 ати в течение 40 минут.
Для поддержания штамма E.coliBL21(DE3)pLysS, содержащего плазмиду pET32a:Pkb5, проводили моноклоновый рассев на чашках Петри с агаризованной средой LB с добавлением хлорамфеникола(30 мкг/мл) и ампициллина (150 мкг/мл).
Для наработки биомассы клетки E.coliBL21(DE3)pLysS, содержащие плазмиду pET32a:Pkb5, выращивали в колбах на среде ТВ с добавлением хлорамфеникола и ампициллина.
На первом этапе выращивали ночные культуры на среде ТВ. На втором этапе в колбы с 150 мл свежей среды вносили по 1,5 ночной культуры. Выращивание проводили в аэрируемых условиях при 250 об/мин и температуре 370С до оптической плотности OD600 = 0,6 (~2 часа), затем индуцировали экспрессию добавлением ИПТГ (изопропил - β-D-тиогалактозид) до конечной концентрации 0,5 мМ. Далее проводили культивирование при 280С в течение 18 часов, после чего биомассу осаждали центрифугированием в течение 10 мин при 6 000 об/мин, промывали 1M Tris-HCl (pH 7,6-8,0) и замораживали при -200С.
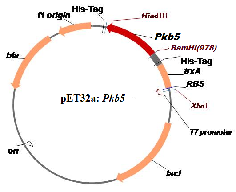
Рис. Схема конструкции плазмиды pET32a: Pkb5.
Приготовление лизата E.сoli
Размораживали клетки E.сoli при температуре 40С. Размороженные клетки отмывали от ростовой среды с 20-ю объемами (18 мл) 1М Тris-HCl, рН 7,8. Клетки осаждали центрифугированием 7500 об/мин в течение 10 мин при температуре 4 0С. На аналитических весах определяли вес осадка 1,61 г.. Осадки ресуспендировали в 10-ти объемах лизирующего буфера, содержащего 300 мМ КCl, 50 мМ КH2PO4, 5 мМ Имидазола, 6 М мочевины ингибиторный коктейль (complete EDTA-free, Roche Diagnostics Gmbh, Germany). Клетки лизировали с помощью ультразвукового дезинтегратора SONICS VIBRA CELL 3 раза по 59 секунд с интервалом 15 секунд при амплитуде 40 % и температуре 4 0С. Для осаждения обломков клеточных стенок, лизат центрифугировали при 10000 об/мин в течение 20 мин при температуре 40С. Надосадочную жидкость отбирали и фильтровали через фильтр (диаметр пор- 0,22 мкм, Merck Millipore Ltd, Germany) непосредственно перед нанесением на колонку.
Металл-аффинная хроматография
Метод металл-аффинной хроматографии основана на не ковалентном взаимодействии 6 гистидинового фрагмента рекомбинантного белка (His-Tag) с ионами никеля (Ni2+), образующими координационные связи с остатками нитролиуксусной кислоты.
Очистку проводили на приборе Bio Logic LP Model 2110 Fraction Collector (Bio Rad, USA) используя колонку объемом 1 мл Bio-Scale Mini Profinity IMAC Cartridges.
Очистку белка проводили согласно методическому руководству Profinite IMAC Resins (Bio Rad, USA).
Перед началом работы промывали систему дистиллированной водой, устанавливали колонку Bio-Scale Mini Profinity IMAC Cartridges, колонку промывали дистиллированной водой со скоростью 2 мл/мин. Уравновешивали колонку с 8-ю объемами лизирующего буфера со скоростью 2 мл/мин, наносили лизат в объеме 15 мл со скоростью 0,5 мл/мин, промывали с 15-ю объемами лизирующего буфера со скоростью 2 мл/мин, далее промывали с15-ю объемами промывочного буфера со скоростью 2 мл/мин, элюцию проводили с 15-ю объемами элюирующего буфера со скоростью 2 мл/мин. Фракции собирали по 2 мл. Фракции соотвествующие элюируемому белку собирали отдельно.
По окончании работы колонку промывали 2 мл дистиллированной воды со скоростью 2 мл/мин и регенерировали с 5-ю объемами 6 М гуанидин-HCl и далее дистиллированной водой. Использованную колонку хранили в 20% этаноле при температуре 4 0С.
Состав буферного раствора
|
|
KCl, мМ |
KH2PO4, мМ |
Имидазол, мМ |
Мочевина, М |
|
Лизирующий буфер |
300 |
50 |
5 |
6 |
|
Промывочный буфер |
300 |
50 |
10 |
6 |
|
Элюирующий буфер |
300 |
50 |
250 |
6 |
Определение количества белка
Количества белка определили по методу Брэдфорд (Bradford M.M. , 1976).
На цифровом спектрофотометре PD-303 для фракций 31 и 32 определяли оптическую плотность при длине волны 595 нм и по графику (рис) определяли количество белка и рассчитывали концентрацию.
Состав краски: 100 мг CBB (Coomassie Brilliant Blue G-250), 95% C2H5OH, 85 % H3PO4
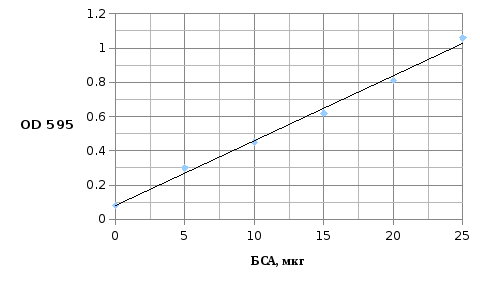
Рис. График для определения количества исследуемого образца по методу Бреэдфорд
Ступенчатый диализ
В работе использовались диализные трубки SnakeSkin Pleated Dialysis Tubing (фирма Thermo scientific), диаметр пор- 3,500 MVCO.
Отобранные фракции диализовали против буферного раствора, содержащего 50 мМ Tris-HCl, 5 мМ β-меркаптоэтанол, 10 % глицерин, 3 М мочевины при температуре 4 0С в течение 2,5 часа при постоянном перемешивание. Далее диализный буфер заменяли на диализный буфер содержащий 50 мМ Tris-HCl, 5 мМ β-меркаптоэтанол, 10 % глицерин, 1,5 М мочевины, 2 мМ МgCl2. Оставляли на ночь при постоянном перемешивание при 40С.
Электрофоретическое разделение белков в денатурирующем ДСН- полиакриламидном геле
Электрофорез проводили по методу Лэммли (Laemmli U. K.,1970) с использованием Mini proteam sistem. В качестве рабочего геля использовали 12 % полиакриламидный гель в буфере, содержащем 0,375 М Tris-HCl рН 8,8, 0,1 % SDS, в качестве формирующего геля использовали 3 % полиакриламидный гель содержащей, 0,125 М Tris-HCl рН 6,8, 0,1 % SDS.
В качестве электродного буфера использовался 0,025 М Трис, 0,192 М глицин, 0,1 % SDS.
Перед нанесением образцы прогревали в буфере ,содержащем 0,0625 М Tris-HCl рН 6,8, 2,3 % SDS, 5 % β-меркаптоэтанол, 10 % глицерин и 0,001 % бром феноловый синий. Электрофорез вели при постоянном напряжение 200 вольт. По окончании электрофореза ПААГ фиксировали в течение 30 мин в растворе, содержащем 50 % C2H5OH и 10 % СH3COOH. Далее окрашивание проводили в растворе содержащая 0,2 % СВВ g-250, 40% C2H5OH, 8 % СH3COOH при нагревание. ПААГ отмывали в 7 % СH3COOH.
Концентрирование
Для дальнейшего измерения активности каталитического домена pkb 5 проводилось концентрирование элюированного белка при помощи центрифужных концентраторов Amicon Ultra Centrifugal Filters, диаметр пор-50,000 NMWL (Merck Millipore Ltd).
Концентрирование белкового образца проводили при помощи центрифугирования Eppendorf 5430 R при 7500 об/мин в течение 1 час 20 мин при температуре 4 0С.
Проверка активности
Определение автофосфорилирования pkb 5 (рекомбинантный белок) проводился с помощью Kinase-Glor Plus Luminiscent Kinase Assey (Promega V3772), используемого для измерения степени фосфорилирования по уровню АТФ, оставшегося в ходе реакции.
В лунки 96-луночного планшета, используя автоматизированную рабочую станцию Biomek 3000 Beckman Coulter©, вносили 15 мкл раствора pkb 5 (5 мкг и 1 мкг в реакционной смеси) в реакционном буфере (15 мМ HEPES pH 7,4; 20 мМ NaCl, 10 мМ MgCl2, 0,5 мМ EDTA, 0,02% Tween-20, 10 мг/мл BSA) и 15 мкл реакционного буфера (контроль без протеинкиназы).
В каждую лунку добавляли 20 мкМ АТФ 15 мкл, перемешали содержимое лунок. Инкубировали при комнатной температуре 30 мин, закрыв планшет крышкой для предотвращения испарения.
По окончании ферментативной реакции добавляли в каждую лунку по 30 мкл реагента для определения люминесценции, инкубировали планшет 40 мин при комнатной температуре, измерили люминесценцию на приборе Beckman Coulter© DTX 880 Multimode Detector.
Обсуждение результатов
На стадии металл-аффинной хроматографии по хроматограмме определяли, что исследуемый белок pkb 5 содержится в фракциях 31 и 32.
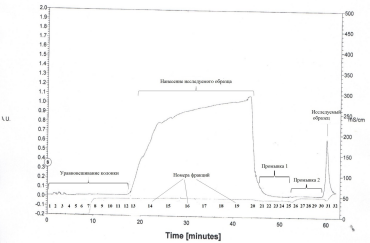 Рис..Хроматограмма
выделения
каталитического домена pkb
5
Рис..Хроматограмма
выделения
каталитического домена pkb
5
Далее определяли количества исследуемого образца по методу Брэдфорд и рассчитывали концентрацию pkb 5 (таблица).
|
№ пробы |
Оптическая плотность |
Количество в 5 мкл, мкг |
Концентрация, мкг/мкл |
|
31 |
0,758 |
15 |
3 |
|
32 |
0,513 |
9 |
1,8 |
Фракции 31 и 32 объединяли, так как в них содержиться исследуемый белок.
Так как каталитический домен pkb5 выделялся в денатурирующих условиях, для дальнейшего исследования было необходимо провести рефолдинг этого белка.
На следующем этапе объедененные фракции диализовали для рефолдинга pkb5 из денатурирующих условий в нативные условия.
На следующей стадии для проверки оптимальных условий хроматографической очистки pkb5 различных фракций, провели электрофоретическое разделение белков в денатурирующем SDS- полиакриламидном геле.
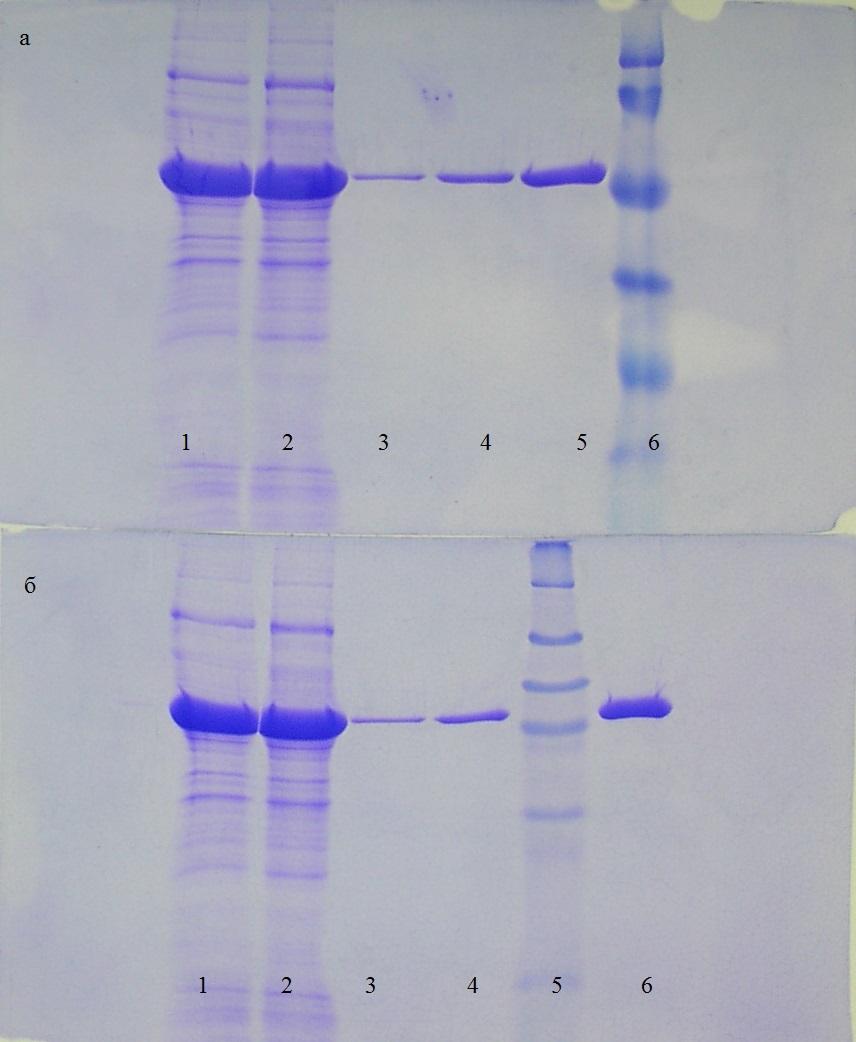
Рис. Электрофореграмма полученная в результате очистки pkb5; а) 1- лизат, 2- фракции 13-20, 3- фракции 26-27, 4- фракция 31, 5- исследуемый образец после диализа, 6- маркерные белки (Prestained Protein Molecular Weight Marker, 20-120 kDa); б) 1- лизат, 2- фракции 13-20, 3- фракции 26-27, 4- фракция 31, 5- маркерные белки (Prestained Protein Marker, Broad Range, 7-175 kDa), 6- исследуемый образец после диализа
В таблице (..) указано конечное количество белков наносимое на электрофорез.
Таблица(..)
|
№ пробы |
Лизат |
Фракции 13-20 |
Фракции 26-27 |
Фракция 31 |
Исследуемый образец после диализа |
|
Количество, мкг |
10 |
10 |
10 |
1 |
1 |
На следующем этапе после ступенчатого диализа увеличивали концентрацию исследуемого белка pkb 5 для дальнейшего измерения активности.
Ранее была проведена проверка фосфотрансферазной активности каталитического домена pkb5. Сотрудниками лаборатории генетики микроорганизмов с.н.с., к.т.н. Мавлетовой Д. А. и м.н.с. Мирончевой Т. А. ИОГен им. Н. И. Вавилова Ран было проведено автофосфорилирование каталитического домена pkb5 с использованием [γ-32P]-ATP (рис).
а)
 б)
б)
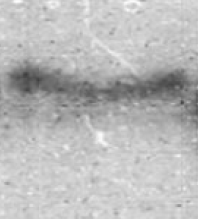
Рис. а) Электрофореграмма автофосфорилирования pkb5. б) Авторадиограмма автофосфорилирования pkb5
Проверка активности
Реагент
Kinase-Glo
использует остаточное количество АТФ
как субстрат для Ultra-GloTMLuciferase,
катализируя монооксигенацию люциферина,
с образованием фотона света (рис. 1).
Активность протеинкиназы обратно
пропорциональна интенсивности сигнала
люминесценции.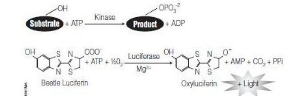
Рис. 1. Схема реакции Kinase-Glo® Assey
По люминесцентным данным построен график зависимости процента автофосфорилирования от количества протеинкиназы pkb 5 (рис.).
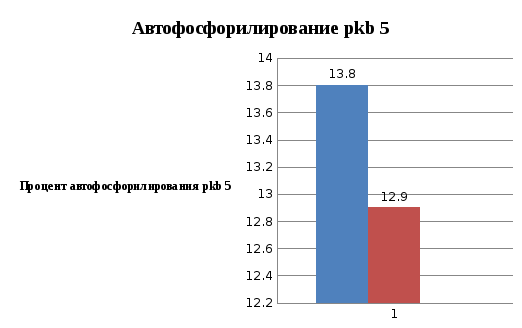
Рис. Процент автофосфорилирования pkb 5
