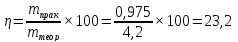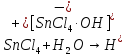1.1Катионная полимеризация
Теоретическая часть: Синтетические полимеры получают путем полимеризации или поликонденсации.
Полимеризация – реакция соединения нескольких молекул, при которой не получаются и не выделяются побочные продукты, а звенья образующего полимера и мономер имеют одинаковый элементный состав или другими словами полимеризация представляет собой присоединение небольших по размеру молекул мономера( за счет кратных связей или раскрытия цикла) к образующейся длинно-цепной полимерной молекуле, называемой макромолекулой. . В общем виде процесс полимеризации можно изобразить схемой:
nM→(M’)n,
где M – молекула мономера, M’ – мономерное звено макромолекулы, n – число звеньев в полимерной цепи.
Химическая природа повторяющихся звеньев и степень полимеризации определяют свойства полимера. Полимеризация непредельных мономеров протекает по законам цепных реакций. Способность к цепной полимеризации является характерным свойством диеновых и виниловых соединений. Обуславливается это наличием в молекуле этих соединений двойных связей. . Поскольку энергия π-связи примерно равна 218 кДж/моль, а α-связи – около 353 кДж/моль, то π-связь является более реакционноспособной. Поэтому полимеризация происходит при разрыве π-связи.
Свойства эластомеров зависят не только от вида мономера, но и от характера и условий поляризации.
Процесс полимеризации состоит из трёх стадий:
Инициирование – образование активного центра A → A*;
Рост цепи A* + A → AA* → An+1A* и тд.;
Обрыв цепи Am-1 + An+1A* → Am+n.
Отдельные стадии цепной полимеризации различаются по скорости и тепловому эффекту. Энергия активации образования активного центра велика, и реакция протекает с относительно маленькой скоростью.
Особенности процесса цепной полимеризации определяются характером активного центра (катионом, анионом, координационным центром).
Различают два типа полимеризации: свободно-радикальную и ионную(катионную, анионную, ионно-координационную).
Ионная полимеризация, возбуждаемая соединениями, способными образовывать в углеводородной среде ионы, обладает исключительной селективностью в отношении мономеров и характеризуется рядом особенностей и преимуществ:
Сильно зависит от полярности растворителя;
Протекает с большими скоростями и значительно меньшей энергией активации;
Полимеризация может осуществляться при температурах, доходящих до -100°C.
Низкая температура, высокая скорость полимеризации и ориентирующее действие активного центра катализатора на молекулы мономера приводят к тому, что эти молекулы соединяются друг с другом в определенном порядке и тем самым могут образовывать:
Стереорегулярные полимеры;
Полимеры с высокой молекулярной массы и сравнительно узкого молекулярно массового распределения.
Схематически катионную (на примере стирола) можно представить следующим образом:
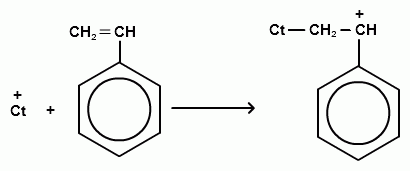
Катализаторами катионной полимеризации являются сильные электроноакцепторные вещества:
Катализаторы Фриделя-Крафтса – BF3, AlCl3, SnCl4, TiCl4, SbCl5, и др.;
Водородные кислоты – H2SO4, HCl, H3PO4, и др.;
Другие кислоты – I2, ICl, IBr, и др.
По активности катализаторы располагаются в ряд:
BF3 < AlBr3 < TiCl4 < TiBr4 < SnCl4 < BCl4 < BBr3
Чаще всего применяют TiCl4, AlCl3, SnCl4, BF3. Каталитическая активность этих соединений значительно повышается, если в полимеризуемой системе в виде примесей содержатся вода, галогенводородные кислоты, алкилгалогениды и другие протонсодержащие вещества.
Ионные процессы обладают высокой чувствительностью по отношению к воде и различным примесям, находящимся в реакционной системе. Таким образом, вода и некоторые другие вещества выполняют роль сокатализаторов.
Наиболее эффективные сокатализаторы подразделяются на два вида:
Соединения, легко отдающие протоны – вода, спирты, водородные кислоты;
Соединения типа галоидных алкилов, обладающих способностью образовывать карбониевые катионы.
Кинетика полимеризации.
Особенности кинетики катионной полимеризации состоят в том, что:
Суммарная скорость полимеризации прямо пропорциональна квадрату концентраций мономера и первой степени концентрации катализатора;
Степень полимеризации прямо пропорциональна 1-ой степени концентрации мономера и не зависит от концентрации катализатора;
Общая энергия активации зависит, в том числе от температуры – чем она ниже, тем выше скорость полимеризации.
Влияние растворителей: Скорость и степень полимеризации повышаются с увеличением величины диэлектрической проницаемости растворителя, и не зависят так же от природы растворителя.
Цель работы: Получение полистирола путём блочной полимеризации стирола под действием катализатора катионного типа и выделение его из реакционной системы осаждением.
Реактивы: Стирол, гидроксид натрия, тетрахлорид олова, дихлорэтан, изопропанол, охлаждающая смесь (лёд с поваренной солью).
Приборы и посуда: Конические колбы с притертой пробкой на 50 мл, делительная воронка, стеклянные ампулы, фарфоровая чашка, сосуд Дьюара, стеклянная палочка.
Ход работы: Смешиваем в стеклянной ампуле 4 мл стирола и 2 мл катализатора (1 мл SnCl4 в 30 мл дихлорэтана). Помещаем ампулу в сосуд Дьюара (в охлаждающую смесь с температурой -20°С). Проводим полимеризацию в течение 15 минут.
По истечении 15 минут смесь загустевает и её нужно переместить в фарфоровую чашечку с изопропанолом, где происходит осаждение полимера.
Сливаем первую порцию осадителя, и добавляем еще небольшое количество изопропанола что бы промыть вещество. Сливаем весь изопропанол и отжимаем полимер тонким слоем по дну чашки. Оставляем его сушиться на воздухе под вытяжным шкафом.
Реакции:
Инициация:
Катализатор образует с примесями
комплексные соединения диссоциируя на
ионы:

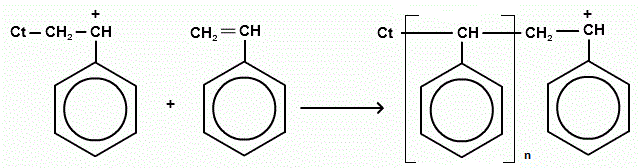
Рост цепи:

Обрыв цепи: прекращение роста цепи состоит в присоединении к карбониевому макроиону отрицательного иона катализатора.
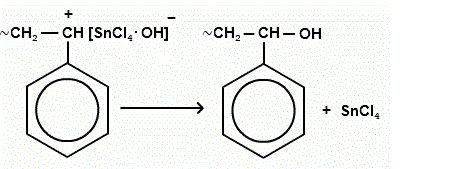
прекращение роста цепи чаще связано с отрывом отрицательным ионом катализатора водорода от полимерной цепи.
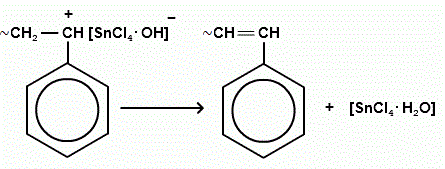
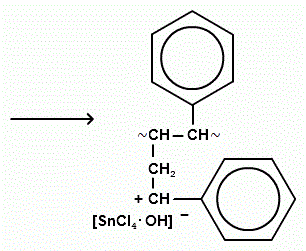
Побочные реакции:


Масса
полученного полимера:
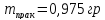
Масса
теоретического полимера:
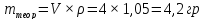
Расчет степени превращения:
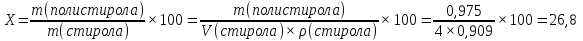
Расчет выхода реакции: