
- •Введение в органическую химию Кузнецов а.И.
- •22.09.10
- •Г. Влияние гибридизации 31
- •Введение
- •1 Ковалентная связь
- •Бутан изобутан
- •Пентан изопентан неопентан
- •Пропан бутан изобутан пентан изопентан неопентан
- •1.1 Электроотрицательность и виды связей
- •Связь Разница в Тип связи
- •1.2 Функциональные группы
- •1.3 Углы между связями и форма молекул
- •1.4 Резонанс
- •Основное состояние возбужденное состояние атома углерода
- •2P орбиталей углерода с образованием четырехsp3-гибридных орбиталей.
- •Ао атома углерода и ао четырех атомов водорода.
- •1.7 Делокализованная химическая связь
- •1.8 Взаимное влияние атомов в молекулах и способы его передачи
- •2 Кислоты и основания
- •2.1 Кислоты и основания по Бренстеду-Лоури
- •Б-1 б-2
- •Константы диссоциации и относительная сила кислот и оснований
- •2.3 Положение равновесия в кислотно-основных реакциях
- •2.4 Строение молекулы и кислотность
- •2.5 Кислоты и основания Льюиса
- •2.6 Принцип жестких и мягких кислот и оснований
- •Жесткие и мягкие кислоты и основания
- •Относительная сила кислот и сопряженных им оснований
2.5 Кислоты и основания Льюиса
По Льюису (1923), кислота – акцептор пары электронов (АПЭ), а основание – донор пары электронов (ДПЭ). Они взаимодействуют друг с другом с образованием донорно-акцепторной (координационной) связи. Рассмотрим реакцию, происходящую при растворении газообразного фторида бора в эфире. У атома бора в молекуле фторида бора на внешнем уровне имеется лишь 6 электронов и поэтому он может принять пару электронов от атома кислорода молекулы эфира.
![]() (14)
(14)
основание кислота комплекс эфира с фторидом бора
ДПЭ АПЭ
По теории Льюиса в качестве кислоты выступает электрон-дефицитный атом. Основания и по Бренстеду и по Льюису предоставляют пару электронов.
Упр. 19. Завершите реакции, показав движение электронов стрелками.
(а) BF3 + NH3 ®,
(б) (CH3)3N + AlCl3 ®,
(в) (CH3)3N + AlCl3 ®,
(г) CH3OH + BF3 ®,
(д) AlCl3 + С2H5OC2H5 ®,
(е) AlCl3 + С2H5OH ®.
(ж) (СH3)2СHCl + AlCl3 ®.
(з) (CH3)3C+ + Cl− ®,
Укажите, какие из приведенных выше веществ являются кислотами Льюиса, а какие - основаниями.
Ответ
(а)
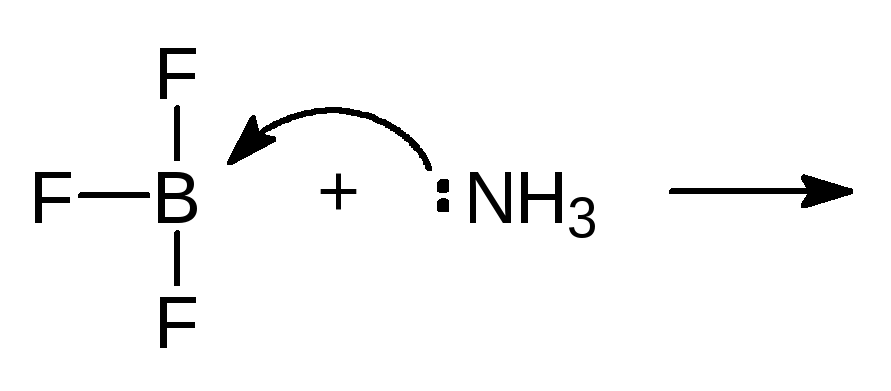
 (15)
(15)
АПЭ ДПЭ аммонийтрифторборат
(б)
![]() (16)
(16)
основ. кис. комплекс триметиламина
с хлоридом алюминия
(в)
![]() (17)
(17)
бромбромонийтрибромферат
2.6 Принцип жестких и мягких кислот и оснований
Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО, сформулирован Р. Пирсоном в 1963 г.). Согласно принципу Пирсона, кислоты и основания делятся на жесткие и мягкие (табл.).
Понятия «жесткие» и «мягкие» кислоты и основания не равноценны понятиям «сильные» и «слабые» кислоты и основания. Это две независимые характеристики кислот и оснований.
Таблица 4
Жесткие и мягкие кислоты и основания
-
Основания
Кислоты
Жесткие
H2O, HOˉ, Fˉ, Clˉ, ROH, ROˉ, H+, Na+, K+, Mg2+, Ca2+, Mn2+,
ROR, NH3, RNH2, NH2ˉ, RCOOˉ Al3+, Fe3+, Mg2+, BF3, AlCl3,
Мягкие
RSH, RSR, RSˉ, HSˉ, NCˉ, ROH, Ag+, Cu+, Hg2+, Br+, I+, Br2, I2,
Hˉ, Iˉ, Rˉ, R2C=CR2, бензол RHal, RCH2+
Промежуточные
Brˉ, C6H5NH2, пиридин Cu2+, Fe2+, Zn2+, R3C+, R6H5+
Принцип ЖМКО используется для качественного описания эффективности протекания кислотно-основного взаимодействия. Он является обобщением, выведенным из экспериментальных данных, и заключается в следующем: жесткие кислоты лучше координируются с жесткими основаниями, мягкие кислоты - с мягкими основаниями.
Концепция Пирсона основана на том, что взаимодействие между орбиталями с близкими энергиями более эффективно, чем между орбиталями, имеющими разную энергию.
Предпочтительное связывание "жестко-жестких" и "мягко-мягких" реагентов объясняется тем, что взаимодействие орбиталей с близкой энергией более эффективно, чем между орбиталями, разнящимися по энергии, то есть подчеркивается преимущество электростатического ("жестко-жесткого") или ковалентного ("мягко-мягкого") взаимодействия.
К жестким кислотам относятся кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью.
Мягкие кислоты содержат акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью и высокой поляризуемостью.
Низшая свободная молекулярная орбиталь (НСМО), которая участвует в связывании с орбиталью донора пары электронов, у жестких кислот имеет низкую энергию. НСМО мягких кислот имеет высокую энергию. У мягких кислот легко поляризуемые вакантные орбитали.
Самая "жесткая" кислота - протон, самая мягкая СH3Hg+.
Жесткие основания – это донорные частицы, обладающие высокой электроотрицательностью, низкой поляризуемостью, трудно окисляющиеся. Мягкие основания, напротив, – это донорные частицы с низкой электроотрицательностью, высокой поляризуемостью, довольно легко окисляющиеся.
Термин «жесткое основание» подчеркивает, что соединение – донор пары электронов – прочно удерживает свои пары электронов. У жестких оснований высшая занятая молекулярная орбиталь (ВЗМО), которая участвует в связывании с орбиталью акцептора пары электронов, имеет низкую энергию (расположена близко к ядру атома). Атомами-донорами в жестких основаниях являются N, O, F, Cl. Мягкие основания слабо удерживают свои валентные электроны, ВЗМО донора имеет высокую энергию. Донорами пары электронов выступают атомы С, S, P, I. Наиболее "жесткие" основания F и OH, наиболее "мягкие" I и H.
Промежуточное положение занимают SO2, Fe2+, Sn2+, карбокатионы (кроме третичных).
При оценке "жесткости" и "мягкости кислот и оснований учитывают их химический состав и электронное строение, а также сравнительную устойчивость образуемых ими кислотно-основных комплексов.
Таблица 5
