
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
В реакциях нуклеофильного замещения галогенопроизводные выполняют роль реагента, алкилирующего нуклеофильную частицу. В зависимости от того, несет ли нуклеофильная частица заряд или нет, схемы такого алкилирования могут выглядеть по-разному, например:


В первом случае при взаимодействии этилхлорида с водным раствором едкого натра (щелочном гидролизе этилхлорида) произошло этилирование гидроксид-аниона. Атом кислорода в нуклеофильной частице в процессе реакции выступил донором неподеленной пары электронов и потерял заряд. Во втором случае при взаимодействии трет-бутилбромида с водой (нейтральный гидролиз) произошло алкилирование воды как нуклеофила. Теперь уже нейтральный атом кислорода выступил в качестве донора неподеленной пары электронов и приобрел положительный заряд.
Описанный выше гидролиз галогенопроизводных является одним из примеров многочисленных реакций нуклеофильного замещения. В результате гидролиза галогенопроизводных образуются спирты, а в результате реакций с другими нуклеофилами – большое число разнообразных функциональных производных углеводородов. Ниже приведены лишь некоторые другие примеры реакций нуклеофильного замещения:
алкилирование алкоголятов – синтез простых эфиров по Вильямсону

бензилхлорид метилат натрия бензилметиловый эфир
алкилирование карбоксилат-анионов (солей карбоновых кислот) – синтез сложных эфиров

аллилиодид ацетат калия аллилацетат
замещение атома галогена на галоген (реакция Финкельштейна)
![]()
алкилирование аммиака или аминов

иодид метиламмония
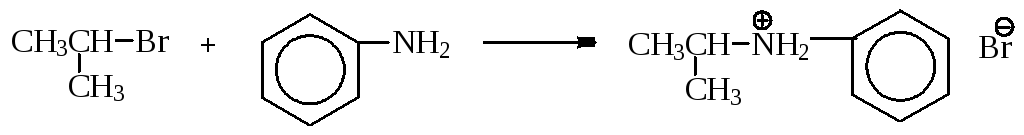
анилин бромид изопропилфениламмония
алкилирование нитрит-аниона – синтез нитросоединений
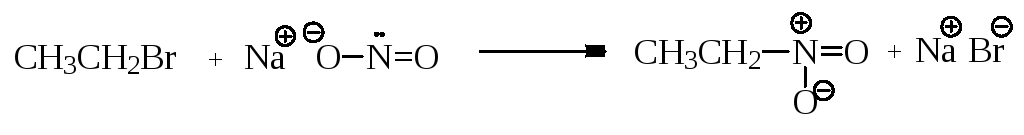
нитроэтан
алкилирование цианид-аниона – синтез нитрилов карбоновых кислот
![]()
4-хлор-1-бутен нитрил 4-пентеновой кислоты
алкилирование ацетиленидов
![]()
метилацетиленид натрия 2-гексин
Нуклеофильное замещение в алкилгалогенидах может происходить по двум альтернативным механизмам:
с последовательными процессами разрыва связи углерод-галоген и образования новой связи с нуклеофилом (мономолекулярное нуклеофильное замещение, или SN1)
с одновременным (синхронным) разрывом связи углерод-галоген и образованием новой связи с нуклеофилом (бимолекулярное нуклеофильное замещение, или SN2).
2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
Этот механизм представляет собой последовательность двух стадий, отличающихся константами скорости. На первой стадии субстрат медленно подвергается гетеролизу полярной связи углерод-галоген с образованием карбокатиона и галогенид-аниона.

На второй стадии образовавшийся карбокатион очень быстро взаимодействует с нуклеофилом с образованием ковалентной связи по донорно-акцепторному механизму: карбокатион предоставляет вакантную орбиталь, а нуклеофил – заполненную орбиталь.

Так как первая стадия протекает значительно медленнее, чем вторая, скорость реакции замещения определяется скоростью первой стадии, которая зависит только от концентрации галогенопроизводного как единственного участника этой стадии. Такой процесс нуклеофильного замещения является мономолекулярным, поэтому его обозначают SN1.
По механизму SN1 реагируют галогенопроизводные, которые при ионизации образуют устойчивые карбокатионы. Поэтому среди насыщенных галогенопроизводных этот механизм характерен, прежде всего, для третичных галогенидов, поскольку третичные карбокатионы являются более устойчивыми, чем вторичные или первичные. Так, например, следующие карбокатионы можно расположить в ряд по убыванию их устойчивости:

Если атом галогена соединен с асимметрическим атомом углерода хиральной молекулы, то мономолекулярное нуклеофильное замещение приводит к рацемизации по данному асимметрическому атому, поскольку образующийся карбокатион как плоская в области заряженного атома углерода частица может присоединить нуклеофил с одинаковой вероятностью с обеих сторон от этой плоскости с образованием двух энантиомеров.
Например, при щелочном гидролизе (S)-2,3-диметил-3-хлорпентана образуется смесь равных количеств энантиомерных спиртов, т.е. рацемический спирт.

Кроме третичных галогенопроизводных, по механизму SN1 могут реагировать также аллил- и бензилгалогениды, которые образуют стабилизированные за счет сопряжения карбокатионы.
![]()
аллил-катион
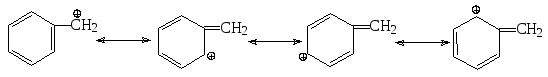
бензил-катион
Поскольку на стадии, лимитирующей скорость реакции, образуются катион и анион, то для протекания реакции по механизму SN1 лучше всего подходят растворители, обладающие возможностью стабилизировать и катионы, и анионы. Такими свойствами обладают так называемые полярные протонные растворители, способные хорошо сольватировать катионы и образовывать водородные связи с анионами. К полярным протонным растворителям относятся, например, вода, муравьиная кислота, а также водно-спиртовые и водно-кислотные смеси.
