
- •Часть 1. Физические основы механики
- •Введение
- •Глава I. Кинематика
- •§1. Перемещение точки. Векторы и скаляры
- •§2. Некоторые сведения о векторах
- •§3. Скорость
- •§4. Вычисление пройденного пути
- •§5. Равномерное движение
- •§6. Проекции вектора скорости на координатные оси
- •§7. Ускорение
- •§8. Прямолинейное равнопеременное движение
- •§9. Ускорение при криволинейном движении
- •§10. Кинематика вращательного движения
- •§11. Связь между векторами v и ω
- •Глава II. Динамика материальной точки
- •§12. Классическая механика. Границы ее применимости
- •§13. Первый закон Ньютона. Инерциальные системы отсчета
- •§14. Второй закон Ньютона
- •§15. Единицы измерения и размерности физических величин
- •§16. Третий закон Ньютона
- •§17. Принцип относительности Галилея
- •§18. Сила тяжести и вес
- •§19. Силы трения
- •§20. Силы, действующие при криволинейном движении
- •§21. Практическое применение законов Ньютона
- •§22. Импульс
- •§23. Закон сохранения импульса
- •Глава III. Работа и энергия
- •§24. Работа
- •§25. Мощность
- •§26. Потенциальное поле сил. Силы консервативные и неконсервативные
- •§27. Энергия. Закон сохранения энергии
- •§28. Связь между потенциальной энергией и силой
- •§29. Условия равновесия механической системы
- •§30. Центральный удар шаров
- •Глава IV. Неинерциальные системы отсчета
- •§31. Силы инерции
- •§32. Центробежная сила инерции
- •§33. Сила Кориолиса
- •Глава V. Механика твердого тела
- •§34. Движение твердого тела
- •§35. Движение центра инерции твердого тела
- •§36. Вращение твердого тела. Момент силы
- •§37. Момент импульса материальной точки» Закон сохранения момента импульса
- •§38 Основное уравнение динамики вращательного движения
- •§39. Момент инерции
- •§40. Кинетическая энергия твердого тела.
- •§41. Применение законов динамики твердого тела
- •§42. Свободные оси. Главные оси инерции
- •§43 Момент импульса твердого тела
- •§44. Гироскопы
- •§45. Деформации твердого тела
- •Глава VI. Всемирное тяготение
- •§46. Закон всемирного тяготения
- •§47. Зависимость ускорения силы тяжести от широты местности
- •§48. Масса инертная и масса гравитационная
- •§49. Законы Кеплера
- •§50. Космические скорости
- •Глава VII. Статика жидкостей и газов
- •§51. Давление
- •§52. Распределение давления в покоящихся жидкости и газе
- •§53. Выталкивающая сила
- •Глава VIII. Гидродинамика
- •§54. Линии и трубки тока. Неразрывность струи
- •§55. Уравнение Бернулли
- •§56. Измерение давления в текущей жидкости
- •§57. Применение к движению жидкости закона сохранения импульса
- •§58. Силы внутреннего трения
- •§59. Ламинарное и турбулентное течение
- •§60. Движение тел в жидкостях и газах
- •Часть 2. Колебания и волны
- •Глава IX. Колебательное движение
- •§61. Общие сведения о колебаниях
- •§62. Гармонические колебания
- •§63. Энергия гармонического колебания
- •§64. Гармоническим осциллятор Систему, описываемую уравнением
- •§65. Малые колебания системы вблизи положения равновесия
- •§66. Математический маятник
- •§67. Физический маятник
- •§68. Графическое изображение гармонических колебаний. Векторная диаграмма
- •§69. Сложение колебаний одинакового направления
- •§70. Биения
- •§71. Сложение взаимно перпендикулярных колебаний
- •§72. Фигуры Лиссажу
- •§73. Затухающие колебания
- •§74. Автоколебания
- •§75. Вынужденные колебания
- •§76. Параметрический резонанс
- •Глава X. Волны
- •§77. Распространение волн в упругой среде
- •§78. Уравнения плоской и сферической волн
- •§79. Уравнение плоской волны, распространяющейся в произвольном направлении
- •§80. Волновое уравнение
- •§81 Скорость распространения упругих волн
- •§82. Энергия упругой волны
- •§83. Интерференция и дифракция воли
- •§84. Стоячие волны
- •§85. Колебания струны
- •§86. Эффект Допплера
- •§87. Звуковые волны
- •§88. Скорость звуковых волн в газах
- •§89. Шкала уровней силы звука
- •§90. Ультразвук
- •Часть 3. Молекулярная физика и термодинамика
- •Глава ХI. Предварительные сведения
- •§91. Молекулярно-кинетическая теория (статистика) и термодинамика
- •§92. Масса и размеры молекул
- •§93. Состояние системы. Процесс
- •§94. Внутренняя энергия системы
- •§95. Первое начало термодинамики
- •§96. Работа, совершаемая телом при изменениях его объема
- •§97. Температура
- •§98. Уравнение состояния идеального газа
- •Глава XII. Элементарная кинетическая теория газов
- •§99. Уравнение кинетической теории газов для давлений
- •§100. Строгий учет распределения скоростей молекул по направлениям
- •§101. Равнораспределение энергии по степеням свободы
- •§102. Внутренняя энергия и теплоемкость идеального газа
- •§103. Уравнение адиабаты идеального газа
- •§104. Политропические процессы
- •§105. Работа, совершаемая идеальным газом при различных процессах
- •§106. Распределение молекул газа по скоростям
- •§107. Экспериментальная проверка закона распределения Максвелла
- •§108. Барометрическая формула
- •§109. Распределение Больцмана
- •§110. Определение Перреном числа Авогадро
- •§111. Средняя длина свободного пробега
- •§112. Явления переноса. Вязкость газов
- •§113. Теплопроводность газов
- •§114. Диффузия & газах
- •§115. Ультраразреженные газы
- •§116. Эффузия
- •Глава ХIII. Реальные газы
- •§117. Отклонение газов от идеальности
- •§118. Уравнение Ван-дер-Ваальса
- •§119. Экспериментальные изотермы
- •§120. Пересыщенный пар и перегретая жидкость
- •§121. Внутренняя энергия реального газа
- •§122. Эффект Джоуля-Томсона
- •§123. Ожижение газов
- •Глава XIV. Основы термодинамики
- •§124. Введение
- •§125. Коэффициент полезного действия тепловой машины
- •§126. Второе начало термодинамики
- •§127. Цикл Карно
- •§128. Коэффициент полезного действия обратимых и необратимых машин
- •§129. К.п.д. цикла Карно для идеального газа
- •§130. Термодинамическая шкала температур
- •§131. Приведенное количество тепла. Неравенство Клаузиуса
- •§132. Энтропия
- •§133. Свойства энтропии
- •§134. Теорема Нернста
- •§135. Энтропия и вероятность
- •§136. Энтропия идеального газа
- •Глава XV. Кристаллическое состояние
- •§137. Отличительные черты кристаллического состояния
- •§138. Классификация кристаллов
- •§139. Физические типы кристаллических решеток
- •§140. Тепловое движение в кристаллах
- •§141. Теплоемкость кристаллов
- •Глава XVI. Жидкое состояние
- •§142. Строение жидкостей
- •§143. Поверхностное натяжение
- •§144. Давление под изогнутой поверхностью жидкости
- •§145. Явления на границе жидкости и твердого тела
- •§146. Капиллярные явления
- •Глава XVII. Фазовые равновесия и превращения
- •§147. Введение
- •§148. Испарение и конденсация
- •§149. Плавление и кристаллизация
- •§150. Уравнение Клапейрона—Клаузиуса
- •§151. Тройная точка. Диаграмма состояния
- •Предметный указатель
Глава ХIII. Реальные газы
§117. Отклонение газов от идеальности
Как уже отмечалось, поведение реальных газов вольно хорошо описывается уравнением
(98.14)
ρV = mμ RT
только при не слишком высоких давлениях и достаточно высоких температурах. С повышением давлением и уменьшением температуры наблюдаются значительные отступления от уравнения. Во втором столбце таблицы 10 приведены значения произведения pV для масс
|
|
|
|
' |
|
ρ, ат |
ρV, ат*л |
|
ρ + |
α |
(V − b' ), ат*л |
2 |
|||||
|
|
|
|
V |
|
1 |
1,000 |
|
|
|
1,000 |
100 |
0,994 |
|
|
|
1,000 |
200 |
1,048 |
|
|
|
1,009 |
500 |
1,390 |
|
|
|
1,014 |
1000 |
2,069 |
|
|
|
0,893 |
|
|
|
|
|
|
азота, занимающей при нормальных условиях объем равный одному литру. Указанные значения даны для различных давлений и одной и тон же температуры. В соответствии с уравнением (98.14) произведение pV при неизменной температуре должно оставаться постоянным. В действительности, как видно из таблицы при давлениях порядка 200 ат наблюдаются заметные отклонения, которые, непрерывно возрастая с увеличением давления, достигают при, 1000 ат более 100%. Эти отклонения не представляются удивительными, поскольку при выводе уравнений (98.14) мы пренебрегали размерами молекул и их взаимодействием друг с другом на расстоянии. Вместе с тем при повышении давления возрастает плотность газа, что приводит к уменьшению среднего расстояния между молекулами; поэтому объем молекул и взаимодействие между ними начинают играть существенную роль.
Согласно произведенной нами оценке (см. § 92) размеры молекул имеют порядок 10-8 см. Принимая радиус молекулы r равным 10-8 см, для объема одной молекулы получим значение
43 π r3 = 43 3,14 10−24 ≈ 4 10−24 см3
Следовательно, объем молекул, содержащихся в 1 см3 газа при нормальных условиях, составит примерно:
4 10−24 2,7 1019 ≈ 10−4 см3
Этим объемом вполне можно пренебречь по сравнению с объемом газа (1 см3). Если бы газ следовал уравнению (98.14), то при повышении давления до 5000 ат его
плотность увеличилась бы в 5000 раз и объем молекул в 1 см3 составил бы 10−4 5 103 = 0,5см3 .
Таким образом, на долю молекул приходилась бы половина всего занимаемого газом объема. Доступным для движения молекул оказался бы объем в 2 раза меньший, чем при атмосферном давлении. Совершенно очевидно, что при этих условиях обратная пропорциональность объема давлению должна нарушаться.
Характер взаимодействия между молекулами лучше всего показать с помощью приведенной на рис. 264 кривой, изображающей взаимную потенциальную энергию двух молекул как функцию расстояния r между их центрами. При построении этой кривой потенциальная энергия молекул, находящихся на бесконечно большом расстоянии друг от друга (т. е. когда они не взаимодействуют) положена равной нулю. Следовательно идет так, что при r стремящемся к бес конечности асимптотически приближается к оси r.
294
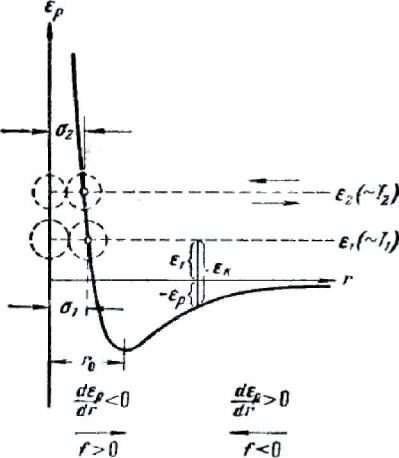
Зная потенциальную энергию как функцию r, можно определить силу, с которой взаимодействуют молекулы на разных расстояниях друг от друга. Для этого
Рис. 264. |
|
|
|
|
нужно воспользоваться известным из механики соотношением |
fr |
= − |
dε p |
|
dr |
||||
|
|
|
Знак «-» здесь отражает то обстоятельство, что силы, с которыми взаимодействуют молекулы, стремятся перевести их в состояние с наименьшей потенциальной энергией. Следовательно, на расстояниях, превышающих го, между молекулами действуют силы взаимного притяжения, а на расстояниях, меньших r0,—силы отталкивания. Крутизна хода кривой в соответствующем месте дает величину силы.
Рассмотрим с помощью кривой ε p процесс сближения (соударения) молекул. Поместим
мысленно центр одной из молекул в начало координат а центр второй молекулы представим перемещающимся по оси r. Пусть вторая молекула летит по направлению к первой из бесконечности, имея начальный запас кинетической энергии ε k = ε1 . Приближаясь к первой
молекуле, вторая под действием силы притяжения движется со все возрастающей скоростью. В результате кинетическая энергия молекулы ε k также растет. Однако полная энергия системы,
равная ε = ε1 + ε p остается неизменной (система двух молекул замкнута) и равной ε1 так как
одновременно уменьшается потенциальная энергия ер. При прохождении молекулой точки с координатой го силы притяжения сменяются силами отталкивания, вследствие чего молекула начинает быстро терять скорость (в области отталкивания кривая ε p идет очень круто). В
момент, когда потенциальная энергия r0 становится равной полной энергии системы ей скорость молекулы обращается в нуль. В этот момент имеет место наибольшее сближение молекул друг с другом. Минимальное расстояние ε1 на которое могут сблизиться центры
молекул, представляет собой эффективный диаметр молекулы. После остановки молекулы все явления протекают в обратной последовательности: сначала молекула движется со все
295
возрастающей скоростью под действием силы отталкивания; миновав расстояние го, молекула попадает под действие замедляющей ее движение силы притяжения и, наконец, удаляется на бесконечность, имея первоначальный запас кинетической энергии ε1 .
Из рис. 264 видно, что в случае, когда молекула начинает свое движение из бесконечности с большим запасом энергии ε 2 , минимальное расстояние d2 на которое сближаются центры
молекул, оказывается меньшим. Таким образом, эффективный диаметр молекул зависит от их средней энергии, а следовательно, и от температуры. С повышением температуры эффективный диаметр молекул d уменьшается, вследствие чего Средняя длина свободного пробега λ растет
[см. (111.7)].
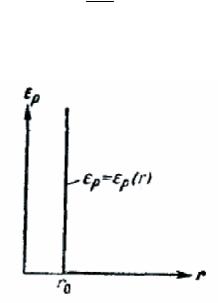
Характер взаимодействия между молекулами, предполагавшийся при выводе уравнения состояния идеального газа, соответствует потенциальной кривой, изображенной на рис. 265. На расстояниях, превышающих r0, ε p постоянна, вследствие чего сила равна нулю. При r=r0 ε p
обращается в бесконечность, образуя потенциальный барьер препятствующий сближению центров молекул на расстояния, меньшие rо. Такое упрощенное рассмотрение допустимо, если
средние расстояния между молекулами в газе достаточно велики: при больших r кривая ε ρ на
рис. 264 идет очень полого, вследствие чего dε ρ ≈ 0. По мере же уменьшения среднего dr
расстояния между молекулами, т. е при увеличении плотности газа, роль сил притяжения между молекулами все больше растет. Одновременно, как мы видели выше, сокращается та часть занимаемого газом объема, в пределах которой может происходить движение молекул.
Рис. 265.
Из всего сказанного вытекает, что уравнение, правильно описывающее поведение газов при больших плотностях, должно учитывать, во-первых, взаимное притяжение молекул друг к другу и, во-вторых, конечную величину собственного объема молекул.
§118. Уравнение Ван-дер-Ваальса
Из большого числа уравнений, предложенных для описания поведения реальных газов, самым простым и вместе с тем дающим достаточно хорошие результаты оказалось уравнение Ван-дер-Ваальса. Это уравнение получено путем внесения поправок в уравнение pVкм=RT и имеет следующий вид:
|
a |
|
|
|
|
|
p + |
(V |
− b) = RT, |
(118.1) |
|||
V 2 |
||||||
|
|
км |
|
|
||
|
км |
|
|
|
||
где р — давление, оказываемое на газ извне (равное давлению газа на стенки сосуда) а и b — константы Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. Если давление выражено в ньютонах на квадратный метр, а объем — в кубических метрах на киломоль, то константа а имеет размерность н•м4/кмоль2, а константа b
— м3/кмоль. Иногда константу а выражают в am*л2/моль2, а константу b — в л/моль.
296

Константа b определяет ту часть объема, которая недоступна для движения молекул вследствие их конечных размеров. Эта константа равна учетверенному объему молекул, что вытекает из следующих соображений.
Пусть в сосуде имеется лишь две молекулы. Центр любой из этих молекул не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра молекулы d (рис. 266).
Рис. 266.
Таким образом, для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы. В расчете на одну молекулу недоступным оказывается объем, равный учетверенному объему молекулы. Поскольку молекулы, как правило, сталкиваются попарно (вероятность столкновений трех и более молекул крайне мала), приведенное рассуждение справедливо для любой пары молекул. Отсюда следует, что в расчете на каждую из молекул газа недоступным будет объем, равный четырем объемам одной молекулы, а для всех молекул — объем, равный учетверенному суммарному объему молекул.
Поправка a/V2км дает внутреннее давление pi, обусловленное взаимным притяжением молекул друг к другу. Если бы взаимодействие между молекулами вдруг прекратилось, то для того, чтобы удержать газ в пределах того же объема, понадобилось бы увеличить внешнее давление на величину, равную внутреннему давлению pi. Обратная пропорциональность pi квадрату объема объясняется следующие причинами. Вследствие быстрого убывания сил притяжения между молекулами с увеличенном расстояния между ними, начиная с некоторого расстояния r, взаимодействием между молекулами можно вполне пренебречь. Расстояние r называется радиусом молекулярного действия. Сферу радиуса r называют сферой молекулярного действия.
Рис. 267.
Проведем мысленно плоскость в газе (рис. 267) и попытаемся оценить силу, с которой притягивают друг друга частицы газа движению по обе стороны от этой плоскости. Относиться эту силу к единице поверхности, мы получим внутреннее давление.
297

Каждая из молекул, находящихся слева от воображаемой плоскости, испытывает притяжение со стороны тех молекул, находящихся справа от плоскости, которые попадают в пределы выступающей за плоскость части сферы молекулярного действия, описанной вокруг данной молекулы (эти молекулы обозначены на рис. 267 крестиками). Число таких молекул, а следовательно, и сила, действующая па каждую из молекул, лежащих слева от плоскости, пропорциональны числу молекул в единице объема n. Притяжение со стороны молекул, находящихся справа от плоскости, испытывают только те молекулы, находящиеся слева от плоскости, которые попадают в слой толщины r. Число этих молекул также пропорционально n. Таким образом, сила, с которой одна часть газа притягивает другую, а следовательно, и внутреннее давление оказываются пропорциональными n2. Поскольку n обратно пропорционально объему газа, внутреннее давление будет обратно пропорционально квадрату объема.
Уравнение (118.1) написано для одного киломоля газа. Чтобы перейти к уравнению для произвольной массы газа m, соответствующей z киломолей газа ( z = m / μ ), нужно учесть, что r киломолей при тех же условиях занимают в z раз больший объем,
V=zVкм Заменяя в (118.1) Vкм через V/z получаем:
|
z |
2 |
a |
|
|
|
|
|
|
|
|
V |
|
||||
p + |
|
|
|
|
|
− b |
= RT. |
|
|
|
2 |
z |
|||||
|
V |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Умножив это уравнение на z и введя обозначения
a′ = z2a;b′ = zb,
приходим к уравнению Вандер-Ваальса для z молей;
|
a′ |
|
|
p + |
|
(V − b′) = zRT. |
|
V 2 |
|||
|
|
(118.2)
(118.3)
Буквами a' и b' обозначены константы Ван-дер-Ваальса для z киломолей. Их связь с a и b дается соотношениями (118.2). Размерность а' равна н*м4, константа b’ имеет размерность объема.
Насколько уравнение Ван-дер-Баальса лучше передает поведение газов, чем уравнение (98.14), можно судить по данным, приведенным в таблице 10 (см. предыдущий параграф). В
|
a′ |
|
1 |
|
третьем столбце таблицы даны значения величины p + |
|
(V − b′) |
|
для той же массы азота, |
|
V 2 |
|
|
|
для которой даны во втором столбце значения pV. Как видно из таблицы» уравнение Ван-дер- Ваальса гораздо лучше согласуется с экспериментом, чем уравнение (98.14).
В соответствии с тем фактом, что все реальные газы с уменьшением плотности приближаются по своим свойствам к идеальному газу, уравнение Ван-дер-Ваальса в пределе, при стремлении объема к бесконечности переходит в уравнение (98.14). В этом можно убедиться, вынеся в уравнении (118.3) р и V за скобки:
|
|
1 a′ |
|
b′ |
|
|
pV 1 |
+ |
|
1 |
− |
|
= zRT , |
|
||||||
|
|
pV V |
|
V |
|
|
и учитывая, что произведение pV остается примерно постоянным.
Раскрыв скобки в уравнении (118.3) и умножив получившееся выражение на V2, уравнение Ван-дер-Ваальса можно привести к виду
1 В соответствии с (118.3). Эта величина должна быть постоянной.
298
pV |
3 |
′ |
2 |
′ |
′ ′ |
(118.4) |
|
− (b p + zRT )V |
|
+ a V = a b . |
|
||
Получилось кубическое уравнение относительно V, коэффициенты которого зависят от параметров р и T. Кубическое уравнение со свободным членом и вещественными коэффициентами имеет три решения, причем в зависимости от соотношения между коэффициентами либо все три решения будут вещественными, либо одно решение — вещественным, а два — комплексными. Поcкольку объем может быть только вещественным, комплексные решения не имеют физического смысла.
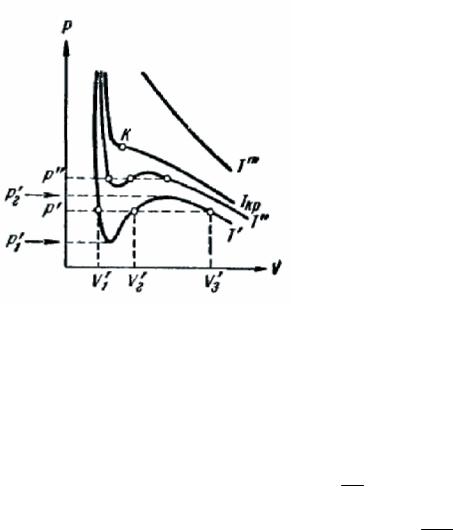
На рис. 268 изображены изотермы Ван-дер-Ваальса для нескольких значений температуры.
При температуре T’ и давлениях в пределах |
p1 |
p2 |
′ до |
′ коэффициенты в (118.4) таковы, что все |
три решения уравнения оказываются вещественными; при иных давлениях вещественным будет только одно решение. Различие между тремя вещественными решениями уравнения с
повышением температуры уменьшается (ср. изотермы T ′ и T ′′ ; T ′ > T ′′). Начиная с определенной, своей для каждого вещества температуры Ткр при любом давлении вещественным остается только одно решение уравнения (118.4). Температура Ткр называется критической.
Рис. 268.
Если повышать температуру, то точки, соответствующие решениям уравнений V ′ , V ′ и
1 2
V3′ , все больше сближаются, сливаясь при критической температуре в одну, обозначенную на
рис. 268 буквой К. Точка К называется критической. Дли соответствующей изотермы К служит точкой перегиба. Ей соответствуют три совпадающих вещественные решения уравнения (118.4). Касательная к критической изотерме в точке К является пределом, к которому стремятся секущие р', р" и т. д. при приближении температуры к критической. Следовательно,
эта касательная, как и все секущие, параллельна оси V, тaк что производная dp в точке К
dV
равна нулю. Кроме того, в точке перегиба должна быть равна нулю вторая производная d 2 p .
dV 2
Разрешим уравнение (118.1) относительно р:
p = |
RT |
− |
a |
(118.5) |
|
Vкм − b |
Vкм2 |
||||
|
|
|
Дифференцирование этого выражения по Vкм дается
299
