с л о в о п о ч и н а є т ь с я із н а з в и в у г л е в о д н ю з т а к и м с а м и м ч и с л о м а т о м і в К а р б о н у , що й у м о л е к у л і к и с л о т и ( в к л ю ч а ю ч и а т о м К а р б о н у
к а р б о к с и л ь н о ї групи), |
і |
м а є з а к і н ч е н н я |
ова. |
Д р у г и м є |
|
слово кислота. |
Н у м е р а ц і ю |
в голов - |
н о м у к а р б о н о в о м у л а н ц ю з і п о ч и н а ю т ь і з |
а т о м а К а р б о н у к а р б о к с и л ь н о ї г р у п и : |
|
|
|
|
|
З |
2 |
|
1 /.О |
|
|
|
|
|
3 І |
І |
|
чон |
|
|
|
|
|
СНз СН 3 |
|
|
|
|
|
2,3-диметилбутанова кислота |
|
|
|
|
|
|
|
|
Таблиця |
5 |
Формули і назви насичених монокарбонових кислот |
|
|
|
|
|
|
|
|
|
Формула кислоти |
|
Назва кислоти |
|
|
|
|
|
|
|
|
|
|
|
тривіальна |
|
систематична |
|
|
|
|
|
|
|
|
|
Н - С О О Н |
|
М у р а ш и н а |
|
|
Метанова |
|
|
СНз-СООН |
|
Оцтова |
|
|
Етанова |
|
|
|
|
|
|
|
|
|
|
|
сн3-сн2-соон |
|
Пропіонова |
|
|
Пропанова |
|
|
сн3-сн2-сн2-соон |
|
Масляна |
|
|
Бутанова |
|
|
|
С Н з - С Н - С О О Н |
|
Ізомасляна |
|
|
Метилпропанова |
|
СНз |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сн3-сн2-сн2-сн2-соон |
|
Валеріанова |
|
Пентанова |
|
|
С Н 3 - С Н - С Н 2 - С О О Н |
|
Ізовалеріанова |
|
З-Метилбутанова |
|
СНз |
|
|
|
|
|
|
|
|
СН 3 - (СН 2 ) 4 - СООН |
|
Капронова |
|
|
Гексанова |
|
|
|
|
. . . |
|
|
|
|
|
|
СН 3 - (СН 2 ) 1 4 - СООН |
|
Пальмітинова |
|
Гексадеканова |
|
СН 3 - (СН 2 ) 1 5 - СООН |
|
Маргаринова |
|
Гептадеканова |
|
СН 3 - (СН 2 ) 1 6 - СООН |
|
Стеаринова |
|
|
Октадеканова |
|
|
Д л я н а й п р о с т і ш и х к а р б о н о в и х к и с л о т |
іноді |
в ж и в а ю т ь л а т и н с ь к і н а з в и : Н С О О Н |
— формі - |
а т н а к и с л о т а , СН 3 СООН — а ц е т а т н а |
к и с л о т а . |
Ч а с т і ш е в и к о р и с т о в у ю т ь |
відповідні |
н а з в и |
ї х |
аніонів: |
|
|
|
|
|
|
|
|
|
|
н-с(0_ |
|
сн:ГсГо |
|
|
|
|
форміат-іон |
|
ацетат-іон |
|
|
|
Від ц и х н а з в п о х о д я т ь н а з в и |
солей карбоно - |
в и х к и с л о т . |
|
|
З а г а л ь н а ф о р м у л а й о н а к и с л о т н о г о з а л и ш - |
ку |
м о н о к а р б о н о в о ї к и с л о т и — |
КСО0 . |
• |
Н а п и ш і т ь ф о р м у л и к а л ь ц і й |
ф о р м і а т у , амо- |
|
ній а ц е т а т у . |
|
С и с т е м а т и ч н і н а з в и а н і о н і в к а р б о н о в и х
к и с л о т с к л а д а ю т ь , д о д а ю ч и д о н а з в и |
відповід- |
ного в у г л е в о д н ю с у ф і к с - оат: НСОО |
— мета - |
ноат - іон, СН3 СОО" — етаноат - іон .
І з о м е р ія к а р б о н о в и х к и с л о т ( с т р у к т у р н а )
зумовлена різною будовою карбонового ланцю-
га м о л е к у л , а н е н а с и ч е н и х к и с л о т — ще й
положенням |
кратного зв'язку. |
Для |
трьох най- |
п р о с т і ш и х |
м о н о к а р б о н о в и х |
к и с л о т |
насичено - |
го р я д у не |
існує ізомерів - кислот, |
а ф о р м у л і |
С 3 Н 7 СООН відповідають дві к и с л о т и (табл. 5). Д л я к а р б о н о в и х к и с л о т ( к р і м м е т а н о в о ї )
х а р а к т е р н а т а к о ж м і ж к л а с о в а і з о м е р і я . Ізо- м е р о м к о ж н о ї к и с л о т и є естер:
СН3СООН |
НСООСН3 |
оцтова кислота |
метиловий естер |
|
мурашиної кислоти |
шкшішшшш^^шшшшшшшшшшшш
Карбонові кислоти — похідні вуглеводнів, молекули яких містять одну або кілька карбоксильних груп. Загальна формула одноосновних карбонових кислот — ЙСООН.
Карбонові кислоти поширені в природі. Карбонові кислоти класифікують за кількістю
карбоксильних груп у молекулі, особливостями зв'язків у карбоновому ланцюзі. Для цих сполук використовують переважно тривіальні назви.
Ізомерія карбонових кислот зумовлена різною будовою карбонового ланцюга в молекулах, а ненасичених кислот — ще й положенням кратного зв'язку. Для карбонових кислот існує також міжкласова ізомерія; їх ізомерами є естери.
206. Назвіть причини багатоманітності карбонових кислот.
207. Знайдіть |
відповідність. |
|
Назва кислоти |
Тип кислоти |
1) щавлева; |
а)одноосновна; |
2)оцтова; |
б)двохосновна; |
3)бензоатна; |
в)насичена; |
4) |
акрилова; |
г) ароматична; |
5) |
олеїнова; |
г) вища; |
6) |
стеаринова; |
д)ненасичена. |
208. Дайте назви кислотам, молекули яких мають такі структурні фор-
мули: |
|
а) С Н 3 - С Н 2 - С Н - С О О Н ; |
в ) СН 2 - СН 2 - СООН . |
СН3 |
Вг |
б) СН 3 - СН — СН - СООН; |
|
С2 Н5 СН3 |
|
209. Напишіть структурні формули |
молекул диметилпропанової та |
З-метил-2-хлоропентанової кислот.
210. Зобразіть структурні формули молекул кислот С6 Н12 02 , якщо головні ланцюги в них містять чотири атоми Карбону. Назвіть сполуки.
211. Виведіть формулу насиченої одноосновної карбонової кислоти, якщо масова частка Оксигену в ній становить 31,37 %.
212. Насичена одноосновна карбонова кислота має молярну масу
116 г/моль і два третинні атоми Карбону у вуглеводневому залишку. Виведіть формулу кислоти і дайте їй назву.
§ І Р " Насичені одноосновні карбонові кислоти
Матеріал параграфа допоможе вам:
прогнозувати властивості кислот за будовою їхніх молекул; повторити властивості карбонових кислот;
отримати відомості про способи добування кислот і сфери їх застосування.
\ Я Г 6+
р о < - н
к— с \ о—н
Мал. 75.
Перекривання
орбіталей
атомів
у карбоксильній групі
Електронна будова молекул. У карбок-
с и л ь н і й |
групі |
а т о м К а р б о н у |
пере- |
буває у |
стані |
8р 2 - гібридизації . Т о м у |
спо- |
л у ч е н і з н и м а т о м и р о з м і щ е н і на о д н і й
|
|
|
|
|
|
п л о щ и н і 1 . |
р - О р б і т а л ь а т о м а К а р б о н у |
кар - |
б о к с и л ь н о ї |
г р у п и |
п е р е к р и в а є т ь с я н е |
тіль - |
ки з р - о р б і т а л л ю |
« к р а й н ь о г о » а т о м а |
Окси - |
гену ( з а в д я к и |
ц ь о м у |
у т в о р ю є т ь с я тт-зв'язок |
у к а р б о н і л ь н і й |
групі |
С = 0 ) , а й із о р б і т а л л ю |
а т о м а О к с и г е н у г і д р о к с и л ь н о ї г р у п и ОН . У н а с л і д о к ц ь о г о м і ж т р ь о м а а т о м а м и в к а р б о к с и л ь н і й г р у п і у т в о р ю є т ь с я є д и н а
л - е л е к т р о н н а система ( м а л . |
75). |
Е л е к т р о н н а г у с т и н а в ц і й |
системі с и л ь н о |
з м і щ е н а д о а т о м а О к с и г е н у к а р б о н і л ь н о ї |
г р у п и . Т о м у з в ' я з о к |
О - Н є б і л ь ш п о л я р - |
н и м , н і ж у с п и р т а х . |
А т о м К а р б о н у г р у п и |
- С О О Н н а б у в а є п о з и т и в н о г о з а р я д у ; д о |
нього з м і щ у є т ь с я |
е л е к т р о н н а г у с т и н а від |
?і |
г>І-о |
вуглеводневого з а м і с н и к а :
Т
н
Н а я в н і с т ь к а р б о к с и л ь н о ї г р у п и в м о л е к у л і
к и с л о т и п о л е г ш у є |
з а м і щ е н н я а т о м |
і в Гідроге- |
н у , я к і с п о л у ч е н і з |
н а й б л и ж ч и м до |
цієї г р у п и |
а т о м о м К а р б о н у . |
|
|
О с о б л и в о с т і б у д о в и м о л е к у л к а р б о н о в и х |
к и с л о т |
у м о ж л и в л ю ю т ь р е а к ц і ї з а у ч а с т ю ц и х |
с п о л у к |
і з р о з р и в о м з в ' я з к і в О - Н , а т а к о ж |
С - О Н і С - Н |
(у г р у п і СН 2 , с п о л у ч е н і й із кар - |
б о к с и л ь н о ю |
групою) . |
Ф і з и ч н і властивості . М у р а ш и н а , о ц т о в а і п р о п і о н о в а к и с л о т и за з в и ч а й н и х у м о в — р і д и н и з р і з к и м з а п а х о м , щ о н е о б м е ж е н о з м і ш у ю т ь с я з в о д о ю з у т в о р е н н я м р о з ч и н у .
1 Кути між лініями, що з'єднують центри цих атомів, наближають -
гн до 120°.
Р о з ч и н е н н ю с п р и я є ф о р м у в а н н я в о д н е в и х з в ' я з к і в м і ж м о л е к у л а м и к и с л о т и і в о д и . М а с л я н а т а і н ш і к и с л о т и з к і л ь к і с т ю а т о м і в
Карбону в |
м о л е к у л а х до д е в ' я т и є |
о л і ї с т и м и |
р і д и н а м и , |
м а ю т ь |
н е п р и є м н и й з а п а х |
і |
погано |
р о з ч и н я ю т ь с я у |
воді. В и щ і карбонові |
к и с л о - |
ти — тверді, н е р о з ч и н н і у воді р е ч о в и н и . |
Т е м п е р а т у р и к и п і н н я к а р б о н о в и х к и с л о т |
в и щ і , н і ж о д н о а т о м н и х с п и р т і в і з т а к о ю |
с а м о ю к і л ь к і с т ю |
атомів К а р б о н у в м о л е к у л а х . |
Ц е с в і д ч и т ь п р о с и л ь н і ш у м і ж м о л е к у л я р н у |
в з а є м о д і ю |
в к и с л о т а х . Я к щ о м і ж д в о м а моле - |
к у л а м и с п и р т у в и н и к а є т і л ь к и о д и н в о д н е в и й |
з в ' я з о к (с. |
136), |
т о м і ж м о л е к у л а м и к и с л о т и |
ї х м о ж е бути два: |
|
|
й~сЧ)-н - о' с к•
|
С у к у п н і с т ь |
двох |
с п о л у ч е н и х м о л е к у л |
нази - |
|
в а ю т ь д и м е р о м ' . Д и м е р и ц и к л і ч н о ї б у д о в и |
|
д о с и т ь с т і й к і . |
|
|
|
|
|
|
Х і м і ч ні властивості. К а р б о н о в і |
к и с л о т и , я к |
|
і н е о р г а н і ч н і , д и с о ц і ю ю т ь у в о д н и х р о з ч и н а х |
|
н а к а т і о н и Г і д р о г е н у й а н і о н и к и с л о т н и х |
|
з а л и ш к і в : |
|
|
|
|
|
|
|
|
|
К - С О О Н <± Н+ |
+ Д - СОО" . |
|
|
Д и с о ц і а ц і я в і д б у в а є т ь с я в н а с л і д о к р о з р и в у |
|
п о л я р н и х з в ' я з к і в О - Н у м о л е к у л а х . |
|
|
Усі |
карбонові |
кислоти |
є слабкими. Зі |
збіль- |
|
ш е н н я м к а р б о н о в о г о л а н ц ю г а в м о л е к у л а х |
|
с и л а н а с и ч е н и х о д н о о с н о в н и х к а р б о н о в и х |
|
к и с л о т з м е н ш у є т ь с я : |
|
|
|
Н - С ' |
|
> |
С Н , - С |
чон |
> С Н 3 - С Н 2 - С Ч |
> ... |
чон |
|
3 |
|
2 |
чон |
|
|
О ц т о в а к и с л о т а с л а б к і ш а з а м у р а ш и н у . |
|
В у г л е в о д н е в и й |
з а м і с н и к |
СН 3 збагачує |
е л е к т - |
|
р о н н о ю г у с т и н о ю |
а т о м К а р б о н у |
г р у п и |
СООН |
|
б і л ь ш е , н і ж а т о м Г і д р о г е н у в м о л е к у л і |
1 Термін походить від грецьких префікса сіі(з) — двічі і слова тегоз — частина.
Н С О О Н . Ц е с п р и ч и н я є м е н ш у п о л я р н і с т ь з в ' я з к у О - Н у м о л е к у л і СН3 СООН.
Якщо атоми Гідрогену у вуглеводневому залишку молекули кислоти замінити на атоми більш електронегативного елемента — галогену, то здатність молекули відщеплювати йон Н+, тобто сила кислоти, помітно зростає (мал. 76). Причина полягає в тому, що внаслідок перерозподілу електронної густини в молекулі під впливом атомів
галогену полярність |
зв'язку О-Н збільшується: |
сі |
П>. |
т |
5+ІО |
і |
(о <—н |
СІ |
^ |
Мал. 76. Забарвлення універсального індикатора в розчинах трихлорооцтової та оцтової кислот однакової концентрації
ссиєоон |
СН3С00Н |
|
Реакції з |
металами, |
оксидами, |
гідрокси- |
дами, солями. |
Карбонові |
к и с л о т и , як |
і біль- |
ш і с т ь н е о р г а н і ч н и х к и с л о т , в з а є м о д і ю т ь із м е т а л а м и з в и д і л е н н я м водню
|
|
|
|
Ге + 2СН3 СООН |
(СН3 СОО)2 Ге + Н2 Т, |
з о с н о в н и м и |
о к с и д а м и , |
основами, д е я к и м и |
а м ф о т е р н и м и |
о к с и д а м и і |
гідроксидами, соля- |
ми с л а б к и х кислот ( н а п р и к л а д , карбонатами): 2НСООН + СаО (НСОО)2 Са + Н 2 0 ;
2СН3 СООН + К а 2 С 0 3 -> 2СН3 СООМа + С02 Т + Н 2 0 .
• Н а п и ш і т ь р і в н я н н я р е а к ц і ї п р о п а н о в о ї к и с л о т и з к а л і й гідроксидом .
Я к щ о д о безбарвного р о з ч и н у ацетату л у ж - ного чи л у ж н о з е м е л ь н о г о елемента добавити
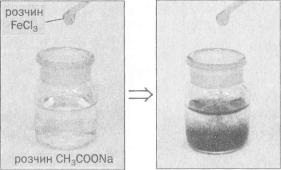
т р о х и жовтувато - бурого |
р о з ч и н у ферум(ІІІ) |
х л о р и д у , |
то |
він набуває |
червоного к о л ь о р у |
(мал . 77). |
За |
допомогою |
такої реакції м о ж н а |
в и я в и т и в |
розчині ацетат - іони . |
Мал. 77.
Якісна реакція на ацетат-іони
Реакції зі |
спиртами. |
Карбонові |
к и с л о т и |
за |
наявності невеликої к і л ь к о с т і концентрованої |
сульфатної к и с л о т и взаємодіють зі с п и р т а м и . |
П р о д у к т а м и ц и х |
р е а к ц і й є естери. Звідси |
й |
назва |
— |
реакція |
естерифікації: |
|
|
|
О |
|
|
Н2804 |
(КОНЦ.) і СНо-С |
, 0 |
|
СНо-С |
|
|
Ч 0С 2 Н 5 |
' | О Н + Н О -С2 Н5 < |
н20 |
|
оцтова кислота |
етиловий спирт |
|
етиловии естер |
|
|
|
|
|
оцтової кислоти |
|
Установлено, що |
к о ж н а м о л е к у л а |
води утво- |
р ю є т ь с я з а р а х у н о к О Н - г р у п и м о л е к у л и |
к и с л о т и й а т о м а Г і д р о г е н у г і д р о к с и л ь н о ї |
групи |
м о л е к у л и спирту . |
|
|
|
Д о к л а д н о естери р о з г л я н у т о в § |
27. |
|
|
Оцтова кислота є стійкою щодо дії окисників. Вона не взаємодіє, наприклад, із калій перманганатом. Однак пару цієї кислоти можна підпалити на повітрі.
Специфічні |
властивості |
мурашиної |
кис- |
лоти. М у р а ш и н а к и с л о т а |
— |
є д и н а із карбоно- |
вих к и с л о т , у |
м о л е к у л і |
я к о ї |
м і с т и т ь с я |
альде- |
гідна г р у п а |
• Тому вона, як і альдегіди, |
о к и с н ю є т ь с я |
к а л і й п е р м а н г а н а т о м , |
арген - |
|
|
|
|
|
|
|
|
|
тум(І) оксидом |
у розчині а м о н і а к у (тобто дає |
|
р е а к ц і ю |
«срібного дзеркала»): |
н - с Х 0 н |
+ |
[0] |
|
Н О - С |
|
або Н2СО< — » С02Т + Н20; |
У® |
, |
Л |
лл |
, охттт |
(.НГО |
2А£І + (МН„)2 С03 . |
Н - С Х ( Ж |
+ А§20 + 2МН3 |
|
|
|
П р и нагріванні з к о н ц е н т р о в а н о ю сульфат - |
|
ною |
кислотою |
м у р а ш и н а к и с л о т а розклада - |
|
є т ь с я на карбон(ІІ) оксид і воду: |
|
|
|
НСООН |
Н г В ° 4 ( к о н ц ' ) > |
СОТ + Н 2 0 . |
Добування. Карбонові к и с л о т и добувають у промисловості п е р е в а ж н о за р е а к ц і я м и окис- н е н н я .
Основний і п е р с п е к т и в н и й метод ґрунтуєть -
ся на окисненні алканів:
|
|
|
|
|
|
|
|
|
2 С Н 3 С Н 2 С Н 2 С Н 3 + 5 0 2 |
и р Л |
> |
4СН3 СООН + 2 Н 2 0 ; |
н-бутан |
|
|
|
|
|
оцтова кислота |
|
2СН4 + 3 0 2 |
|
к |
> |
2НСООН + 2 Н 2 0 . |
|
метан |
|
|
мурашина кислота |
|
Карбонові к и с л о т и |
т а к о ж |
добувають |
окис- |
ненням альдегідів |
і |
спиртів. П р о д у к т о м |
реак - |
ції за участю альдегіду є к и с л о т а |
|
с н 3 - с ч н |
+ГОІ |
с н 3 - с ч о н |
|
П р и о к и с н е н н і |
спиртів |
к и с л о т и у т в о р ю ю т ь с я |
на другій стадії перетворення: |
|
|
я - с н 2 - о н |
|
|
д - < ° л ш , |
|
первинний спирт |
|
|
альдегід |
кислота |
У давнину оцет виробляли з вина. При |
контак- |
ті натурального виноградного вина, |
в якому |
масова частка етанолу не перевищує 10 %, з повітрям за участю особливих бактерій протягом двох-трьох тижнів відбувається окиснення спирту до оцтової кислоти. Цей процес називають оцтовокислим бродінням. Назва розчину оцтової кислоти, добутого таким способом, — винний оцет.
.175
О д и н і з п р о м и с л о в и х м е т о д і в д о б у в а н н я
метанової к и с л о т и п о л я г а є |
у з д і й с н е н н і р е а к - |
ції |
карбон(ІІ) |
о к с и д у з н а т р о н н и м |
вапном (це |
с у м і ш гідроксидів Н а т р і ю і |
К а л ь ц і ю ) і наступ- |
ній |
взаємодії |
натрій форміату із |
с у л ь ф а т н о ю |
кислотою: |
|
|
|
|
СО + МаОН |
Н С О О Ш -Ш28О4> НСООН . |
У |
лабораторії |
карбонові |
к и с л о т и |
добувають |
п е р е в а ж н о за р е а к ц і я м и їхніх солей із сильни - |
ми |
н е о р г а н і ч н и м и к и с л о т а м и (зазвичай суль- |
фатною): |
|
|
|
ДСООМа + Н 2 8 0 4 (надл.) -> ДСООН + № 1 1 3 0 , . З а с т о с у в а н н я . Н а й б і л ь ш о г о в и к о р и с т а н н я серед к а р б о н о в и х к и с л о т н а б у л и о ц т о в а й м у р а ш и н а . О ц т о в у к и с л о т у з а с т о с о в у ю т ь у х а р ч о в і й , ш к і р я н і й , х і м і ч н і й п р о м и с л о в о с т і , п р и ф а р б у в а н н і т к а н и н , у в и р о б н и ц т в і ш т у ч - н и х в о л о к о н , д о м а ш н ь о м у господарстві ( д л я к о н с е р в у в а н н я , я к п р и п р а в у д о ї ж і ) . П р о м и с - ловість в и п у с к а є с т о л о в и й оцет ( в о д н и й роз- ч и н о ц т о в о ї к и с л о т и з м а с о в о ю ч а с т к о ю
СНдСООН 5 — 1 0 |
% ) , о ц т о в у е с е н ц і ю ( 7 0 — |
8 0 % ) , я б л у ч н и й |
оцет . М у р а ш и н у к и с л о т у |
з а с т о с о в у ю т ь в о р г а н і ч н о м у с и н т е з і , т е к с - т и л ь н і й п р о м и с л о в о с т і , м е д и ц и н і , в и р о б н и ц - тві фарб, г у м и .
В И С Н О В К И
Карбонові кислоти за звичайних умов є рідинами або твердими речовинами. Розчинність їх у воді зменшується зі зростанням кількості атомів Карбону в ланцюзі. Ці сполуки мають вищі температури кипіння, ніж одноатомні спирти з такою самою кількістю атомів Карбону в молекулах.
Карбонові кислоти дисоціюють у водних розчинах, реагують із м е т а л а м и , д е я к и м и оксидами і гідроксидами, солями, а також зі спиртами.
У промисловості карбонові кислоти добувають окисненням алканів, спиртів, альдегідів, а в лабораторії — за реакціями їхніх солей із сильними неорганічними кислотами.
Карбонові кислоти використовують у хімічній, шкіряній, харчовій, текстильній промисловості, медицині, побуті.
о
а
213. Поясніть, чому мурашина кислота сильніша за оцтову. Запишіть схеми електролітичної дисоціації обох сполук.
214. Напишіть рівняння реакцій і дайте назви їх продуктам:
а) НСООН + М§ |
С Н 3 С 0 0 Н + РЬ(ОН)2 ->• |
НСООН + № 2 5 Ю 3 |
б) СН3СООН + С и О —> |
С2 Н5 |
СООН + К 2 С 0 3 |
С2 Н5 |
СООН + С4 Н9 ОН -> |
215. Допишіть у йонно-молекулярні рівняння замість крапок формули йонів, молекул і наведіть відповідні молекулярні рівняння:
а) Н+ + С2 Н5 СОО |
-> ...; |
|
|
б) 0Н~ + С2 Н5 СООН -> ... + ...; |
|
в) 5і0|" + 2 С Н 3 С 0 0 Н |
... + ... . |
|
216. Складіть рівняння |
реакцій, за допомогою яких можна здійснити |
такі перетворення (в останніх завданнях замініть крапки на фор- |
мули сполук): |
|
|
|
а) С -> СаС2 -> С2 Н2 -> СН 3 СН0 -> СН 3 С00Н; |
|
б)СН 4 |
-» ... -» |
С2 Н6 |
-» С2 Н5 Вг -> ... |
СН3 СНО -> ... -» |
- » СН3 СООС3 Н7 ; |
|
|
в) С2 Н6 |
С2 Н5 СІ - > . . . - > С4 Н9 СІ - » С4 Н9 0Н - > . . . - > С3 Н7 СООН - » |
- » С3 Н7 СОО№. |
|
|
Укажіть умови, необхідні для перебігу реакцій. |
|
217. Визначте масову частку оцтової кислоти в розчині, виготовленому добавлянням до 100 г 80 %-го розчину кислоти:
а) 100 мл води; б) 100 г 9 %-го розчину цієї кислоти;
в) 100 мл 20 %-го розчину цієї кислоти, густина якого 1,026 г/мл.
218. Яка маса розчину натрій гідроксиду з масовою часткою лугу 20 % витрачається на нейтралізацію 50 г розчину пропанової кислоти з масовою часткою кислоти 7,4 %?



