
- •Міністерство освіти і науки, молоді та спорту України
- •Навчальний посібник до вивчення курсу «Основи проектування хімічних виробництв»
- •Оглавление
- •Глава 1 основные этапы и организация проектирования
- •Глава 2 состав исходных данных и основные стадии
- •Глава 3 системы автоматизированного проектирования 78
- •Глава 4 введение в проектирование 90
- •Глава 5 выбор и разработка технологической схемы
- •Глава 6 выбор технологического оборудования
- •Глава 7 уравнения материального баланса технологи-
- •Глава 8 технологический расчет основной и
- •Глава 9 тепловой расчет основного оборудования 141
- •Глава 10 гидравлические расчеты 166
- •Глава 11 механический расчет 175
- •Глава 12 конструкционные материалы в химическом
- •Глава 13 оформление отдельных элементов химической
- •Глава 14 трубопроводы и трубопроводная арматура 224
- •Глава 15 вспомогательное оборудование химических
- •Введение
- •Глава 1 основные этапы и организация проектирования химических производств
- •1.1. Перспективный план и технико-экономическое обоснование
- •1.2. Задание на проектирование
- •1.3. Выбор района размещения предприятия и площадки строительства
- •1.3. «Роза ветров» района размещения предприятия и площадки строительства
- •1.4. Основные принципы проектирования зданий и сооружений химической промышленности
- •1.5. Разработка проектной документации по охране окружающей среды
- •1.5.1. Экологическое прогнозирование
- •1.5.2. Разработка прогноза загрязнения воздуха
- •1.5.3. Прогнозирование состояния поверхностных и подземных вод
- •1.5.4. Прогноз воздействия объекта при возможных авариях
- •1.6. Технологический процесс как основа промышленного проектирования
- •1.7. Генеральный план химических предприятий
- •1.8. Типы промышленных зданий
- •1.8.1 Основные элементы конструкции производственных зданий и их назначение
- •1.8.2 Одноэтажные промышленные здания
- •1.8.3. Многоэтажные здания
- •1.8.4. Вспомогательные здания и помещения химических предприятий
- •1.8.5. Склады промышленных предприятий
- •1.9. Инженерные сооружения
- •1.10. Специальные вопросы проектирования химических предприятий
- •Глава 2 состав исходных данных и основные стадии
- •2.2 Виды конструкторских документов
- •2.3. Содержание разделов исходных данных для проектирования промышленного химического производства
- •Раздел 1. Общие сведения и технология
- •Раздел 2. Характеристика выполненных научно-исследовательских и опытных работ, положенных в основу исходных данных для проектирования
- •Раздел 3. Технико-экономическое обоснование рекомендуемого метода производства. Перспективы производства и потребления
- •Раздел 4. Патентный формуляр
- •Раздел 5. Техническая характеристика исходного сырья, вспомогательных материалов, основных и конечных продуктов. Целевое назначение и области применения основных продуктов
- •Раздел 6. Физико-химические корстанты и свойства исходных,
- •Раздел 7. Химизм, физико-химические основы и принципиальная
- •Раздел 8. Рабочие и технологические параметры производства
- •Раздел 9. Материальный баланс производства
- •Раздел 10. Технологическая характеристика побочных продуктов и
- •Раздел 11. Математическое описание технологических процессов и
- •Раздел 12. Данные для расчета, конструирования и выбора основного промышленного технологического оборудования и защиты строительных конструкций
- •Раздел 13. Рекомендации для проектирования автоматизации
- •Раздел 14. Аналитический контроль производства
- •Раздел 15. Методы и технологические параметры очистки химически и механически загрязненных сточных вод, обезвреживания газовых выбросов и ликвидации вредных отходов
- •Раздел 16. Мероприятия по технике безопасности, промсанитарии и противопожарной профилактике
- •Раздел 17. Указатель отчетов и рекомендуемой литературы по
- •2.4 Проектирование в системе подготовки
- •2.4.1 Курсовое проектирование
- •2.4.2. Дипломное проектирование
- •Глава 3 системы автоматизированного проектирования
- •3.1. История развития сапр
- •3.2. Основные принципы создания сапр
- •3.3 Применение эвм для автоматизации процесса пректирования
- •3.4. Автоматическое изготовление чертежей
- •3.5 Основные преимущества автоматизации проектирования.
- •3.6. Основные требования к сапр
- •3.7. Связь сапр с производством, расширение области применения
- •Глава 4 введение в проектирование
- •4.1. Проектно-сметная документация
- •4.2. Технико-экономическое обоснование проекта
- •4.2.1. Исходные положения
- •4.2.2. Обоснование способа производства химической продукции
- •4.2.3. Экономика строительства предприятия и производства продукции
- •Глава 5 выбор и разработка технологической схемы производства
- •5.1. Общие положения
- •5.2. Последовательность разработки технологической схемы
- •5.3. Принципиальная технологическая схема
- •5.4. Размещение технологического оборудования
- •Глава 6 выбор технологического оборудования химических производств
- •6.1. Основные типы химических реакторов
- •6.2. Химические факторы, влияющие на выбор реактора
- •6.2.1. Реакции расщепления
- •6.2.2 Реакции полимеризации
- •6.2.3. Параллельные реакции
- •6.2.4. Комбинация реактора смешения с реактором вытеснения
- •6.3. Эскизная конструктивная разработка основной химической аппаратуры
- •6.3.1. Общие положения
- •6.3.2. Реакторы
- •6.4. Оптимизация процессов химической технологии
- •Глава 7 уравнения материального баланса технологического процесса
- •7.1. Стехиометрические расчеты
- •7.2. Общее уравнение баланса массы
- •7.3. Практический материальный баланс
- •7.4. Физико-химические основы технологического процесса
- •Глава8 технологический расчет основной и вспомогательной аппаратуры
- •8.1. Общие положения
- •8.2. Расчет объемов реакторов
- •8.2.1. Основные положения химической кинетики
- •8.2.2. Расчет идеальных реакторов
- •8.3. Определение объемов аппарата
- •Глава 9 тепловой расчет основного оборудования
- •9.1. Общее уравнение баланса энергии
- •9.2. Практический тепловой баланс
- •9.3. Теплообмен в реакторах
- •9.4. Расчет энтальпий и теплоемкостей
- •9.5. Расчет реактора периодического действия
- •9.6. Степень термодинамического совершенства технологических процессов
- •Глава 10 гидравлические расчеты
- •10.1. Расчет диаметра трубопровода
- •10.2. Расчет гидравлических сопротивлений в трубопроводе
- •10.3. Гидравлическое сопротивление кожухотрубчатых теплообменников
- •10.4. Подбор насосов
- •Глава 11 механический расчет
- •11.1. Расчет сварных химических аппаратов
- •11.1.1. Основные расчетные параметры
- •11.1.2. Расчет на механическую прочность
- •11.1.3 Требования к конструированию.
- •11.1.4 Расчет цилиндрических обечаек.
- •11.1.6. Подбор стандартных элементов
- •11.2. Расчет толстостенных аппаратов
- •Глава 12 конструкционные материалы в химическом машиностроении
- •12.1. Виды конструкционных материалов
- •12.2. Коррозия металлов и сплавов
- •12.2.1. Виды коррозии
- •12.2.2. Виды коррозионных разрушений
- •12.2.3. Способы борьбы с коррозией
- •12.3. Влияние материала на конструкцию аппарата и способ его изготовления
- •12.3.1. Конструкционные особенности аппаратов из высоколегированных сталей
- •12.3.2. Конструктивные особенности эмалированных аппаратов
- •12.3.3. Конструктивные особенности аппаратов из цветных металлов
- •12.3.4. Конструктивные особенности аппаратов из пластмасс
- •Глава 13 оформление отдельных элементов химической аппаратуры
- •13.1. Оформление поверхности теплообмена
- •13.2. Перемешивающие устройства
- •13.3. Уплотнения вращающихся деталей
- •Глава 14 трубопроводы и трубопроводная арматура
- •Глава 15 вспомогательное оборудование химических заводов
- •15.1. Виды вспомогательного оборудования
- •15.2. Транспортные средства
- •15.2.1. Классификация транспортных средств для твердых материалов
- •15.2.2. Машины для транспортировки жидкостей и газов
- •Список рекомендованой литературы
- •1Вимоги до оформлення розрахунково-пояснювальної записки та графічної частини
- •1.1 Загальні вимоги
- •1.2 Вимоги до тексту
- •1.2.10. Оформлення ілюстрацій і додатків.
- •1.3 Оформлення графічної частини
- •2 Склад розрахунково-пояснювальної записки
- •3 Стандартизація і метрологія
- •4 Матеріалоємність і ресурсозбереження
- •5 Будівельна частина
- •5.1 Вибір майданчика для будівництва
- •5.2 Пов’язування технологічної лінії з об’ємно-планувальним рішенням промислової будови
- •5.3 Вибір конструктивного рішення будівлі
- •5.4 Допоміжні будівлі і приміщення
Глава8 технологический расчет основной и вспомогательной аппаратуры
8.1. Общие положения
Задачей технологического расчета является определение размеров аппарата, обеспечивающих заданную производительность, и количества всех аппаратов, составляющих схему производства.
Принципы расчетов оборудования периодического и непрерывного действия различны, хотя конечная их цель сводится к нахождению, преимущест-
венно, объема аппарата или поверхности теплообмена.
Геометрические размеры, например, реактора - это высота (Н) и диаметр (D). При этом диаметр реактора можно определить из соотношения

где V0 - объемная производительность, м3/с; w - скорость движения реакционной смеси, м/с; f - площадь сечения реактора, м2.
Длина рабочей зоны реактора
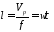
где Vp - объем реактора, м3; τ - среднее время пребывания реакционной смеси в аппарате, с.
Объем реактора
Vp = τV0
Исходными данными для технологического расчета химической аппаратуры являются:
- предварительная аппаратурно-технологическая схема, предусматривающая характер выбранных аппаратов и их взаимосвязь в материальном потоке;
- объемы перерабатываемого сырья, полупродуктов и готового продукта на каждой технологической стадии производства (в сутки, в час, в секунду). Количества перерабатываемых продуктов, полученных в материальном расчете, переводятся в соответствующие объемные величины;
- длительность каждой стадии технологического процесса. Необходимо учесть возможность длительности отдельных стадий за счет усовершенствования процесса: введение более эффективно действующего инициатора или катализатора, изменение соотношения реагирующих компонентов, повышение эффективности перемешивания, обогрева и т.д.;
- скорость протекания реакционной массы через аппарат в м/с или в других еди-
ницах для реакторов непрерывного действия. Эта величина зависит от кинетики химической реакции, длительности аналогичной стадии периодического процес-
са, вязкости реакционной смеси и, наконец, заданной степени конверсии исход-
ных продуктов;
- возможные соотношения длины (или высоты) аппаратов «идеального» вытеснения к их поперечному сечению. Для аппаратов «идеального» смешения и комбинированных типов необходимо заранее предполагать характер передачи реакционной смеси из одного аппарата (или секции) в другой.
После завершения технологического расчета каждого аппарата необходимо дать обоснованный выбор конструкционного материала для его изготовления.
8.2. Расчет объемов реакторов
8.2.1. Основные положения химической кинетики
Химическая кинетика - наука, изучающая протекание химических реакций во времени. Ее основным понятием является скорость химической реакции. Для гомогенных процессов под скоростью химической реакции понимают изменение количества одного из компонентов реакции в единицу времени в единице объема, т.е.:
 ,
,
где ri - скорость реакции по i-тому компоненту, моль/(м3 с); V - реакционный объем, м3; Ni - число молей i - того компонента, моль; τ — время, с.
Знак плюс - для продуктов реакции, а знак минус - для реагентов (так как в резуль-
тате реакции число молей продуктов увеличивается, а реагентов - уменьшается).
Если реакция протекает без изменения объема, то

где Сi — концентрация i -того компонента, моль/м3.
Вводя понятие степени превращения Хi определяемое соотношением
 ,
,
где индекс «0» относится к начальному состоянию i - того компонента, получим

Для гетерогенных процессов скорость реакции - это изменение количества компо-
нента в единицу времени, отнесенное к единице поверхности, где протекает хими-
ческая реакция

где S - «активная» поверхность, м2; ri - скорость реакции, моль/(м2∙с).
Если в процессе реакции поверхность S постоянна, то скорость реакции можно от-
нести к пропорциональным ей величинам: массе твердой фазы mτ, объему твердой фазы Vτ, реакционному объему Vp, т.е.
 .
.
Единицы этих скоростей соответственно: моль/(кг∙с), моль/м3
Стехиометрия реакций дает следующие соотношения между скоростями реакции по компоненту и общей скоростью r, например для реакции:
vAA
= vBB;
-vAA
+vBB
= 0;
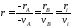
В отличие от скорости превращения вещества ri величина скорости простой химической реакции r всегда положительна.
Основным законом химической кинетики является закон действующих масс, который гласит, что скорость реакции прямо пропорциональна произведению концентрации реагентов в степени, являющейся порядком реакции по данному реагенту, т.е.

где k - константа скорости реакции, зависящая только от температуры;
m - число реагентов; ni - порядок реакции по i-тому реагенту.
Константа скорости реакции и ее порядок являются эмпирическими величинами и расчету практически не поддаются.
Зависимость константы скорости реакции от температуры определяется известным уравнением Аррениуса:
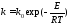
где k0 - предэкспоненциальный множитель, имеющий размерность константы ско-
рости реакции; Е - энергия активации реакции, Дж/моль; R - универсальная газовая постоянная, Дж/(моль∙К); T - температура, К.
Предэкспоненциальный множитель и энергия активации могут быть определены только опытным путем при обработке нескольких экспериментальных данных по константам скорости реакции, полученным при различных температурах. Считается, что энергия активации не зависит от температуры, что подтверждается экспериментом. Однако обычно ошибка в оценке энергии активации не может быть меньше 15 - 20% из-за сложности установления изотермического режима при проведении реакции, недостаточной точности измерения и регулирования температуры в реакционном пространстве.
В узком интервале температур можно по двум точкам оценить температурную зависимость скорости реакции линейной функцией вида
k = аТ + b.
В химической кинетике принято разделя гь химические реакции на простые и слож
ные. К простым относятся реакции, протекающие практически до конца в одну ста
дию. Сложные реакции представляют некоторую совокупность простых и подраз-
деляются на параллельные, последовательные и обратимые. Дальнейшее усложне-
ние реакций приводит к комбинациям последних трех типов.
Параллельные реакции имеют вид
А →В; А →С.
Скорость реакции в этом случае равна сумме скоростей отдельных реакций
r
= r1
+ r2
=

Последовательные реакции:
А → В → С.
скорость превращения компонента А rA = kА∙СА;
скорость образования компонента С rC = kB∙СB
скорость накопления компонента В rB = kАСА - kBСB.
Обратимые реакции:
А ↔ В.
Если k1 - константа скорости прямой реакции, а k2 - обратной, то суммарная скорость
r
= rА
- rB
=
 .
.
При равновесии r = 0 (rА = rB), поэтому выполняется условие, при котором
КР = k1/k2,
где КР - константа равновесия данной реакции.
Со сложными реакциями связано понятие селективности (избирательности) процесса, так как часто желательно получение только одного, «целевого», продукта. Под дифференциальной селективностью понимают отношение скорости образования целевого продукта к общей скорости реакции, например, для параллельной реакции, если целевым является конечный продукт В,

Дифференциальная селективность изменяется со временем, так как по мере увеличения степени превращения уменьшается концентрация реагентов.
Интегральную (общую) селективность можно выразить отношением конечной концентрации целевого продукта СВк к сумме концентраций всех продуктов реакции.

Соотношение между дифференциальной и интегральной селективностью определяется выражением
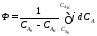
При кинетических расчетах не следует проводить операцию по исключению стехи
ометрически зависимых реакций, так как она целесообразна только при материаль
ных расчетах.
