
- •Теоретическая часть.
- •Состав комплексных соединений.
- •Классификация комплексов.
- •Номенклатура комплексных соединений.
- •Изомерия комплексных соединений.
- •Химическая связь в комплексах.
- •Диссоциация комплексов.
- •Химические свойства.
- •Выполнение работы.
- •Опыт №1. Получение комплексных соединений с комплексными анионами.
- •Опыт №2. Получение комплексных соединений с комплексными катионами.
- •Опыт №3. Получение комплексных соединений с комплексным катионом и комплексным анионом.
- •Опыт №4. Исследование прочности комплексов.
- •Опыт №5. Свойства комплексных соединений.
Опыт №4. Исследование прочности комплексов.
1. Разрушение комплексов в результате осаждения комплексообразователя.
Берем три пробирки. В первую наливаем 5 капель 0,5 М раствора сульфата железа (II) и добавляем одну каплю 1н раствора сульфида натрия. При этом наблюдаем выпадение черного осадка сульфида железа (III).Это контрольный опыт, он показывает, что наличие в растворе иона приводит к образованию осадка с ионом
Уравнение реакции имеет вид:
FeSO4+Na2S=FeS+Na2SO4
Во вторую пробирку наливаем пять капель 0,5М раствора сульфата
железа (II) и добавляем 3 капли концентрированного раствора ацетата натрия. В результате реакции образуется комплекс
FeSO4+6CH3COONa=Na[Fe(CH3COO)6]+Na2SO4
В третью пробирку наливаем пять капель 1н раствора
Затем во вторую и третью пробирки добавляем по одной капле 1н раствора сульфида натрия. В первой пробирке наблюдаем
2. Разрушение комплекса в результате образования нового комплекса.Сначала необходимо получить комплексNa4[Co(CH3COO)6]. Для этого в две пробирки наливаем по две капли 1н раствора хлорида кобальта (II) и по десять капель концентрированного раствора ацетата натрия до появления ярко – розового цвета, обусловленного ионом [Co(CH3COO)6]4+. Уравнение реакции:
FeSO4+6CH3COONa=Na[Fe(CH3COO)6]+Na2SO4
Далее одну пробирку оставляем для того, чтобы можно было потом сравнить цвет, а во вторую добавляем 10 капель концентрированного раствора роданида калия до появления фиолетового цвета, обусловленного ионом [Co(SCN)4]2-.
Na2[Co(CH3COO)4]+4KSCN=K2[Co(SCN)4]+2CH3COONa+2CH3COOH
Опыт №5. Свойства комплексных соединений.
1. Реакции обмена комплексообразователя.
В пробирку поместить две капли 1н раствора хлорида кобальта (II) и добавить 5-10 капель концентрированной соляной кислоты до появления сине – фиолетового окрашивания, обусловленного образованием комплексного иона [Co(Cl)4]2-. Затем в пробирку вносим две капли концентрированного раствора сульфата цинка до появления розовой окраски. В результате этой реакции происходит обмен комплексообразователяCo2+ наZn2+ . Розовая окраска обусловлена выделением в свободном виде ионаCo2+.
CoCl2+2HCl=H2[CoCl2]
H2[CoCl4]+ZnSO4=H2[ZnCl4]+CoSO4
В другую пробирку наливаем две капли концентрированного раствора сульфата цинка и добавляем несколько капель (3 – 7) концентрированного раствора аммиака до образования комплексного иона [Zn(NH3)4]2+. Раствор этого комплекса бесцветный. Затем в эту пробирку внести 2-3 капли 1н раствора сульфата меди (II) до появления синего цвета, обусловленного образованием нового комплексного катиона [Cu(NH3)4]2+.
ZnSo4+NH3=[Zn(NH3)4]SO4+ZnSO4 (или [Cu(NH3)4]SO4+ZnSO4)
2. Участие комплексных соединений в окислительно – восстановительных реакциях.
Вносим пять капель 0,5н раствора иодида калия в пробирку, пять капель концентрированной соляной кислоты и три капли толуола. Содержимое пробирки встряхиваем и убеждаемся, что верхний слой остается бесцветным. Затем вносим в пробирку 2-3 капли насыщенного раствора красной кровяной соли, встряхивае5м и наблюдаем за изменением окраски верхнего слоя жидкости. В результате реакции йод окисляется до свободного состояния (при этом йод переходит в слой толуола и окрашивает его), а комплексообразователь Fe3+восстанавливается доFe2+.
2KI+HCl+C7H8+2K3[Fe(CN)6]=2K4[Fe(CN)6]+I2+HCl+C7H8
4Na+
4-
Na4[Co(CH3COO)6] – гексаацетокобальтат (II) натрия Кнест.=6*10-2
sp3d2-гибридизация
Na3[Co(CH3COO)6]= 3Na++[Co(CH3COO)6]3-
4-
4Na+



Na4[Fe(CH3COO)6] – гексаацетоферрат (II) натрия Кнест.=7,8*10-2
sp3d2-гибридизация
Na4[Fe(CH3COO)6]= 4Na++[Fe(CH3COO)6 ]4-
4-
4Na+
Na4[Co(NO2)6] – гексанитритокобальтат (II) натрия Кнест.=8*10-2
d2sp3-гибридизация
Na4[Co(NO2)6]= 4Na++[Co(NO2)6]4-
Cl-
2-
2H+





H2[CoCl4] – тетрахлорокобальтат (II) водорода Кнест.=6*10-1
sp3-гибридизация
H2[CoCl4]= 2H++[CoCl4]2-
SCN-
2-
2K+





K2[Co(SCN)4] – тетрароданокобальтат (II) калия Кнест.=8*10-3
sp3-гибридизация
K2[Co(SCN)4]= 2K++[Co(SCN)4]2-
4-
4Na+



Na4[Co(S2O3)3] –тритиосульфатокобальтат (II) натрия Кнест.=8,5*10-3
d2sp3-гибридизация
Na4[Co(S2O3)3]= 4Na++[Co(S2O3)3]4-
2+
2Cl-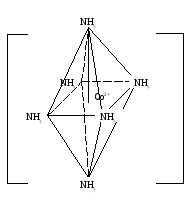
[Co(NH3)6]Cl2 – хлорид гексаамин кобальта (II) Кнест.=8*10-6
d2sp3-гибридизация
[Co(NH3)6]Cl2= [Co(NH3)6]2++2Cl-
3+
3SO42- 2
[Cr(NH3)6](SO4)3 – сульфат гексаамин хрома (VI) Кнест.=10-9
d3sp2-гибридизация
[Cr(NH3)6](SO4)3= [Cr(NH3)6]3++3SO42-
2+
NH3
SO42-





[Cu(NH3)4]SO4 – сульфат тетраамин меди (II) Кнест.=1,5*10-10
sp3-гибридизация
[Cu(NH3)4]SO4= [Cu(NH3)4]2++ SO42-
2+
SO42-
[Ni(NH3)6]SO4 – сульфат гексаамин никеля (II) Кнест.=2*10-9
d2sp3-гибридизация
[Ni(NH3)6]SO4= [Ni(NH3)6]2++SO42-
2+
SO42-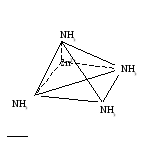





[Zn(NH3)4]SO4 – сульфат тетраамин цинка Кнест.=4*10-10
sp3-гибридизация
[Zn(NH3)4]SO4= [Zn(NH3)4]2++SO42-
4-
4K+
K4[Fe(CN)6] – гексацианоферрат (II) калия Кнест.=1*10-27
d2sp3-гибридизация
K4[Fe(CN)6]= 4K++[Fe(CN)6]4-
2Ni2+
4-
Ni2[Fe(CN)6] – гексацианоферрат (II) никеля Кнест.=1*10-27
d2sp3-гибридизация
Ni2[Fe(CN)6]= 2Ni2++[Fe(CN)6]4-
3+
3-


[Ni(NH3)6][Fe(CN)6] – гексацианоферрат (II) гексаамин никеля Кнест.=1,2*10-8
d2sp3-гибридизация и sp3d2-гибридизация
[Ni(NH3)6][Fe(CN)6]= [Ni(NH3)6]3-+ [Fe(CN)6]3+
2-





2Na+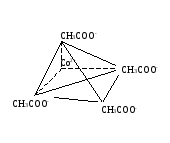
Na2[Co(CH3COO)4] – тетраацетокобальтат (II) натрия Кнест.=10-2
sp3-гибридизация
Na2[Co(CH3COO)4]= 2Na++[Co(CH3COO)4]2-
2H+
2-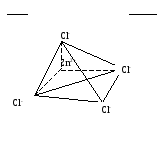



H2[ZnCl4] – тетрахлороцинкат водорода Кнест.=10-1
sp3-гибридизация
H2[ZnCl4]= 2H++[ZnCl4]2-
3K+
K3[Fe(CN)6] – гексацианоферрат (III) калия Кнест.=1*10-44
d2sp3-гибридизация
K3[Fe(CN)6]=3K++[Fe(CN)6]3-
