
Сеть, структура и кадры учреждений службы
В соответствии с распоряжением Правительства Российской Федерации от 13 января 2005 года № 23-р санитарно-эпидемиологическая служба области в 2005 году реорганизована в форме слияния федерального государственного учреждения "Центр санитарно-эпидемиологического надзора во Владимирской области" и 17 центров госсанэпиднадзора в административно-территориальных образованиях Владимирской области и создано федеральное государственное учреждение здравоохранения "Центр гигиены и эпидемиологии в Владимирской области" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, в состав которого вошли головное учреждение и 7 филиалов, являющиеся обособленными подразделениями и осуществляющие деятельность от имени Центра на основании Положения. Структура Центра и обособленных подразделений предусматривает выполнение задач по обеспечению деятельности Территориального управления Роспотребнадзора по Владимирской области. Руководителем Центра является главный врач. Руководство филиалами осуществляют главные врача филиалов, действующие на основании Положения о филиале и доверенности, выданной главным врачом Центра. В 2006 году на бюджетных средствах Центра по всем группам персонала имелось 380 штатных должностей, занятых 439 физическими лицами, в том числе: • врачей на 107 должностях - 105 физических лиц; • специалистов с высшим немедицинским образованием соответственно 12 - 10; • средних медицинских работников 153 - 185; • младшего медицинского персонала 21 - 35; • прочего персонала 87 - 104.
Из общего количества врачей имеют квалификационные категории 92,3%, в т.ч. высшую - 44,8%, первую - 44,8%, вторую - 2,7 %, сертификат специалиста - 81,9%. Средние медицинские работники : имеют квалификационные категории 84,3%, в т.ч. высшую - 29,7%, первую - 49,2%, вторую - 5,4%, сертификат специалиста - 77,8%. Большое внимание уделяется повышению профессионального образования и квалификации кадров. В 2005 году на сертификационном цикле "Организация и проведение санитарно-эпидемиологических экспертиз" на базе ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора обучено 35 врачей-гигиенистов, организаторов здравоохранения, 12 врачей-эпидемиологов, 4 эксперта-физика, 5 химиков-экспертов, 11 врачей-лаборантов, 20 врачей-бактериологов. В учреждении работают 1 кандидат медицинских наук, 3 врача имеют почетных
звания "Заслуженный врач Российской Федерации".
Потенциометрическое титрование
Зависимость равновесного потенциала индикаторного электрода от состава раствора, описываемую уравнением Нернста, можно использовать для нахождения конечной точки титрования. Для этого измеряют потенциал после добавления каждой порции титранта. Заметив объем, при котором наблюдается резкое изменение потенциала (скачок титрова-

Рис
1. Графический способ
нахождения конечной точки
титрования:
а
—
интегральная кривая; б
—
первая
производная; в
—
вторая
производная

преобразуют в функции, дающие линейную зависимость от объема титранта. Этот способ позволяет получить более точные результаты для тех случаев, когда скорость изменения /^функции вблизи точки эквивалентности мала и кривая титрования выражена плохо.
В качестве типичного примера использования способа Грана рассмотрим титрование 2-Ю"4 М хлорид-ионов 2-Ю"3 М раствором нитрата серебра (рис. 10.23). Кривая титрования выражена плохо, и отыскать точку максимального наклона трудно (кривая 1).
Рис. 2. Кривая титрования 2*10-4 М раствора хлорида натрия 2*10-3 М раствором нитрата серебра (1) и график Грана екать точку максимального наклона для данного титрования (2)
Вблизи точки эквивалентности индикаторный серебряный электрод, применяемый при титровании хлорид - ионов, служит электродом II рода и поэтому
Отсюда
где 16,9 = 1/0,059, Следовательно,
(а)
С другой стороны, до точки эквивалентности равновесную концентрацию хлорид-ионов можно рассчитать по формуле
(б)
Объедини формулы (а) и (б), получаем
Для данного титрования в полученном выражении постоянно все, кроме Еюи и VAg +, поэтому график зависимости
будет линейным (рис. 2, кривая 2). В непосредственной близости от точки эквивалентности линейная зависимость нарушается, и искривление графика наблюдается тем раньше, чем менее полно протекает реакция. В точке эквивалентности левая часть уравнения (в) становится равной нулю. Экстраполяцией линейного участка графика находим точку на оси
ординатой, равной нулю. Абсцисса этой точки и дает искомый объём титранта V Ag+.
Известен другой прием — титрование до заданного потенциала. Если есть возможность оценить потенциал в конечной точке титрования (это просто сделать, записав предварительно кривую титрования с помощью автотитратора), можно воспользоваться и этим способом.
В потенциометрическом титровании применимы кислотно-основные, окислительно-восстановительные реакции и реакции комплексообразова-ния, а также процессы осаждения, протекающие быстро и количественно.
Для кислотно-основного титрования в качестве индикаторного применим любой электрод с водородной функцией: водородный, хингидрон-ный, стеклянный. Наиболее часто применяемый стеклянный электрод подробно описан в предыдущем разделе.
Водородный электрод — это первичный электрод для измерения рИ. Устройство электрода описано в гл. 6. Потенциал водородного электрода зависит от активности ионов водорода и в интервале рН от 0 до 14 (25 °С) описывается уравнением
E = -0,059рН+const.
В аналитических лабораториях водородный электрод не применяют из-за относительной сложности работы с ним.
Сурьмяный электрод пригоден для измерения рН в интервале от 3 до 10. В основе его работы лежит полуреакция
Sb203+6Н++6е
![]() 2Sb
+ ЗН20
2Sb
+ ЗН20
В указанном интервале рН
E = k'-0,059рН,
где к' — константа, характерная для каждого конкретного электрода и определяемая экспериментально. Практического применения этот электрод почти не находит, так как мешают окислители (кислород), восстановители (сероводород), ионы тяжелых металлов.
Хингидронный электрод состоит из платиновой пластинки, погруженной в насыщенный хингидроном (молекулярный комплекс 1:1 хинона и гидрохинона) раствор. Потенциал платинового электрода согласно полуреакции
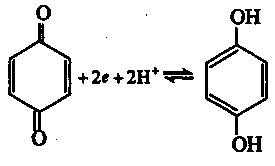
определяется уравнением
Электрод нельзя применять при рН > 9 (гидрохинон окисляется растворенным кислородом и нарушается соотношение 1:1), а также в присутствии окислителей и
восстановителей, реагирующих с хиноном и гидрохиноном. Достоинством электрода является низкая погрешность результатов.
Индикаторным электродом в окислительно-восстановительном титровании служит платиновый электрод (см. разд. 10.2.1). Величина скачка определяется разностью формальных потенциалов полуреакций. Желательно, чтобы хотя бы одна из полуреакций, была обратимой. При титровании не рекомендуется измерять потенциал до прибавления титранта и вблизи точки эквивалентности, так как в эти моменты из-за отсутствия одной из форм (окисленной или восстановленной) полуреакции образуется смешанная окислительно-восстановительная пара, где роль отсутствующей окисленной формы выполняет растворенный кислород, а роль отсутствующей восстановленной формы — вода. Приобретаемый электродом смешанный потенциал неустойчив, поэтому его трудно измерить.
В осадительном титровании по реакции галогенид-ионов с ионами серебра в качестве индикаторного пригоден серебряный электрод. До точки эквивалентности потенциад электрода в соответствии с уравнением
АgХ
+ е ![]() Аg
+ Х-
Аg
+ Х-
зависит от активности галогенид-ионов
и серебряный электрод является электродом II рода. За точкой эквивалентности при избытке ионов серебра потенциал электрода определяется полуреакцией
Аg+
+ е ![]() Аg0
Аg0
и зависит от активности собственных ионов
(электрод I рода). Величина скачка зависит от растворимости осадка. Можно провести дифференцированное титрование смеси хлорид-, бромид- и иодид-ионов.
Метод потенциометрического титрования имеет ряд преимуществ перед прямой потенциометрией и тагриметрией с визуальными индикаторами. В отличие от прямой потенциометрии здесь не существует искажения результатов за счет диффузионного потенциала, его влияние проявляется лишь в смещении кривой титрования вдоль оси потенциалов. Кроме того, нет необходимости знать коэффициент активности определяемого иона.
К числу преимуществ перед визуальным титрованием прежде всего относятся исключение субъективных ошибок, возможность анализа мутных и окрашенных растворов, документальность и сравнительно легкая автоматизация. Но, пожалуй, основное преимущество заключается в возможности дифференцированного титрования компонентов смеси. Сочетание преимущества инструментального фиксирования конечной точки и влияния органического растворителя (метилизобутилкетон) на кислотно-основные свойства позволяет, например, зафиксировать раздельные скачки титрования для смеси пята кислот — хлорной, соляной, салициловой, уксусной и фенола, что совершенно невозможно сделать с помощью индикаторов.
