
- •1. Общая характеристика d-элементов.
- •2. Общая характеристика d-элементов viб-группы.
- •Биологическая роль d-элементов viб-группы. Их применение в медицине.
- •4. Общая характеристика d-элементов viiб-группы.
- •5. Биологическая роль соединений марганца. Их применение в медицине.
- •6. Общая характеристика d-элементов viiiб-группы (семейство железа и семейство платины).
- •7. Биологическая роль d-элементов семейства железа. Применение их соединений в медицине.
- •8. Общая характеристика d-элементов iб-группы.
- •Химические свойства соединений меди, серебра, золота.
- •9. Биологическая роль d-элементов iб-группы. Применение их соединений в медицине.
- •10. Общая характеристика d-элементов iiб-группы.
- •Химические свойства соединений цинка, кадмия и ртути.
- •11. Биологическая роль d-элементов iiб-группы. Применение их соединений в медицине.
- •12. Семейство платины.
12. Семейство платины.
В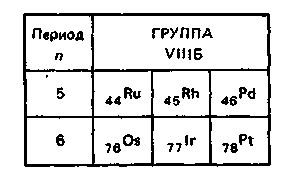 подгруппу платины входит шесть переходных
металлов. По числу электронов на
4dЗs-орбиталях
(Ru,
Rh,
Рd)
и 5d6s-орбиталях
(Оs,
Ir,
Рt)
и по аналогии физико-химических свойств
все элементы VI
IIБ-группы
делятся на три подгруппы: 1) Ru
— Оs;
2) Rh
— Ir;
3) Рd
— Рt.
Атомный радиус у всех шести элементов
изменяется в небольшом интервале: 134 пм
(Ru)
— 139 пм (Рt).
подгруппу платины входит шесть переходных
металлов. По числу электронов на
4dЗs-орбиталях
(Ru,
Rh,
Рd)
и 5d6s-орбиталях
(Оs,
Ir,
Рt)
и по аналогии физико-химических свойств
все элементы VI
IIБ-группы
делятся на три подгруппы: 1) Ru
— Оs;
2) Rh
— Ir;
3) Рd
— Рt.
Атомный радиус у всех шести элементов
изменяется в небольшом интервале: 134 пм
(Ru)
— 139 пм (Рt).
В электрохимическом ряду все платиновые металлы стоят после водорода. По значениям электроотрицательности все элементы группы ближе к неметаллам, чем к металлам. Поэтому соединения этих металлов проявляют амфотерность, выраженную в разной степени. Гидроксиды не всех этих элементов растворяются и в кислоте и в щелочи. Тем не менее, элементы семейства платины образуют не только катионные, но и анионные комплексы. Устойчивые валентные состояния для элементов семейства платины следующие: Ru — IV, VI, VIII; Rh — III, IV; Рd — II, IV; Оs — IV, VI; Ir — III, IV; Рt — II, IV.
Гидроксиды Ru, Rh, Рd, Оs, Ir и Рt в четырехвалентном состоянии существуют в форме МО2∙nН2О, где n = 2 (для платины n = 2, 3). Содержание воды зависит от температуры.
Гидроксиды Rh, Рd и Рt растворяются в кислотах и щелочах:
РtO2∙3Н2О + 2NаОН → Na2[Рt(ОН)6] + Н2О
РtO2∙3Н2О + 6НСl → H2[РtСl6] + 5Н2О
В обычных условиях платиновые металлы не взаимодействуют с такими сильными окислителями, как F2, Сl2 и О2. Низкая реакционная способность элементных веществ определяется большой энергией связи в кристаллической решетке. Та же причина определяет высокие температуры плавления и большие значения плотности.
Только платина реагирует без нагревания с окисляющей смесью кислот
3Рt + 18НСl + 4НNО3 ⇄ 3H2[PtСl6] + 4NО + 8Н2О
или с соляной кислотой в присутствии кислорода
Рt + 6НСl + О2 ⇄ Н2[РtСl6] + 2Н2О
Все металлы платинового семейства, кроме иридия, переходят в четырехвалентное состояние при сплавлении со щелочными окисляющими смесями. Например:
Ru + 2КОН + 3КNО3 → К2RuО4 + 3КNО2 + Н2О
Иридий переходит в трехвалентную форму.
При нагревании платиновые металлы реагируют с NаСl или НСl в токе хлора, что приводит к образованию комплекса. Например:
Ir + 2NаСl + 2Сl2 → Na2[IrСl6]
Платина при нагревании может образовывать цианидный комплекс:
Рt + 6КСN + 4Н2О → К2[Рt(СN)6] + 4КОН + 2Н2
Элементы платинового семейства образуют комплексные соединения с координационными числами 4 и 6. Наиболее изучены цианидные, галогенидные и аммиачные комплексы. Комплексные соединения могут быть катионные, анионные и нейтральные. Катионный комплекс:
[Рt(NН3)2Сl2] + 2NН3 → [Рt(NН3)4Сl2]
Нейтральный комплекс:
[Рt(NН3)4]Сl2 + 2НСl ⇄ [Рt(NН3)2Сl2] + 2NН4Сl
Катионно-анионный комплекс:
[Рt(NН3)4]Сl2 + К2[РtСl4] → [Рt(NН3)4] [РtСl4] + 2КСl
Применение соединений платиновых элементов в медицине. Многочисленные исследования показали, что цис-изомер дихлородиамминплатины(II) [Рt(NН3)4]Сl2 оказывает лечебное действие при раковых заболеваниях. Действие этого комплекса основано на том, что в нем происходит постепенное замещение хлорид-ионов хелатирующими лигандами. Такими лигандами являются аминокислотные остатки в белках. Координация идет за счет взаимодействия металла с атомами азота лиганда. После замещения хлорид-ионов создаются условия для замещения и групп NН3. В результате платина образует четыре связи с новыми лигандами. Это свойство цис-дихлородиамминплатины приводит к образованию устойчивого комплекса с молекулой ДНК. Таким образом, это вещество ингибирует синтез ДНК. Интересно отметить, что транс-изомер дихлородиамминплатины (II) токсичен, но противоопухолевым действием не обладает.
Н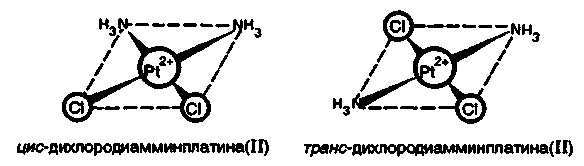 аряду
с цис-дихлор-диамминплатиной (II)
противоопухолевой активностью обладают
и другие комплексы, содержащие в качестве
лигандов амины и хлорид-ионы. Например,
цыс-диамминтетрахлорплатина (IV)
[Рt(NН3)2Сl4]
и цис-дианилиндихлороплатина
(II)
[Pt(NH2C6H5)2Cl2]:
аряду
с цис-дихлор-диамминплатиной (II)
противоопухолевой активностью обладают
и другие комплексы, содержащие в качестве
лигандов амины и хлорид-ионы. Например,
цыс-диамминтетрахлорплатина (IV)
[Рt(NН3)2Сl4]
и цис-дианилиндихлороплатина
(II)
[Pt(NH2C6H5)2Cl2]:
С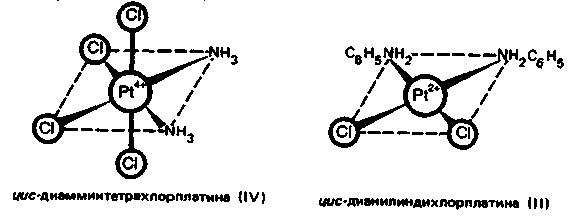 плавыРt
—
Ir
и Рt
— Аu
применяются в ортопедической стоматологии,
для изготовления шприцов; сплавы Рd—Аu,
Рd—Аu—Рt,
Рd—Рt—Ir
— для изготовления хирургических
инструментов, в ортопедической
стоматологии используют сплавы Рd—Аu
или Рd—Аg,Сu,Ir.
Вживляемые в сердце электроды для
стимуляции изготовлены из сплава Рt—Ir;
Ir—Рt
— эталон массы (а раньше и длины). Для
дезинфекции питьевой воды применяют
О3,
его можно получить по реакции:
плавыРt
—
Ir
и Рt
— Аu
применяются в ортопедической стоматологии,
для изготовления шприцов; сплавы Рd—Аu,
Рd—Аu—Рt,
Рd—Рt—Ir
— для изготовления хирургических
инструментов, в ортопедической
стоматологии используют сплавы Рd—Аu
или Рd—Аg,Сu,Ir.
Вживляемые в сердце электроды для
стимуляции изготовлены из сплава Рt—Ir;
Ir—Рt
— эталон массы (а раньше и длины). Для
дезинфекции питьевой воды применяют
О3,
его можно получить по реакции:
![]() ,
где
Ir
— катализатор (порошкообразный иридий).
,
где
Ir
— катализатор (порошкообразный иридий).
Оксид осмия (VIII) ОsO4 применяется как фиксатор ткани (липидный стабилизатор) для гистологических исследований в виде 1%-ного раствора в ацетоне. ОsO4 можно использовать и для электронно-микроскопического выявления ферментов. Механизм действия ОsO4 может быть представлен в следующем виде:
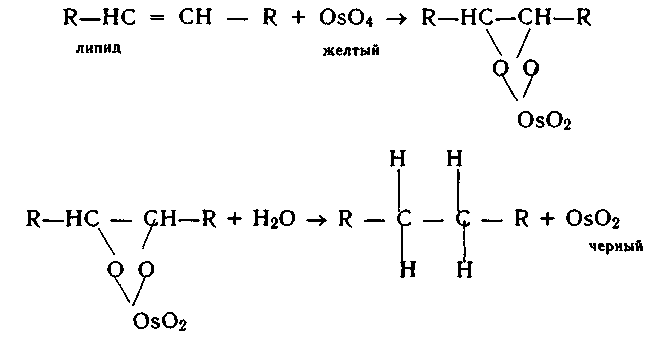
Восстановление может идти глубже и будет образовываться Оs2О3 или ОsО. Все эти соединения имеют темно-коричневый или черный цвет, т.е. обеспечивается эффект контрастирования участка клетки или ткани (образуются эфиры холестерина и триглицеридов)
Комплекс [Ru(NН3)4(ОН)Сl]Сl — рутениевый красный также применят для анатомических и гистологических исследований. Его раствор (1:5000) окрашивает в розово-красные тона пектин.
