
Лекція 02 Регуляція метаболічних процесів
.pdf
Лекція 2
Регуляція метаболічних процесів

План лекції:
Регуляторні ферменти
•Кофактори
•Коферменти
•Коферментні функції вітамінів
Актуальність теми:
•Регуляція ферментативної активності. Алостеричні ферменти.
•Пояснити роль металів в механізмі ферментативного каталізу.
•Класифікувати окремі групи коферментів за хімічною природою та типом реакції, яку вони каталізують.
•Трактувати роль коферментів в механізмах каталізу за участю основних класів ферментів.
•Пояснити застосування антивітамінів як інгібіторів ферментів при патологіях системи гомеостазу.
Регуляція активності ферментів
Механізм саморегуляції базується на негативному або позитивному
зворотньому зв’язку. |
|
|
пепсиноген пепсин |
||||
1. Пригнічення реакції її продуктами: |
|
|
|
|
|||
|
|
|
|
|
|
(реакція другого порядку) |
|
|
|
|
- |
|
|
|
|
A B C D F |
|||||||
E |
E |
2 |
E |
E |
4 |
|
|
1 |
|
3 |
|
|
|
||
A B C D F |
|||||||
E |
E |
2 |
E |
E |
4 |
|
|
1 |
|
3 |
|
|
|
||
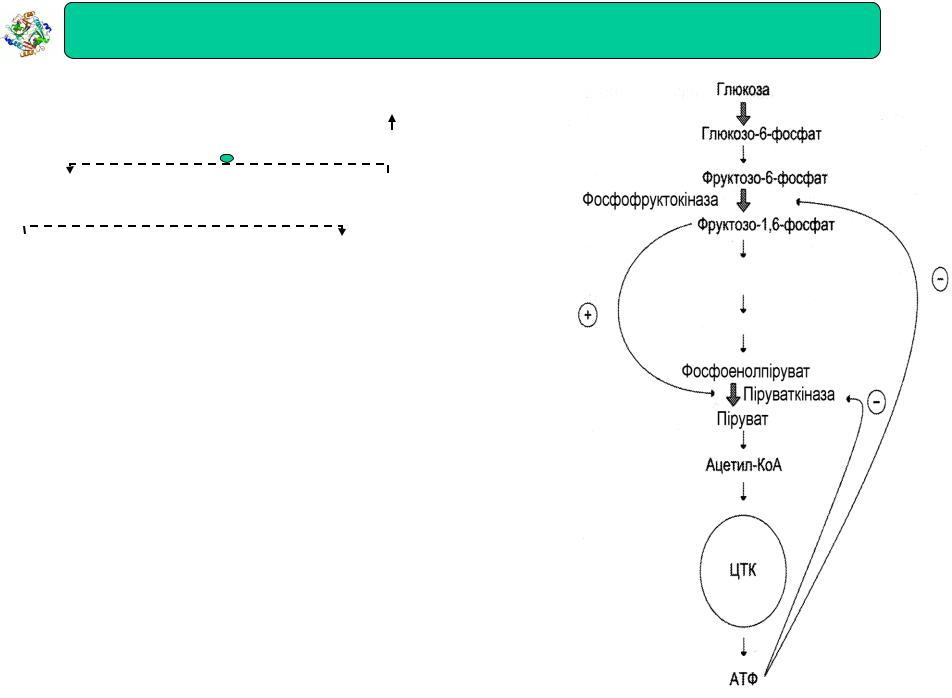
2.Регуляція ферментативних процесів за допомогою аденілатів
(АТФ, АДФ, АМФ). Притаманна реакціям з утворенням АТФ.
Молекула АТФ приймає участь у ретроінгібуванні алостеричних ферментів фосфофруктокінази та піруваткінази. Фруктозо-1,6-диосфат – активатор метаболічного шляху розпаду глюкози.
3.Регуляція шляхом модифікації ферменту (фосфорилювання дефосфорилювання в одних випадках підвищує активеість, в інших знижує.
4.Регуляція з допомогою аденілатциклазної системи. Провідну роль відіграє аденілатциклаза та протеїнкіназа, що утворюють єдину регуляторну систему (каскад реакцій).
5.Гормональна регуляція ферментативних процесів має значення як на
клітинному рівні так і на рівні організму.
Алостеричні ферменти |
модулятори |
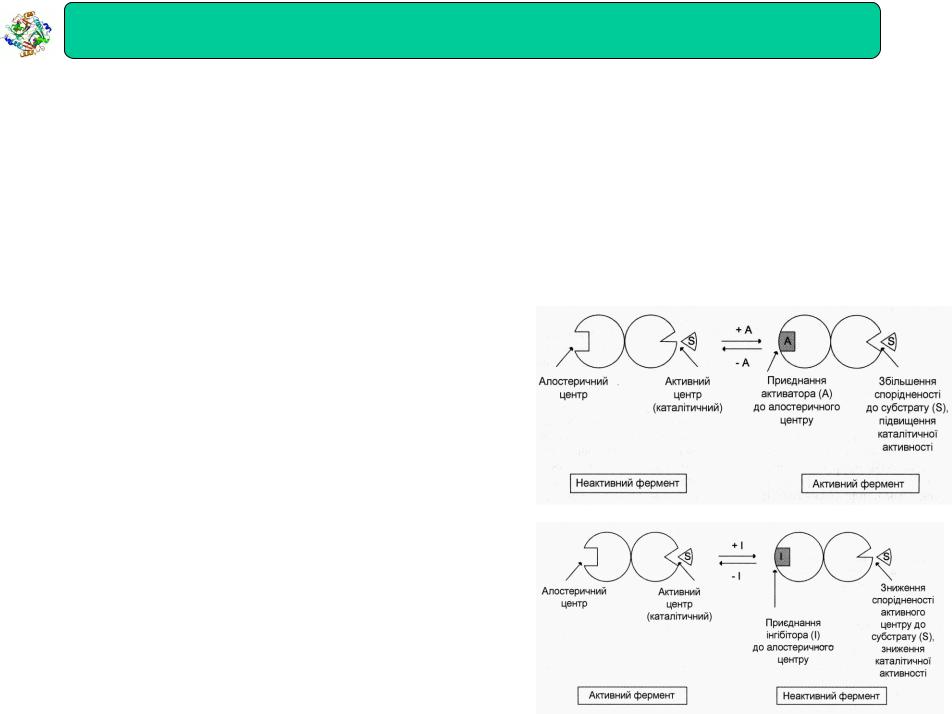
Алостеричні ферменти мають спеціальну регуляторну ділянку (алостеричний центр), яка просторово відмежована від активного центру.
Містять більше, ніж один поліпептидний ланцюг (мають четвертинну структуру).
Алостеричні модулятори
-зв’язуються нековалентно з алостеричним центром -регулюють активність фермента змінюючи його конформацію
• Позитивні модулятори (активатори)
–зв’язуються з алостеричним центром і стимулюють активність фермента;
–зазвичай є субстратом реакції – зворотній позитивний зв’язок
• Негативні модулятори (інгібітори)
–зв’язуються з алостеричним центром і інгібують активність фермента;
–зазвичай є кінцевими продуктами біохімічних шляхів – зворотній негативний зв’язок
Дія позитивного ефектора (активатора)
Дія негативногоефектора (інгібітора)
Алостеричні ферменти |
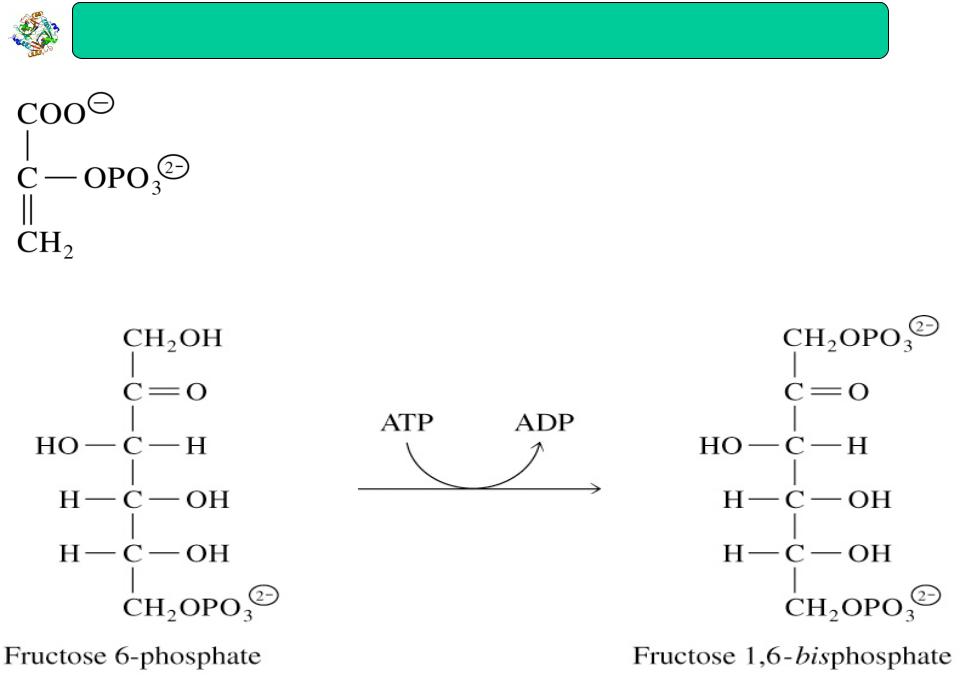
ФФК-1 |
фосфофруктокіназа-1 (ФФК-1)
•Каталізує реакцію гліколізу на початку процесу.
•Фосфоенолпіруват, проміжна сполука гліколізу, є алостеричним інгібітором ФФК-1.
фосфофруктокіназа-1
|
|
Фруктозо 1,6-дифосфат |
Фруктозо 6-фосфат |
|
|
|
|
|
|
|
|

Кофактори та коферменти Роль кофактора и кофермента
Більшість ферментів для прояву ферментативної активності потребує іони металів (КОФАКТОРИ) і/або низькомолекулярних органічних сполук небілкової природи (КОФЕРМЕНТИ).
•Зміна третинної структури білку і створення комплементу між Е і S.
•Безпосередня участь в реакції в якості ще одного S. Звичайно це органічні коферменти, вони донори або акцептори хімічних груп.
функції простетических груп;
•Служать акцепторами і донаторами електронів;
•Роль Ме в приєднанні S в АкЦ Е :
-стабілізатори молекули S,
-стабілізатори АкЦ Е,
-стабілізатори третинної і четвертинної структури.
•Роль Ме в регуляції активності Е
•Участь: у приєднанні субстрату;
-власне в каталізі;
-у стабілізації оптимальної конформації молекули ферменту;
-у стабілізації четвертинної структури.

Кофактори та коферменти |
металозалежні ферменти |
||
|
|
|
|
Фермент |
Іон металу |
Функция іону металла |
|
|
|
|
|
Гексокіназа |
Mg2+ |
|
Зв’язування субстрату |
|
|
|
|
Піруваткіназа |
Mg2+, К+ |
|
Зв’язування субстрату та |
|
|
|
каталіз |
|
|
|
|
Аргіназа |
4Мn2+ |
|
* |
|
|
|
|
1,4 α-амілаза |
Са2+ (та аніон Сl) |
Стабілізація третинної |
|
|
|
|
структури |
|
|
|
|
Карбоксипептидаза А |
Zn2+ |
|
Каталіз |
|
|
|
|
Транскетолаза |
Са2+ |
|
Стабилізація |
|
|
|
четвертинної структури |
|
|
|
|
Супероксиддисмутаза |
2Zn2+, 2Сu2+ |
Каталіз |
|
|
|
|
|
Церулоплазмін |
8Сu2+ |
|
« |
|
|
|
|
Ксантиноксидаза |
2Мо6+ |
|
« |
|
|
|
|

Кофактори та коферменти металозалежні ферменти (гексокіназа)
Участь Mg2+ у приєднанні субстрату в активному центрі гексокінази
В активному центрі гексокінази є ділянки зв'язування для молекули глюкози і комплексу Мg2+— АТФ. У результаті ферментативної реакції відбувається перенесення кінцевого - фосфатного залишку АТФ на глюкозу з утворенням глюкозо-6-фосфату.

Коферменти |
Класифікації коферментів |
•Коферменти діють як переносники водню, електронів, груп атомів.
Класифікація коферментів:
За хімічною природою:
•вітамінні;
•вітаміноподібні;
•невітамінні.
2. За механізмом дії :
•переносники атомів водню, електронів і протонів.
•переносники окремих хімічних груп.

Коферменти Класифікація коферментів
Коферменти І групи (переносники атомів водню, електронів і протонів):
•Невітамінні: гем, глутатіон,
•Вітамінні: аскорбінова кислота(АК), НАД і НАДФ, ФАД і ФМН, 5 дезоксиаденозилкобаламін.
•Вітаміноподібні: убіхінон(коензим Q), ліпоєвая кислота (ЛК), тетрагідробіоптерин
(ТГБП) хінонові коферменти.
Коферменти ІІ групи (переносники різних хімічних груп):
•Невітамінні: фосфати нуклеозидів, фосфати вуглеводів.
•Вітамінні: ТДФ, КоА, ПАЛФ, біоцитин, ТГФК, метилкобаламін, вітаміни А та
К
