
- •1.Які елементи називаються біогенними елементами?
- •9.Яка реакція середовища у водному розчині ch3cooNa? Відповідь аргументувати.
- •10.Яка реакція середовища у водному розчині Na3po4? Відповідь аргументувати.
- •11. Яка реакція середовища у водному розчині ZnSo₄? Відповідь аргументуйте.
- •12. Яка реакція середовища у водному розчині (ch₃coo)₂Mg? Відповідь аргументуйте.
- •13. Яка реакція середовища у водному розчині nh₄Cl? Відповідь аргументуйте.
- •14. Яка реакція середовища у водному розчині k₂co₃? Відповідь аргументуйте.
- •15. Яка реакція середовища у водному розчині Fe(no₃)₂? Відповідь аргументуйте.
- •16. Яка реакція середовища у водному розчині AlCl₃? Відповідь аргументуйте.
- •17. Яка реакція середовища у водному розчині Na₂s? Відповідь аргументуйте.
- •18.Де краще розчиняється кисень: у воді чи у крові? Відповідь аргументуйте.
- •46.Що таке водневий показник? За якою формулою його обчислюють?
15. Яка реакція середовища у водному розчині Fe(no₃)₂? Відповідь аргументуйте.
1. Fe(NO₃)₂ - розчинна сіль, утворена сильною кислотою НNO₃ та слабкою основою Fe(OH)₂ →дана сіль зазнає гідролізу. 2. У водному розчині сіль дисоціює на йони: Fe(NO₃)₂ → Fe² + 2NO₃¯ З водою буде реагувати катіон Fe²⁺, оскільки самейому відповідає слабкий електроліт. 3. Перша стадія гідролізу: Fe²⁺ + Н₂О ↔ Fe (OH)₂ + H⁺ - скорочене йонне рівняння Fe(NO₃)₂ + H₂O ↔ Fe (OH)₂ + HNO₃ - молекулярне рівняння. Відповідь: Середовище розчину ферум нітратукисле, оскільки в результаті гідролізу солі в розчині збільшується кількість катіонів Н⁺.
16. Яка реакція середовища у водному розчині AlCl₃? Відповідь аргументуйте.
1.AlCl₃ - розчинна сіль утворена сильною кислотою HCl та слабкою основою Al(OH)₃ → дана сіль зазнає гідролізу
2.У водному розчині сіль дисоціює на іони:
AlCl₃ → Al³⁺ + 3Cl⁻
З водою буде реагувати катіон Al³, оскільки саме йому віповідає слабкий електроліт. 3. Перша стадія гідролізу:
Al³⁺ + H₂O ↔ Al(OH)²⁻ + H⁺ - скорочене іонне рівняння
AlCl₃ + H₂O ↔ AlCl(OH) + HCl – молекулярне рівняння
Відповідь: Середовище розчину хлориду алюмінію кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів Н⁺.
17. Яка реакція середовища у водному розчині Na₂s? Відповідь аргументуйте.
1.Na₂S- розчинна сіль, утворена слабкою кислотою H₂S та сильною основою NaOH → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
Na₂S → 2Na⁺ + S²⁻
З водою буде реагувати аніон S ²⁻, оскільки саме йому віповідає слабкий електроліт. 3. Перша стадія гідролізу:
S²⁻ + H₂O ↔ HS⁻ + OH⁻ - скорочене іонне рівняння
Na₂S + H₂O ↔ NaHS + Na(OH) – молекулярне рівняння
Відповідь: Середовище розчину сульфіду натрію лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН⁻.
18.Де краще розчиняється кисень: у воді чи у крові? Відповідь аргументуйте.
Кисень краще розчиняється у воді, оскільки в крові він не розчиняється, а лише зв’язується з гемоглобіном і переноситься по організму. Кров лише приблизно на 70% складається з води і тому відповідно розчинність у цій частині є достатньо великою. А оскільки вода є «чистим продуктом» то в ньому розчинність вища. Але на фактор розчинності можуть вплинути також температура і тиск.
19.За якою формулою можна обчислити молярну концентрацію йонів ОН⁻, якщо відома молярна концентрація йонів Н⁺?
[OH⁻]=
20.Що таке молярна концентрація розчиненої речовини? В яких одиницях вона вимірюється?
Молярна концентрація розчиненої речовини с(х) – відношення кількості речовини компонента n(x) до об’єму розчинуV(р-ну):
С(х)=
 =
=

У системіSI молярну концентрацію слід вимірювати в моль/м³, проте у лабораторній практиці молярну концентрацію вимірюють у моль/л.
21.Що таке молярна концентрація еквіваленту розчиненої речовини? В яких одиницях вона вимірюється?
Молярна
концентрація еквіваленту розчиненої
речовини с – відношення кількості речовини
еквівалента компонента n
– відношення кількості речовини
еквівалента компонента n до об’єму V(р-ну):
до об’єму V(р-ну):
с
Молярну концентрацію еквіваленту розчиненої речовини вимірюють у моль/л
22.Що таке масова частка розчиненої речовини? В яких одиницях вона вимірюється?
Масова частка розчиненої речовини ω(Х) – відношення маси компонента m(x) до маси розчинуm(р-ну):
ω(Х)
=

Масова частка не має розмірності. Масова частка може бути виражена також у відсотках, тоді
ω(Х)
=
 · 100%
· 100%
23.Що таке масова концентрація розчиненої речовини? В яких одиницях вона вимірюється?
Масова концентрація розчиненої речовини p(x)– відношення маси компонента m(x) до об’єму розчину V(р-ну):
р(х) =

Масову концентрацію вимірюють у кг/м³. Допускається також г/м³; г/л; г/см³; мг/л; мг/см³ тощо
24.Який зв'язок між молярною концентрацією розчиненої речовини та молярною концентрацією еквівалента розчиненої речовини?
c
 = c
= c
 · z
· z
Прямопропорційна залежність: чим більша молярна концентрація розчиненої речовини тим більша молярна концентрація еквівалента розчиненої речовини.
25. Який зв'язок між молярною концентрацією розчиненої речовини та масовою концентрацією розчиненої речовини?
p
 = c
= c · M
· M
Прямопропорційна залежність: чим більша молярна концентрація розчиненої речовини тим більша масова концентрація розчиненої речовини.
26.Який зв'язок між масовою часткою розчиненої речовини та масовою концентрацією розчиненої речовини?
m(р-ну) ·w( )
=p(
)
=p(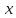 )
·V(р-ну)
)
·V(р-ну)
Прямопропорційна залежність: чим більша масова частка розчиненої речовини, тим більша масова концентрація розчиненої речовини.
27.Як приготувати 200г спиртового розчину йоду з масовою часткою йоду 5%?
Дано:
1)m(I)
= 200 · 0,05 = 10 г
m(р-ну) =200 г 2)m(спирту) = 200 – 10 = 190 г
ω(I)=5%
m(I)-?
m(спирту)-?
Відповідь: Потрібно змішати 190 г спирту з 10 г йоду.
28.Як приготувати 300г спиртового розчину йоду з масовою часткою йоду 5%?
Дано:
1)m(I)
=300 · 0,05 = 15г
m(р-ну) =300 г 2)m(спирту) =300 – 15=285г
ω(I)=5%
m(I)-?
m(спирту)-?
Відповідь: Потрібно змішати 285 г спирту з 15 г йоду.
29.Як приготувати 1000г фізіологічного розчину NaCl(масова частка NaCl дорівнює 0,9%)?
Дано:
1)m(NaCl)
= 1000 · 0,009 = 9 г
m(р-ну) =1000 г 2)m(Н₂О) = 1000 – 9 = 991 г
ω(NaCl)=0,9%
m(NaCl)-?
m(H₂O)-?
Відповідь: Потрібно змішати 9 г хлориду натрію і 991 г води.
30.В чому полягає принципова відмінність комплексних сполук від інших? Навести приклади комплексних сполук.
Комплексні сполуки – хімічні сполуки, кристалічні решітки яких складаються з комплексних груп, утворених внаслідок взаємодії іонів або молекул, здатних існувати самостійно. І їх утворення з більш простих сполук не пов’язане з виникненням нових електронних пар.
K₄[Fe(CN)₆]; [Zn(NH₃)₄(OH)₂]; [Pt(NH₃)₂Cl₂];
31.Які комплекси називають катіонними? Навести два приклади.
Катіонні комплекси – це ті комплекси, внутрішні сфери яких, мають позитивний заряд.
[Co³⁺(NH₃⁰)₆]³⁺Cl₃⁻; [Cu²⁺(NH₃⁰)₂H₂O⁰Cl⁻]⁺NO₃⁻;
32.Які комплекси називають аніонними? Навести два приклади.
Аніонні комплекси – це ті комплекси, внутрішні сфери яких, мають негативний заряд.
K⁺[Ag⁺(CN)⁻₂]⁻; Cu²⁺[Pt⁺⁴Cl⁻(OH)⁻₅]²⁻;
33.Які комплекси називають нейтральними? Навести два приклади.
Нейтральні комплекси–це ті комплекси, які не мають зовнішньої сфери, а заряд внутрішньої сфери відповідно 0.
[Pt²⁺(NH₃⁰)₂Cl₂⁻]; [Co³⁺(NH₃⁰)₃(NO₂)⁻₃]
34.Які комплекси називають аквакомплексами? Навести приклад.
Аквакомплекси – це ті комплекси, лігандами яких є вода. [Al(H₂O)₆]Cl₃
35.Які комплекси називають ацидокомплексами? Навести приклад.
Ацидокомплекси –це ті комплекси, для яких лігандами є кислотні залишки. K[Ag(CN)₂]
36.Які комплекси називають амінокомплексами? Навести приклад.
Амінокомплекси – це ті комплекси, лігандами яких є молекули NH₃, або молекули, що містять групи: NH₂, NH, або N. [Cr(CH₃NH₂)₆](NO₃)₃
37.Що таке комплексоутворювач? Що таке ліганди? Що таке координаційне число?
Комплексоутворювач – це центральний атом або центральний іон. Типовими комплексоутворювачами є Cr, Co, Ni, Fe, Mn, Ag⁺, Au⁺, Cu⁺, Cu²⁺, Hg²⁺, Cd²⁺, Zn²⁺, Fe²⁺, Co²⁺, Ni²⁺, Pt²⁺, Cr³⁺, Fe³⁺, Pt⁴⁺
Ліганди – молекули неорганічних і органічних сполук Н₂О, NH₃, OH⁻, CN⁻,Cl⁻, F⁻ тощо, які за рахунок неподільних електронних пар утворюють ковалентні зв’язки з комплексоутворювачем за донорно-акцепторним механізмом.
Кординаційне число – кількість ᵟ зв’язків, які утворює центральний атом з лігандами.
38.Чому дорівнює ступінь окиснення феруму в гемі гемоглобіну?
2+
39.Чому дорівнює координаційне число в гемі гемоглобіну?
4
40.Чим відрізняється будова молекули гемоглобіну від будови молекули оксигемоглобіну?
Оксигемоглобін це гемоглобін, який приєднав кисень.
41.Чим відрізняється будова молекули гемоглобіну від будови карбоксигемоглобіну?
Карбоксигемоглобін це гемоглобін до якого приєднався вуглекислий газ.
42.Який йон є комплексоутворювачем в інсуліні?
Zn²⁺
43. Який йон є комплексоутворювачем у вітаміні В₁₂?
Co²⁺
44. Який йон є комплексоутворювачем у хлорофілі?
Mg²⁺
45.Що таке хелати? Що таке хелатотерапія?
Хелати - клішнеподібні комплексні сполуки, що утворюються при взаємодії іонів металів з молекулами деяких органічних сполук, що містять солеутворюючу і комплексоутворюючу групи. Хелатні сполуки містять центральний іон (частинку) —комплексоутворювач— і координовані навколо ньоголіганди. Хелатні сполуки часто використовуються в хімії для розділення, концентрації і визначення різних елементів.
Хелатотерапія - це виведення токсичних часток з організму, засноване на хелатируванні їх комплексонатами s-елементів.
