
- •1.Функції печінки
- •2. Панкреатичне і кишкове травлення. Роль жовчі в механізмі травлення
- •3.Синтез гема
- •4. Вторинні месенджери та їх роль в механізмах гормонального впливу на клітини-мішені
- •5. Нормальні і патологічні складові сечі
- •6.Катаболізм пуринових нуклеотидів
- •1.Види жовтяниць. Причини виникнення
- •2. Блокування біосинтезу білка дифтерійним токсином (адф-рибозилювання факторів трансляції)
- •3. Джерело енергії для м’язового скорочення. Атф, креатинфорфат. Особливості обміну в серцевому м’язі.
- •4. Всмоктування вуглеводів. Порушення травлення і всмоктування. Недостатність лактази
- •5. Орнітиновий цикл сечоутворення. Послідовність реакцій
- •6. Порушення обміну медіаторів і модуляторів головного мозку при психічних розладах. Нейрохімічні механізми дії психотропних препаратів
- •1.Антизгортальна система крові.
- •2.Технологія трансплантації генів.
- •3. Експресія генів на рівні транскрипції.
1.Антизгортальна система крові.
Антикоагулянти виконують функції інгібіторів певних білкових факторів згортання крові. Зниження вмісту цих інгібіторів у плазмі крові людини спричиняє підвищення схильності крові до згортання і може призводити до тромбозу.Антитромбіни - білки крові, що гальмують каталітичну активність тромбіну. Найпотужнішим інгібітором тромбіну є антитромбін III - білок, антикоагулянтна активність якого значно зростає в присутності гепарину. Антитромбін III здатний зв'язуватися із сериновими протеїназами ферментного каскаду коагуляції крові, блокуючи, крім тромбіну, активність таких факторів, як ІХа, Ха, ХІа, ХПа. - інгібітор протеїназ (аі - антитрипсин) - глікопротеїн о^-глобулінової фракції плазми крові (розділ 28). Інгібітор має широкий спектр антипротеїназної дії, гальмую чи активність багатьох серинових протеїназ, зокрема тромбіну, факторів Ха та ХІа системи згортання крові. а2 - макроглобулін -глікопротеїн а2-глобулінової фракції плазми крові, що є інгібітором протеїназ із широкою субстратною специфічністю, блокуючи серинові, тіолові, карбокси- та металопротеїнази. Концентрація а2-макроглобуліну в плазмі крові людини (до 2,5 г/л) найвища, порівняно з іншими протеїназними інгібіторами. а2-Макроглобулін є інгібітором тромбіну, активність якого, на відміну від антитромбіну III, не
залежить від дії гепарину. На частку цього інгібітора припадає до 25 % антитромбінової
активності плазми крові. Гепарин - гетерополісахарид (глікозаміноглікан), що є потужним природним антикоагулянтом. Його молекула побудована з дисахаридних фрагментів, що повторюються і складаються із залишків сульфатованої D-глюкуронової або L-ідуронової кислоти та N-ацетилглюкозаміну; гепарин існує у формі поодиноких полісахаридних ланцюгів або
у вигляді протеогліканів, тобто білків, які зв'язані з декількома глікозаміноглікановими
ланцюгами. Гепарин синтезується опасистими клітинами (гепариноцитами), що розташовані в
печінці, легенях та впродовж стінок кровоносних судин. Механізм антикоагулянтної дії
гепарину полягає в активації антитромбіну III: взаємодія з гепарином спричиняє кон-
формаційну перебудову антитромбіну III, в результаті якої в останнього з'являється
можливість зв'язуватися із сериновими протеїназами коагуляційного каскаду,
блокуючи їх каталітичні активності. Кумарини - антикоагулянти природного (рослинного) та синтетичного походження, антагоністи вітаміну К. Вони є антикоагулянтами непрямої дії, протидіють утворенню біохімічно активних (у-карбоксиглутамінованих) факторів коагуляції - II, VII, IX, X. У лікарській практиці для профілактики та лікування тромбозів застосовують такі похідні 4-оксикумарину, як Неодикумарин, Синкумар.
2.Технологія трансплантації генів.
Технологія трансплантації генів:
1) отримання в чистому вигляді, тобто у формі ізольованого фрагмента ДНК, гена
з певними властивостями (тобто такого, що кодує синтез необхідного ферменту,
гормону тощо);
2) конструювання рекомбінантної (гібридної, химерної) молекули ДНК;
3) введення рекомбінантної ДНК всередину реципієнтної бактеріальної клітини
(тобто такої, в якій буде здійснюватися реплікація, клонування необхідного гена);
4) клонування рекомбінантної ДНК.
2. Конструювання рекомбінантної ДНК
Ген, що був отриманий за допомогою вищерозглянутої процедури (кДНК), необхідно
ввести в бактеріальну клітину таким чином, щоб він інтегрувався в її геном. Для цього
формують рекомбінантну ДНК, що складається з кДНК та особливої молекули ДНК,
яка править за провідник, або вектор, здатний до проникнення в реципієнтну клітину.
3. Введення рекомбінантної ДНК всередину реципієнтної клітини та кло-
нування необхідного гена Рекомбінантні ДНК, що складаються з плазмідної ДНК та ДНК гена, що
трансплантується (наприклад, гена, який кодує синтез певного білка організму людини) при взаємодії з бактеріальними клітинами (що є нормальними хазяїнами
для даної плазміди), можуть проникати всередину останніх. Усередині клітини хазяїна відбувається реплікація (клонування) рекомбінантної ДНК з утворенням багатьох тисяч копій. У подальшому ці клоновані ДНК виходять з бактеріальної клітини, і з них можливо (знову ж таки за допомогою рестриктаз) виділити велику кількість копій шуканого гена.
Білет 10
Дія стероїдних та тиреоїдних гормонів.
проникнення гормону всередину клітини ► сполучення гормону з цито-
зольним рецептором ► модифікація {активація) рецептора у складі
гормонорецепторного комплексу ^-транслокація модифікованого
гормонорецепторного комплексу в ядро *-взаємодія комплексу зі
специфічною ділянкою ДНК хроматину ► активація специфічних
генів >-транскрипція мРНК *~ синтез ферментних білків,
що реалізують біологічні ефекти гормону.
Білет 11
Дія гормонів білково-пептидної природи та катехоламінів
Залежно від клітинної локалізації рецептора, характеру його взаємодії з гормоном та механізмами реалізації гормонального сигналу, всі гормони поділяють на дві великі групи:
1. Гормони, що не проникають всередину клітин і взаємодіють зі своїми рецепторами,локалізованими в плазматичних мембранах клітини; до цієї групи належитьбільшість гормонів білково-пептидної природи та похідні амінокислот.
2. Гормони, які для реалізації своєї специфічної дії проникають всередину клітин, де вони взаємодіють з внутрішньоклітинними цитозольними (в деяких випадках -ядерними) рецепторами; до цієї групи належать ліпофільні стероїди, а також тиреоїдні гормони. Гормони першої групи здійснюють трансформацію регуляторного сигналу в специфічну функціональну активність
клітини-мішені за рахунок таких молекулярних подій:
(1) взаємодії гормону на поверхні плазматичної мембрани з білковим рецептором;
(2) передачі хімічного сигналу з рецептора, модифікованого за рахунок взаємодії з лігандом (гормоном, іншим біорегулятором), через трансформуючі білки-трансдук- тори (G-білки) на внутрішньоклітинні сигнальні системи;
(3) утворення (або вивільнення) внутрішньоклітинних сигнальних молекул - вторинних посередників (циклічних нуклеотидів цАМФ, цГМФ, фосфоінозитидів, іонів Са2+);
(4) взаємодії вторинних посередників з ферментними білками клітини з включенням (як правило, через активацію специфічних протеїнкіназ) ефекторних систем клітини, тобто послідовних стадій розвитку клітинної біохімічної реакції на гормональний стимул.
Транспортні РНК. Активація АК, Аміноацил-тРНК-синтетази. Кодони РНК
тРНК, що виконують функцію адапторів у процесі трансляції, взаємодіючи з кодонами мРНК та певними амінокисло тами - близько 20 типів різних тРНК, відповідно до кількості амінокислот, які вони акцептують (рис. 21.2); аміноацил-тРНК-синтетази (АРС-ази) - ферменти, що активують
амінокислоти та сполучають амінокислотні залишки з З'-кінцями акцепторних гілок тРНК.
АРС-ази є ферментами з високою специфічністю як відносно певної амінокислоти,
так і тРНК, що їй відповідає; регуляторні білки - білкові фактори ініціації (IF), елонгації (EF) та термі- нації, або рилізинг-фактори (RF); білкові фактори еукаріотів мають позначення elF, eEF та eRF, відповідно; коферменти - ГТФ, АТФ.
Транспортні РНК та активація амінокислот Загальні риси будови різних тРНК були детально розглянуті вище (розділ З, п. 3.4). Для кожної з 20 oc-L- амінокислот існує щонайменше один специфічний для неї тип тРНК. Разом з тим, різні молекули тРНК відзначаються схожістю у вторинній та третинній структурі, що пояснюється загальним характером біохімічної функції. Важливою структурною особливістю тРНК є наявність у складі антикодонової петлі специфічного триплету нуклеотидів - антикодону, який є комплементарним кодону мРНК і забезпечує сполучення між тРНК та мРНК (кодон-антикодонову взаємодію) під час утворення
ініціюючого комплексу. Саме ці дві біохімічні властивості тРНК - здатність до взаємодії з певною амінокислотою, по-перше, і здатність до взаємодії із специфічним ко- доном мРНК, по-друге, є молекулярною основою адапторної функції тРНК, тобто можливості сполучати два інформаційні потоки - "нуклеотидний" та "амінокислотний" - у процесі фенотипічної експресії генетичної інформації. Взаємодія між тРНК та відповідною їй амінокислотою вимагає взаємного
розпізнавання (рекогніції) цих молекул, що здійснюється лише за умов наявності спеціальних білків, які мають специфічні сайти для рекогніції як тРНК, так і a-L-амінокислоти. Цей процес розпізнавання та наступного сполучення двох біомолекул різних класів відбувається у два етапи і каталізується аміноацил-тРНК-синтетазами.
Білет 12
Гормони на обмін кальцію та фосфатів
Паратгормон (паратиреоїдний гормон) - сполука, що синтезується в головних і ацидофільних клітинах паращитовидних залоз. За хімічною природою є простим білком (м.м.= 9,5 кДа), який має один поліпептидний ланцюг, що складається з 84 амінокислотних залишків. Паратгормон синтезується на рибосомах у формі препропа- ратгормону (115 амінокислотних залишків), який підлягає процесингу в ендоплазматичному ретикулумі та апараті Гольджі з утворенням спочатку пропаратгормону (90 амінокислотних залишків), а потім - парат-
гормону. Паратгормон має гіперкальціємічний ефект, водночас зменшуючи концентрацію в крові фосфатів, що є результатом його впливу на обмін цих сполук у таких ефекторних системах: - у кістковій тканині паратгормон стимулює функціональну активність остеокластів, що призводить до резорбції як органічного матриксу, так і неорганічних структур кістки із звільненням кальцію та фосфатів і виходом їх у екстрацелюлярнии простір та в кров. Внутрішньоклітинними посередниками в дії паратгормону на остеокласти виступають іони кальцію, які надходять у клітини внаслідок взаємодії гормону з мембранними рецепторами і після сполучення з каль- модуліном спричиняють активацію синтезу ферментів, що беруть участь у резорбції кісткової тканини. - в нирках паратгормон збільшує реабсорбцію Са2+ в дистальних відділах ка-
нальців та, навпаки, пригнічує реабсорбцію фосфатів, що може призводити при аномальному зростанні кількості гормону в організмі (див. нижче) до фосфатурії та гіпофосфатемії;
- в кишечнику дія паратгормону призводить до стимуляції всмоктування Са2+в кров через апікальні мембрани ентероцитів; цей ефект гормону є опосередкованим за рахунок його позитивного впливу на біосинтез кальцитріолу, який є справжнім активатором абсорбції кальцію в кишечнику. Кальцитріол (l,25(OH)2D3)
Кальцитріол - сполука гормонального типу дії, що утворюється в організмі з
біологічного попередника, яким в організмі людини та вищих тварин є жиророзчинний
вітамін D3 {холекальциферол, кальціол). Біологічна функція кальцитріолу полягає в стимуляції всмоктування Са2+ та фосфатів у кишечнику. Кальцитріол є єдиною природною фізіологічно активною спо лукою, ефект якої полягає в транспортуванні Са2+проти концентраційного градієнта, що існує на мембрані ентероцитів; тим самим кальцитріол підтримує фізіологічні
концентрації кальцію і фосфатів у плазмі крові, що забезпечує умови для нормальної
побудови кісткової тканини.
Кальцитонін - гормон, який синтезується в парафолікулярних (С-клітинах) щитовидної залози. кальцитонін є гормоном гіпо- кальціємійної дії, що зменшує концентрацію в плазмі крові Са2+та неорганічних фосфатів. Механізм дії кальцитоніну полягає в пригніченні функції остеокластів та
зменшенні їх утворення з клітин-попередників; у результаті цих клітинних ефектів резорбція як органічної, так і неорганічної складової кісткового матриксу гальмуються, що призводить до зменшення надходження в кров кальцію та фосфатів. Фізіологічним стимулятором секреції кальцитоніну є зростання концентрації Са2+в плазмі крові.
Єдиний нейрогуморальний механізм регуляції
???
Білет 13
ЦТК і механізми, що контролюють його у мозку
???
Катаболізм піримідинових нуклеотидів
Р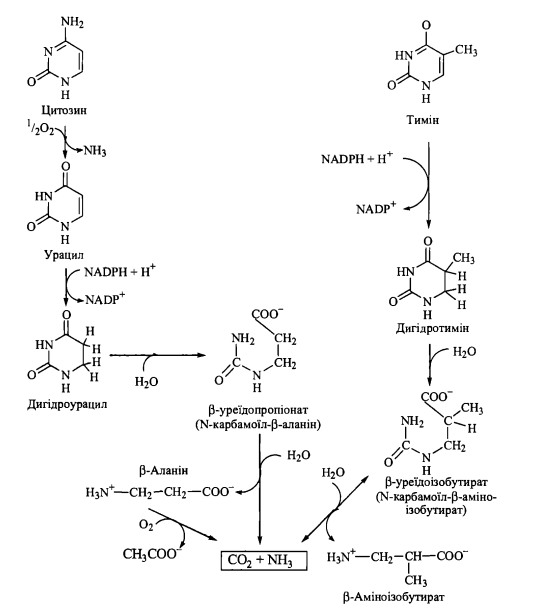 озщеплення
піримідинових нуклеотидів Початкові
етапи катаболізму піримідинових
нуклеотидів, як і в разі пуринових
нуклеотидів, полягають у відщепленні
рибозофосфату з подальшим окисленням
утворених піримідинів. Катаболізм
азотистих основ (урацилу, цитозину,
тиміну) полягає в розриві піримідинових
циклів з утворенням у якості продуктів
похідних амінокислот - ^-аланіну та
$-аміноізобутирату. В свою чергу, ^-аланін
розщеплюється до двоокису вуглецю та
аміаку, тоді як $-аміноізобутират може
метаболізуватися подібно до інших
озщеплення
піримідинових нуклеотидів Початкові
етапи катаболізму піримідинових
нуклеотидів, як і в разі пуринових
нуклеотидів, полягають у відщепленні
рибозофосфату з подальшим окисленням
утворених піримідинів. Катаболізм
азотистих основ (урацилу, цитозину,
тиміну) полягає в розриві піримідинових
циклів з утворенням у якості продуктів
похідних амінокислот - ^-аланіну та
$-аміноізобутирату. В свою чергу, ^-аланін
розщеплюється до двоокису вуглецю та
аміаку, тоді як $-аміноізобутират може
метаболізуватися подібно до інших
розгалужених амінокислот з утворенням сукциніл-КоА.
Білет 14
Порушення гомеостазу кальцію
Найбільш поширеними клінічно окресленими порушеннями гомеостазу кальцію є патологічні синдроми, пов'язані з дефіцитом вітаміну D3 (які проявляються як рахіт у дітей і різні форми остеопорозу в дорослому та похилому віці) та захворювання, спричинені первинною патологією паращитовидних залоз—гіпер- та гіпопаратиреоз.
Рахіт - захворювання дитячого віку, яке спричиняється зменшеним надходженням та (або) синтезом в організмі вітамінів групи D — тваринного D3 (холекальциферолу) та рослинного D2 (ергокальциферолу). Вірогідність захворювання значно зростає в умовах недостатнього опромінення шкіри дитини сонячним світлом, що є необхідним для утворення вітаміну D3 з 7-дегідрохолестерину. Основними проявами рахіту є гіпо- кальціємія та гіпофосфатемія, які призводять до глибоких порушень кальцифікації кісткової тканини та специфічних змін скелета.
Гіперпаратиреоз - група захворювань, розвиток яких пов'язаний із надлишковою секрецією паратгормону, аномальним збільшенням внаслідок цього концентрації кальцію в сироватці крові і гіпофосфатемією. Первинний гіперпаратиреоз - патологія, що спричиняється наявністю в паращитовидних залозах гормонально активних пухлин - аденоми, карциноми - або гіперплазією залози. Провідними симптомами захворювань цієї групи є ураження кісткової системи (проявляється демінералізацією кісток остеопорозом) та нирок із розвитком сечокам'яної хвороби (внаслідок відкладання солей та утворення каменів, що складаються з оксалату та фосфату кальцію) і нефрокальцинозу.
Хімічний склад поперечно-смугастих мязів.
Біохімічний склад м'язів Скелетні м'язи ссавців містять у своєму складі: 72-80 % води; 16-20 % білків; 0,9-2,2 % небілкових азо-і А ! тистих сполук (креатин, креатинфосфат, АТФ,
АДФ, амінокислоти тощо); безазотисті органічні сполуки (глікоген - 0,3- 3,0 %; фосфоліпіди - 0,4— 1,0%; холестерин - 0,06- 0,2 %); мінеральні елементи (К+, Са2+, Na+ тощо).
Білки м'язів Білки скелетних м'язів складаються з водонероз- чинних білків міофібрил (які становлять 75-80 % загального вмісту білків м'язів) і водорозчинних білків саркоплазми - так званого "міогену" До складу фракції міогену входять переважно ферменти, що каталізують ката-
болічні реакції, які забезпечують біоенергетику м'язового скорочення - глікогенфос-
форилаза, ферменти гліколізу, креатинфосфокіназа, аденілаткіназа, кисеньдепо-
нуючий білок міоглобін. У саркосомах містяться ферменти циклу трикарбонових
кислот, біологічного окислення й окисного фосфоритування.
Білки міофібрил До складу міофібрил входять такі білки: 1) до складу товстих ниток - білок міозин; 2) до складу тонких ниток - білки актин, тропоміозин, тропоніновий комплекс {тропонін Т, тропонін І, тропонін Q; 3) білок a-актинін - компонент Z-лінії саркомерів; з цим білком сполучені кінці F-актинових молекул тонких філаментів. Міозин - фібрилярний білок, що утворює товсті філаменти міофібрил. Молекула міозину асиметрична, складається з двох важких поліпептидних ланцюгів, що мають конформацію ос-спіралі й закручені один відносно одного; довжина молекули - 160 нм. N-кінці важких ланцюгів утворюють глобулярні "головки", які нековалентни- ми зв'язками сполучені з додатковими чотирма легкими поліпептидними ланцюгами. В умовах триптичного гідролізу міозин розщеплюється на два фрагменти - меро- міозини: легкий мероміозин — LMM {light meromyosin - англ.) та важкий мероміозин - НММ {heavy meromyosin — англ.). Подальший гідроліз НММ папаїном спричиняє утворення двох ідентичних глобулярних субфрагментів S1 (головок міо зину) і паличкоподібного субфрагмента S2
(рис. 33.3). До складу головок S1 входять каталітичні центри з АТФ-азною активністю і
центри для зв'язування з актином (при відсутності АТФ). Фібрилярні "хвости" молекул міозину
контактують між собою в поздовжньому напрямку, утворюючи товсті філаменти саркомерів, до складу кожного з яких входять близько 400 молекул міозину. Глобулярні головки виступають із зовнішньої поверхні філамента (рис. 33.4). Актин - білок, що існує у двох формах: G- та F-актин. G-актин - глобулярний білок, що має вигляд кулястих молекул діаметром близько 5 нм. Молекули G-актину (субоди- ниці) нековалентно сполучаються між собою, утворюючи намистоподібні утворення -ланцюги фібрилярного F-актину. У м'язових клітинах F-актин представлений фібрилярними структурами, що складаються з двох ланцюгів, переплетених один навколо одного (рис. 33.5). F-актин складає основу будови тонких ниток саркомерів. У складі тонких ниток ланцюги F-актину сполучені з тропоміози- ном і тропонінами. Тропоміозин - білкові молекули витягнутої форми, що складаються з двох поліпептидних ланцюгів (а та 0), які утворю ють подвійну спіраль. Паличкоподібні молекули тропоміозину (довжиною 40 нм і товщиною 2 нм) розміщуються в борозенках між двома ланцюгами F-актину таким
чином, що кожна молекула тропоміозину контактує із сімома молекулами (субоди-
ницями) G-актину. Тропонін - білок тонких філаментів, що складається з трьох субодиниць: ТпТ, ТпІ, ТпС. Тропонінові комплекси мають глобулярну форму і розміщуються впродовж ак-
тинового філамента з інтервалами в 38,5 нм, контактуючи з кінцями молекул
тропоміозину (рис. 33.6). Найбільш вивченим компонентом тропонінового комплексу є ТпС - кальційзв 'язуючий білок, близький за структурою і властивостями до кальмодуліну - універсального трансдуктора кальцієвих сигналів у біохімічних системах. Білок ТпІ взаємодіє з актином, ТпТ - забезпечує взаємодію тропонінового комплексу з тропоміозином.
