
NK 1 kontr / biosynt pU pA
.docБіосинтез мононуклеотидів
Біосинтез рибо- і дезоксирибонуклеотидів являється життєво-важливим процесом, оскільки ці біомолекули служать прямими попередниками ДНК, РНК, а також нуклеотидних коферментів. Центральна ланка біосинтезу мононуклеотидів – синтез пуринових та піримідинових основ. Майже всі організми, за виключенням небагатьох бактерій, здатні синтезувати основи НК із дуже простих попередників. Для шляхів біосинтезу мононуклеотидів характерно те, що вони знаходяться під контролем значного числа алостеричних регуляторних систем.
Біосинтез піримідинових основ
В ранніх дослідженнях з використанням ізотопної мітки було виявлено, що попередниками піримідинового кільця служать вуглекислий газ і аміак. Але можна вважати, що перші, дійсно важливі дані по біосинтезу піримідинів були одержані при вивченні мутантів Neurospora crassa, ауксотрофних по піримідинам і ,тому, нездатні до росту в середовищі без Ц і У. Виявилось, що мутанти, не здатні синтезувати піримідини, можуть нормально рости при додаванні оротової кислоти – піримідинового похідного, вперше виявленого в коров’ячому молоці.
схема синтезу піримідинів:




Перехід рУ рЦ здійснюється:
УМФ + АТФ УТФ + АМФ
УМФ + NH3+ АТФ ЦТФ + АМФ
Регуляція біосинтезу піримідинів
Виявлено, що аспартат карбамоїл трансфераза, яка каталізує першу реакцію карбамоїл фосфату з аспарагіновою кислотою, інгібується кінцевими продуктами реакції УТФ і ЦТФ (рррУ і рррЦ). Високоочищена аспартат карбамоїл трансфераза – фермент з високою М.в. (300 000), який подібно багатьом алостеричним ферментам містить декілька субодиниць. По останнім даним аспартат карбамоїл трансфераза містить 6 регуляторних і 6 каталітичних субодиниць.
Важливу роль у вивченні біосинтезу пуринів відіграли досліди Бьюкенена проведені на голубах, яких він годував різними міченими попередниками. У птахів, як відомо, азот виводиться з організму головним чином у вигляді сечової кислоти, яка є похідним пурину. Виявилось, що попередниками пурину є:

Відповідно уявлень, поширених до досліджень Бьюкенена, на першій стадії повинно утворюватись пуринове кільце, а вже потім до нього приєднується D-рибоза і фосфат (як і в піримідинів). Потрібно було декілька років досліджень, щоб показати, що насправді відбувається не так. Виявилось, що спочатку утворюються ациклічні нуклеотиди, а вже тільки потім кільце замикається.
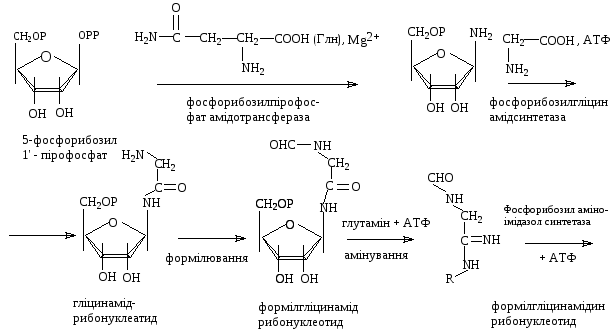

Для утворення інозінової кислоти потрібно 6 макроергічних фосфатних зв’язків ( починаючи з 5 фосфорибозилпірофосфату).
При утворенні інозінової кислоти є стадії, які специфічно інгібуються антибактеріальними агентами.
Антибіотик азасерин,

який є аналогом глутаміну блокує перенос амідної групи на 5-фосфорибозіл–пірофосфат.

Сульфамідні препарати (H2N–C6H4–SO2–NHR), які широко використовуються в медицині для подавлення росту бактерій є аналогами параамінобензойної кислоти (ПАБ): H2N–C6H4–COOH. ПАБ є попередником фолієвої кислоти, яка приймає участь у реакціях формілювання. В результаті конкурентного інгібірування вони блокують нормальне включення ПАБ в фолієву кислоту.
Схема синтезу АМФ і ГМФ починаючи з ІМФ:

Біосинтез дезоксирибонуклеотидів.
Оскільки дезоксирибонуклеотиди відрізняються від рибонуклеотидів тільки вуглеводом (D-2 – дезоксирибоза замість рибози) спочатку вважали, що вони можуть утворюватись точно таким же шляхом, що і рибонуклеотиди, з тою різницею, що замість фосфорильованого похідного D-рибози використовується похідне D-2 – дезоксирибози. Але дослідження з використанням мічених сполук показали, що синтез дезоксирибонуклеотидів здійснюється шляхом прямого відновлення рибонуклеотидів. Якщо годувати тварин, або додавати в культуру бактерій цитидін, який містить 14С як в піримідиновій так і в вуглеводній частині молекули, то мітка включається в залишки цитиділової кислоти РНК і дезоксицитиділової кислоти ДНК, причому відносний вміст 14С в піримідиновій і рибозній частині (дезоксирибозній) не міняється. Ці дані свідчать про те, що при утворенні дезоксирибонуклеотидів, рибоза не відщепляється від основи (не розщеплюється N-глікозидний зв’язок). Яким чином рибонуклеотид відновлюється у відповідний дезоксирибонуклеотид було неясно до 1973 р. В цей час в екстрактах E.coli знайшли фермент, який відповідає за цю реакцію – рибонуклеозиддифосфатредуктазу.
Рибонуклеозиддифосфатредуктаза (М. 245 000) складається з двох поліпептидних субодиниць В1 (М. 160 000) і В2 (М. 78 000).
Активність рибонуклеозиддифосфатредуктази E.coli in vitro в оптимальних умовах складає біля 1% активності, що спостерігається, in vivo.
Виявилось, що всі чотири рибонуклеозиддифосфати можуть відновлюватись до відповідних дезоксианалогів за допомогою ферментної системи, яка містить 4 білки. Для відновлення рибози до D-2-дезоксирибози необхідна пара атомів водню, донорами яких є НАДФ Н.

Недостатній вміст у їжі нікотинової кислоти викликає у людей захворювання, котре називається пелагрою (шершава шкіра). Пелагра поширена у багатьох районах світу, де люди їдять в основному кукурудзу і мало вживають м’яса, молока і яєць.
З метою профілактики і лікування пелагри можна використовувати як нікотинову кислоту, так і її амід.
Нікотинамід – компонент двох близьких за структурою коферментів НАД і НАДФ.
Ці коферменти можуть знаходитись як в окисненій НАД+ і НАДФ+, так і у відновленій (НАДН і НАДФН) формах. Нікотинамідний компонент цих коферментів грає роль проміжного переносника гідрид-іона, котрий ферментативно відщеплюється від молекул субстрату під дією специфічних дегідрогеназ.

Але безпосереднім донором водню служить не НАДФН, а відновлена форма термостабільного білка, названого тіоредоксином, у якого є дві вільні –SH групи на 108 амінокислотних залишків. Тіоредоксин може зворотньо окиснюватись і відновлюватись, переходячи відповідно в дисульфідну або дитіольну форму.
![]()
Відновлений тіоредоксин відновлює рибонуклеозид -5-дифосфат по схемі:

Cхема біосинтезу піримідинів:




Перехід рУ рЦ здійснюється:
УМФ + АТФ УТФ + АМФ
УМФ + NH3+ АТФ ЦТФ + АМФ
Б іосинтез
пуринових нуклеотидів
іосинтез
пуринових нуклеотидів

Для відновлення рибози до D-2-дезоксирибози необхідна пара атомів водню, донорами яких є НАДФ Н.


![]()
Відновлений тіоредоксин відновлює рибонуклеозид -5-дифосфат по схемі:

