|
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ «ФІЗИЧНА ХІМІЯ»
ТЕМА: ВИЗНАЧЕННЯ ШВИДКОСТІ КОРОЗІЇ ЗАЛІЗНИХ СПЛАВІВ В РОЗЧИНІ СУЛЬФАТНОЇ КИСЛОТИ РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ, ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ; ОЗНАЙОМЛЕННЯ НА ДОСЛІДІ З ЯВИЩЕМ КОРОЗІЇ; ВИВЧЕННЯ ВПЛИВУ ДОМІШОК НА ШВИДКІСТЬ КОРОЗІЇ МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ: Бюретка, крючки, воронка, штатив, склянка, зразки сплавів; 10% H2SO4. ПРАВИЛА ОХОРОНИ ПРАЦІ: Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом.
Корозією називається руйнування матеріалів в результаті хімічної і електрохімічної дії на них навколишнього середовища. По характеру процесів, що відбуваються, розділяють хімічну та електрохімічну корозію металів. При контакті металевої поверхні з електропроводним середовищем внаслідок різниці потенціалів окремих ділянків виникає багато короткозамкнених мікроскопічно малих гальванічних елементів. В кислому середовищі на катоді відновлюються іони гідрогену 2Н+ + 2е = Н2 Fe + H2SO4 = FeSO4 + H2
Швидкість корозії К, мл / см2 . хв, визначається по об'єму водню, що виділяється, на одиницю поверхні сплаву за одиницю часу за формулою: V К = ------ , S . де V – об'єм водню, що виділяється, мл; S – площа зразка, см2; . - час, хв.
На швидкість корозії впливають рН средовища, температура, рух рідини, склад і структура металу, обробка поверхні. Для зменшення втрат металу від корозії використовуються різні методи його захисту.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 09ТЗ |
Арк. |
|
|
|
|
|
|
35 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
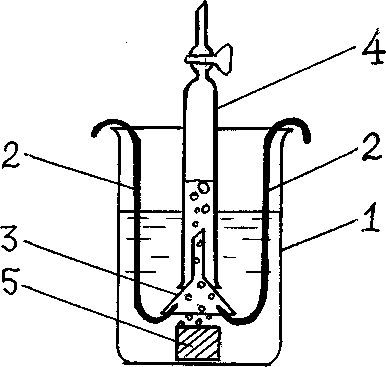
Зразок залізного сплаву старанно зачищається наждачним папірцем і знежирюється ватним тампоном, змоченим ацетоном. За допомогою лінійки вимірюється площа зразка. Зразок розташовується в склянці під воронкою, що тримається на двох гачках. Над воронкою за допомогою штативу закріплюється бюретка краником угору. Наливається в склянку вище початку бюретки розчин сульфатної кислоти, відкривається краник бюретки і засмоктується за допомоги груші кислота точно до помітки 0. Також можна наповнити бюретку до краю сульфатною кислотою і обережно перевернути бюретку на воронку. Якщо рівень в бюретці зупиниться на іншій помітці, ніж нуль, цю цифру прийняти за нульовий рівень.
Рисунок - Схема приладу для визначення швидкості корозії
Кількість водню, що виділяється, замірюється по об'єму сульфатної кислоти, що витискується з бюретки через кожні 5 хвилин протягом 40 хв.
Після проведення досліду проводиться розрахунок швидкості корозії для кожного часу та середня швидкість корозії як середньоарифметична величина.
Результати досліду оформлюються в таблиці.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 09ТЗ |
Арк. |
|
|
|
|
|
|
36 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
Таблиця – Результати роботи
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки. Розрахувати швидкість корозії. Побудувати графік залежності швидкості корозії від часу корозії К = f( По закінченню роботи зробити загальний висновок по роботі.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 09ТЗ |
Арк. |
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
37 |
||||||||||||||||||||||||||||||||||||||||||||||
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
|||||||||||||||||||||||||||||||||||||||||||||||
|
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
УМІТИ:
ЗАХИСТ РОБОТИ:
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Представити хімізм протікання корозії в кислому, лужному та нейтральному середовищах. Запропонувати способи запобігання корозії.
ЛІТЕРАТУРА
1 Ахметов Б.В., Новиченко Ю.П., Чапурин В.И. Физическая и коллоидная химия.- Л.: Химия, 1986. с 256 – 259 2 Балезин С.А. Практикум по физической и коллоидной химии.- М.: Просвещение, 1980. с 171 – 182 3 Гамеева О.С. Физическая и коллоидная химия.- М.: Высш. шк., 1974. с 283 – 285 4 Краткий справочник физико-химических величин. Под редакцией К.П.Мищенко, А.А.Равделя. Л.:Химия,1974.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 09ТЗ |
Арк. |
|
|
|
|
|
|
38 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ «ФІЗИЧНА ХІМІЯ»
ТЕМА: ДОБУВАННЯ КОЛОЇДНИХ РОЗЧИНІВ ТА ВИВЧЕННЯ ЇХ ВЛАСТИВОСТЕЙ.
РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ, ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ; ОЗНАЙОМЛЕННЯ НА ДОСЛІДІ З МЕТОДАМИ ОДЕРЖАННЯ КОЛОЇДНИХ РОЗЧИНІВ: КОНДЕНСАЦІЇ ТА ДИСПЕРГУВАННЯ; ВИВЧЕННЯ ВПЛИВУ СТАБІЛІЗАТОРІВ НА СТІЙКІСТЬ КОЛОЇДНИХ РОЗЧИНІВ; МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Колби, пипетки, бюретка, пробірки, мірний циліндр, паличка скляна, штатив, склянка, ступка, технічні ваги; розчин мила, 2% розчин каніфолі у етиловому спирті, насичений розчин сірки у етиловому спирті; олія, 2% FeCl3; 0,03H KI; 0,5H AgNO3; 0,1H AgNO3; 1H SnCl4; 1H NaOH; 0,1H HCl; 1% NH4OH; насичений розчин (NH4)2SO4; бура Nа2В4О7 ; K2SO4 0,00M; K3[Fe(CN)6] 0,0001M.
ПРАВИЛА ОХОРОНИ ПРАЦІ: Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом. З камфорою та бензолом працювати під тягою.
Виходячи з того, що колоїдні розчини займають за ступенем дисперсності частинок проміжне положення між грубодисперсними системами і молекулярно – дисперсними системами, то їх можна отримати двома принципово різними методами:
В двох методах необхідні стабілізатори – речовини, що утворюють захисні адсорбційні шари навкруги часток. Роль стабілізаторів можуть виконувати молекули або іони, що є продуктами взаємодії речовин дисперсної фази з дисперсійним середовищем або спеціальні добавки поверхнево – активних речовин.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 10ТЗ |
Арк. |
|
|
|
|
|
|
39 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1 Одержання золей методом конденсації
Дослід 1 Одержання гідрозолей сірки і каніфолі Насичений розчин сірки у етиловому спирті додають по краплям у дистильовану воду по краплям при збовтуванні. 5 – 10мл 2%розчину каніфолі у етиловому спирті додають по краплям при енергійному перемішуванні до 100мл дистильованої води. Відмітити спостереження.
Дослід 2 Одержання золю гідроксиду феруму (ІІІ) 100мл дистильованої води нагрівають до кипіння та додають по краплям 5 – 10мл розчину хлориду феруму (ІІІ). Реакція утворення феруму гідроксиду (ІІІ) відбувається за схемою: FeCl3 + 3H2O ---> Fe(OH)3 + 3HCl Fe(OH)3 + HCl ---> FeOCl + 2H2O FeOCl ---> FeO+ + Cl- Будову часток золю схематично зображається таким чином: n[Fe(OH)3] + m FeO+ + m Cl- ----> {[ n Fe(OH)3]. m FeO+ . (m – x) Cl-}+ х x Cl- Відмітити спостереження.
Дослід 3 Визначення порогу коагуляції золя гідроксиду феруму (ІІІ) Мінімальна концентрація електроліту, що викликає явну коагуляцію, називається порогом коагуляції. Порог коагуляції залежить від природи електроліту і ступеня окиснення коагулюючого йона. Порог коагуляції С пор, ммоль/л, розраховують за формулою С пор = 100 . С . V, де С – молярна концентрація електроліта, моль/л; V – найменший об’єм розчину електроліту, достатній для коагуляції золя, мл.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 10ТЗ |
Арк. |
|
|
|
|
|
|
40 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
В пробірки наливають по 5мл золя феруму гідроксиду (ІІІ) та вказаний в таблиці 1 об’єм дистильованої води і розчину електроліту. Потім вміст пробірок перемішують і через годину відмічають, в яких пробірках спостерігається явна коагуляція (помутніння) та седиментація.
Таблиця 1 – Таблиця вмісту реагентів
У випадку, коли в жодній з пробірок не відбудеться коагуляція, то дослід повторюють з більш (в 2 – 5 разів) концентрованими розчинами електролітів.
Обчислюється порог коагуляції для кожного електроліту та записуються результати в таблицю 2.
Таблиця 2 – Таблиця результатів
Дослід 4 Одержання золю йодиду аргентуму
В три колби додають по 2мл розчину йодиду калію КІ, потім повільно по краплям при інтенсивному перемішуванні додають в першу пробірку – 1,6мл, в другу – 1,8мл, в третю – 2,0мл розчину аргентум нітрату AgNO3. Відмітити спостереження. Відмітити в якій колбі утворюється золь, що має додатний та від'ємний заряди гранул. Написати формули будови міцелл золя аргентум йодиду.
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 10ТЗ |
Арк. |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
41 |
||||||||||||||||||||||||||||||||||
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
|||||||||||||||||||||||||||||||||||
|
Дослід 5 Отримання золю станатної кислоти пептизацією
У водних розчинах хлорид стануму (ІV) гідролізується: SnCl4 + 4Н2О = 4НСl + Sn(OH)4 Sn(OH)4 ---> H2SnO3 + Н2О Станатна кислота осаджується під дією лугів на розчини солей стануму (ІV): SnCl4 + 4NH4OH = H2SnO3 + 4NH4Cl + H2O Осад H2SnO3 під впливом кислоти або лугу (пептизаторів) здатен переходити в колоїдний розчин. Характерною особливістю пептизації є те, що кількість пептизатора у багато разів менше (нерідко у 1000 раз) кількості речовини, що пептизується. Станатна кислота розчиняється в кислотах і лугах: H2SnO3 + 4HCl = SnCl4 + 3H2O H2SnO3 + 2NaOH + H2O = Na2[Sn(OH)6] При додаванні NaOH до H2SnO3 утворюється натрій станнат H2SnO3 + 2NaOH = Na2SnO3 + 2Н2О В розчині Na2SnO3 дисоціює, утворюючи від’ємно заряджений іон SnO32-, який, адсорбуючись, надає агрегату Na2SnO3 від’ємний заряд – виникають міцели, осад переходить у золь. Пептизація станатної кислоти може відбуватися під дією кислот. В цьому випадку утворюється додатно заряджений золь: H2SnO3 + 2HCl = SnОCl2 + 2H2O nSnOCl <==> nSnO2+ + 2nCl –
До 100мл киплячої води додають по краплям розчин хлориду стануму (ІV) – утворюється осад станатної кислоти Н2SnО3. Осад промивається гарячою водою, декантується до зникнення хлорид – іонів (не утворюється осад при додаванні AgNO3 до промивної води). До промитого осаду додається декілька крапель NаOH, розчин сильно розбавляється водою та збовтується. До промитого осаду додається декілька крапель НС1, розчин сильно розбавляється водою та збовтується. Відмітити спостереження. Написати формулу міцелли золя, що має від’ємно та додатно заряджений заряд часточки.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 10ТЗ |
Арк. |
|
|
|
|
|
|
42 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки. По закінченню роботи зробити загальний висновок по роботі.
ПІСЛЯ ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ СТУДЕНТ ПОВИНЕН:
ЗНАТИ:
УМІТИ:
ЗАХИСТ РОБОТИ:
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Пояснити різницю між колоїдними, молекулярними розчинами та розчинами полімерів
ЛІТЕРАТУРА
1 Ахметов Б.В., Новиченко Ю.П., Чапурин В.И. Физическая и коллоидная химия.- Л.: Химия, 1986. с 203 – 206, 210, 213 – 215 2 Балезин С.А. Практикум по физической и коллоидной химии.- М.: Просвещение, 1980. с 268 – 304 3 Гамеева О.С. Физическая и коллоидная химия.- М.: Высш. шк., 1974. с 286 – 293, 313 – 331. 4 Краткий справочник физико-химических величин. Под редакцией К.П.Мищенко, А.А.Равделя. Л.:Химия,1974.
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 10ТЗ |
Арк. |
|
|
|
|
|
|
43 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||
|
ІНСТРУКЦІЙНА КАРТКА ДЛЯ ПРОВЕДЕННЯ ЛАБОРАТОРНОГО ЗАНЯТТЯ
З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ «ФІЗИЧНА ХІМІЯ»
ТЕМА: ВИВЧЕННЯ ВЛАСТИВОСТЕЙ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК РОБОЧЕ МІСЦЕ: ХІМІЧНІ ЛАБОРАТОРІЇ ХТК ТРИВАЛІСТЬ ЗАНЯТТЯ: 2 ГОДИНИ
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ: ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ, ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ; ОЗНАЙОМЛЕННЯ НА ДОСЛІДІ З ВЛАСТИВОСТЯМИ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК. МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Колби, пипетки, бюретка, пробірки, мірний циліндр, паличка скляна, штатив, склянка, ступка, технічні ваги; розчин мила, крохмаль, насичений розчин (NH4)2SO4; бура Nа2В4О7 ; K2SO4 0,00M; K3[Fe(CN)6] 0,0001M; желатин; 1М розчини K2SO4, СН3СООН, КС1, КІ; бензен.
ПРАВИЛА ОХОРОНИ ПРАЦІ: Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом. З камфорою та бензолом працювати під тягою.
Високомолекулярні сполуки (ВМС)– речовини, що мають молекулярну масу від декількох тисяч до декількох мілліонів атомних одиниць мас. Особливостю ВМС (порівняно з золями) є тісна взаємодія їх частинок з розчинником, що виражається терміном ліофільність (для розчинника вода – гідрофільність). Емульсіями називаються дисперсні системи з двох рідин, що не змішуються. Радіус зважених крапель рідин в емульсіях знаходиться в межах 10 -3 – 10 -5 см. Для утворення емульсій беруть рідини, що сильно відрізняються за типом внутришньомолекулярного зв'язку. Одна з них повинна бути полярною рідиною (частіше вода), а друга – неполярною або малополярною. Ліофільні золі (колоїдні часточки сильно взаємодіють з середовищем) отримують шляхом розчинення високомолекулярних сполук у відповідних розчинниках. Ліофільні золі, що є розчинами ВМС, мають значно більшу стійкість порівняно з ліофобними золями, тому вони можуть бути отримані в порівняно високих концентраціях, і відповідно, мають велику в’язкість та осмотичний тиск. Підвищення концентрації ліофільних розчинів призводить до утворення твердої нерозчиненої речовини – переходу у гель.
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
Одержання гідрофільних золей
|
||||||
|
|
|
|
|
|
Т 07. 5.05130105. . 11ТЗ |
Арк. |
|
|
|
|
|
|
44 |
|
|
Змін. |
Арк. |
№ докум. |
Підп. |
Дата |
||