
Genetics_sivolob_et_al
.pdf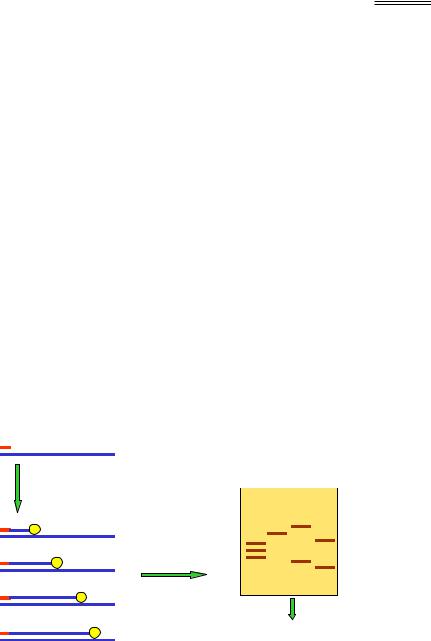
 Розділ 9. Генетична інженерія та методи молекулярної генетики
Розділ 9. Генетична інженерія та методи молекулярної генетики
АНАЛІЗ СТРУКТУРИ Й ЕКСПРЕСІЇ ГЕНІВ І ГЕНОМІВ
Клонований або ампліфікований фрагмент ДНК можна дослідити різними способами, але найбільш вичерпну інформацію дає встановлення нуклеотидної послідовності (sequence) фрагмента – секвенування.
На рис. 9.6 показано схему найпопулярнішого сьогодні методу Сангера (Frederick Sanger). До одноланцюгової ДНК-матриці додається радіоактивно мічений праймер, повний набір дезоксинуклеозидтрифосфатів (dNTP), ДНК-полімераза й невелика кількість дидезоксинуклеозидтрифосфату одного з чотирьох типів (наприклад, ddATP). Дидезоксинуклеотид відрізняється тим, що містить атом Н замість ОН-групи не тільки при 2'-, а також і при 3'-атомі пентози (див. рис. 1.1). Відповідно, включення такого нуклеотиду в ланцюг, що синтезується, зупинить подальше зростання ланцюга внаслідок відсутності 3' ОН-групи на його кінці. Оскільки ddATP присутній у невеликій кількості, така подія буде відбуватися в різних точках ланцюга – в усіх, де стоїть аденін напроти тиміну в складі матриці. Денатурація продуктів реакції дасть набір мічених одноланцюгових фрагментів від праймера до кінцевого аденіну, довжина цих фрагментів у нуклеотидах дасть порядковий номер аденіну в складі ланцюга.
праймер
5' 
ДНК-полімераза + |
A G T C |
||||
dATP, dTTP, dCTP, dGTP + |
|||||
невелика кількість ddATP |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А
А
АДенатурація, гель-електрофорез
А |
CTAAACGTGA |
Рис. 9.6. Секвенування ДНК за Сангером: схема синтезу ДНК у присутності дидезоксиАТР (ліворуч). Аналогічна процедура для інших
трьох дидезоксинуклеотидів дає набір одноланцюгових фрагментів, що аналізуються за допомогою гель-електрофорезу в денатуруючих умовах (праворуч) – розподіл смуг дозволяє прочитати послідовність (праворуч внизу)
281

Генетика
З метою визначення довжини фрагментів проводять гель-електро- форез одноланцюгової ДНК у денатуруючих умовах, на сусідні лунки геля наносять також продукти синтезу в присутності інших дидезоксинуклеотидів. Як показано на рис. 9.6, після електрофорезу та візуалізації смуг із такого геля можна прочитати нуклеотидну послідовність.
Інший сучасний підхід у секвенуванні (так зване піросеквенування), який реалізується на автоматизованих секвенаторах, дозволяє встановити послідовність значно швидше, дешевше й при цьому не потребує ані клонування ДНК, ані електрофорезу. Одноланцюгові фрагменти, отримані з невеликої кількості геномної ДНК, пришиваються своїми 5'-кінцями до мікрокульок (один фрагмент на кульку) і піддаються ампліфікації за допомогою ПЛР. Кожна кулька з пришитими до неї ампліфікованими ідентичними фрагментами розміщується в мікрореакторі, де здійснюється ДНК-полімеразна реакція. Нуклеозидтрифосфати подаються в реакційну суміш імпульсно один за одним. Якщо нуклеотид певного типу виявляється комплементарним матриці та включається у зростаючий ланцюг, пірофосфат, що при цьому звільняється, залучається до низки хімічних реакцій, де остання реакція супроводжується випромінюванням світла (хемілюмінесценція). Світловий сигнал фіксується оптичною системою, і послідовність таких сигналів читається як нуклеотидна послідовність. Реакція здійснюється паралельно у 200 тис. мікрореакторів (для 200 тис. фрагментів, які перекриваються), що дозволяє встановити послідовність приблизно 200 млн пар основ за 4,5 години.
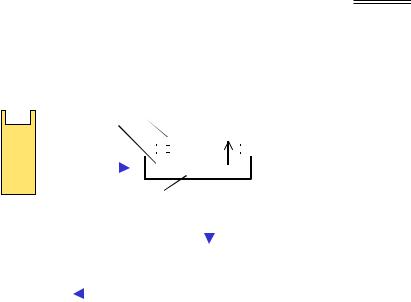
Зрозуміло, що далеко не завжди є потреба у визначенні послідовності ДНК, із якою має справу дослідник. Потужним засобом аналізу складних сумішей ДНК щодо наявності там специфічних елементів послідовності є блот-гібридизація на нітроцелюлозних фільтрах за Саузерном (Edward Southern). Назва процедури, яку схематично зображено на рис. 9.7, походить від слова blotting (промакування): фрагменти ДНК розділюються за допомогою гель-електрофорезу (залишаючись невидимими в гелі), після чого на гель накладають нітроцелюлозний фільтр, а під та над цим "сендвічем" розміщують фільтрувальний папір і занурюють нижній шар паперу в лужний розчин. Під дією капілярних сил розчин піднімається до верхнього шару паперу, "захоплюючи" при цьому ДНК і переносячи її з гелю на нітроцелюлозу. Одночасно при цьому ДНК денатурується лугом. У результаті одноланцюгова ДНК опиняється на фільтрі – середовищі, придатному для подальшої гібридизації, а сам фільтр є точною реплікою вихідного гелю. Далі проводять обробку фільтра зондом – одноланцюговим фрагментом
282
 Розділ 9. Генетична інженерія та методи молекулярної генетики
Розділ 9. Генетична інженерія та методи молекулярної генетики
ДНК певної послідовності, який містить радіоактивну мітку. Зонд гібридизується з комплементарною ДНК у певних досі невидимих смугах, що можна зафіксувати за допомогою авторадіографії.
|
|
|
|
Фільтрувальний |
||||||||||||
|
|
|
|
папір |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Блотинг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гель після |
Лужний розчин |
|||||||||||||||
електрофорезу |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Обробка зондом |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Авторадіограма |
Нітроцелюлозний |
|
фільтр |
Рис. 9.7. Блот-гібридизація
У такий спосіб можна встановити, наприклад, присутність специфічних послідовностей ДНК у препаратах; наявність у геномі додаткових копій послідовності, що є гомологічними до вже відомої; присутність у невивченому геномі генів, гомологічних відомим генам тощо. Прикладом одного з численних застосувань Саузерн-блотингу є метод фингерпринтингу ДНК (DNA fingerprinting). Метод базується на факті наявності в еукаріотичних геномах мінісателітних повторів – невеликих елементів послідовності, які тандемно повторюються в різних місцях геному кілька разів. Розподіл локусів за кількістю повторів є індивідуальним – так само, як відбитки пальців. З метою ідентифікації особини (чи особи – у криміналістиці, судових справах тощо) геномну ДНК обробляють рестриктазою, котра не має своїх сайтів усередині повтору. Фрагменти розділюються шляхом електрофорезу, здійснюється блотинг і гібридизація з радіоактивно міченим елементом послідовності мінісателіта. У результаті на авторадіограмі представлено специфічний для особини набір фрагментів різної довжини, тобто різної кількості повторів мінісателіта – своєрідний молекулярний відбиток (DNA fingerprint).
283

Генетика
Нозерн-блотинг відрізняється від описаної процедури блотингу за Саузерном (назва nothern є просто жартівливою аналогією з буквальним значенням прізвища Саузерна) лише тим, що на гель для електрофорезу наноситься сумарний препарат виділеної мРНК. Гібридизація з міченим фрагментом ДНК (наприклад, кДНК із бібліотеки клонів) дозволяє встановити наявність певної мРНК, тобто активність гена, у клітинах певного типу після дії активуючих / репресуючих факторів тощо, а також оцінити рівень цієї активності (концентрацію мРНК) за інтенсивністю забарвлення смуги на авторадіограмі.
Проаналізувати повну програму активності генів організму чи клітин певного типу за певних фізіологічних умов або у процесі розвитку, а також виконувати інші завдання, пов'язані з вивченням функціонування цілого геному, дозволяють методи, що базуються на використанні ДНК-мікроареїв (DNA-microarrays) або ДНК-
чіпів (DNA-microchips).
Фрагмент ДНК довжиною до 1 тис. пар основ, для якого відомо його розташування в геномі, ампліфікується, і одноланцюгові продукти ампліфікації пришиваються до невеликої зони на поверхні предметного скла мікроскопа. Скло розміром 2 × 2 см – ДНК-мікроарей – покрито сіткою із приблизно 6 тис. таких мікроплям, кожна з яких містить ДНК певної геномної ділянки.
Сумарна мРНК
Зворотна транскриптаза + флуоресцентний аналог
NTP
кДНК
ДНК-мікроарей
Рис. 9.8. Аналіз сумарної мРНК за допомогою ДНК-мікроарея
284

 Розділ 9. Генетична інженерія та методи молекулярної генетики
Розділ 9. Генетична інженерія та методи молекулярної генетики
Одну з типових схем використання мікроарея зображено на рис. 9.8. Сумарна мРНК, отримана з клітин певного типу, використовується як матриця в реакції зворотної транскрипції. Поряд зі звичайними, до реакційної суміші додається флуоресцентний аналог одного з NTP. У результаті маємо препарат флуоресцентно міченої кДНК. Після гібридизації з цією кДНК мікроарей аналізують за допомогою флуоресцентного мікроскопа: наявність флуоресцентної плями свідчить про активність певного гена, інтенсивність флуоресценції – про рівень цієї активності.
Експерименти такого типу дозволяють з'ясувати зміни загальної програми експресії генів при змінах зовнішніх умов, активність різних генів у різних тканинах багатоклітинного організму, зміни активності груп генів у процесі диференціювання клітин.
ЕКСПРЕСІЯ РЕКОМБІНАНТНИХ БІЛКІВ
Методи генної інженерії дозволяють не тільки здійснювати різноманітні операції з нуклеїновими кислотами, а й отримувати практично будь-які білки у великих кількостях. Ген, що кодує даний білок, можна клонувати, вбудувати (наприклад, у бактеріальну плазміду) і змусити бактеріальну культуру продукувати цей білок. Виділення та очищення білка з культури біохімічними методами не є принциповою проблемою, зважаючи на його велику кількість.
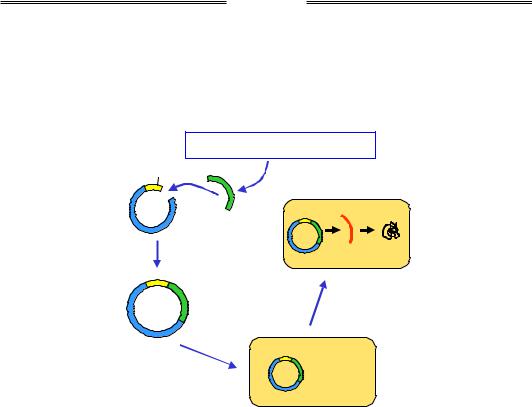
Одну з найпростіших схем експресії білка в E. сoli зображено на рис. 9.9. Зрозуміло, що еукаріотичний ген не має сенсу вводити у прокаріотичну клітину – прокаріоти не мають системи сплайсингу. Тому беруть лише кодуючу частину гена, яку можна отримати з бібліотеки клонів кДНК. Використовуючи придатну рестриктазу та лігазу, потрібну кДНК вбудовують у плазмідний вектор для експресії поряд із промотором – наприклад, лактозного оперона (див. розділ 2). Здійснюють трансформацію рекомбінантної плазміди в бактеріальні клітини, до бактеріальної культури додають синтетичний індуктор lac-оперона IPTG. Промотор активується, після чого здійснюється транскрипція гена та трансляція білка.
Більш ефективна двоступенева система експресії використовує промотор РНК-полімерази бактеріофага Т7. У бактеріальному геномі ані таких полімераз, ані відповідних промоторів немає. У клітину
285
Генетика
вводяться два плазмідні вектори: один містить lac-промотор і ген РНК-полімерази Т7, інший – сильний промотор полімерази Т7 разом із геном білка, що має бути експресований. IPTG індукує експресію полімерази, яка зв'язується тільки з промотором у складі другої плазміди (інших промоторів немає) і забезпечує синтез великої кількості білка.
Бібліотека клонів кДНК
lac промотор
мРНК білок
Плазмідний
вектор
+ IPTG
Трансформація
Рис. 9.9. Експресія білка в бактеріальній клітині. lac-Промотор – промотор лактозного оперона, IPTG – синтетичний індуктор lac-оперона
Велика кількість білків, у тому числі ферменти, що використовуються у рекомбінантних технологіях, виробляються сьогодні шляхом експресії в бактеріальних клітинах. Поряд із прокаріотичними розробляються та використовуються також системи експресії рекомбінантних білків в еукаріотичних клітинах. Особливо важливими еукаріотичні системи експресії є для еукаріотичних білків, що не можуть бути синтезовані бактеріальною клітиною в активній формі. Зокрема, це стосується білків, що піддаються суттєвим посттрансляційним модифікаціям – наприклад, глікопротеїдів. Найпростішим для використання еукаріотичним "біореактором" є дріжджі, маніпулювати якими так само легко й так само дешево, як і бактеріями. Як дріжджові експресуючі вектори використовують плазміди або штучні хромосоми YAC.
286
 Розділ 9. Генетична інженерія та методи молекулярної генетики
Розділ 9. Генетична інженерія та методи молекулярної генетики
Плазміда
Клонований ген
Гомологічні |
Рекомбінація |
ділянки |
Хромосомна ДНК
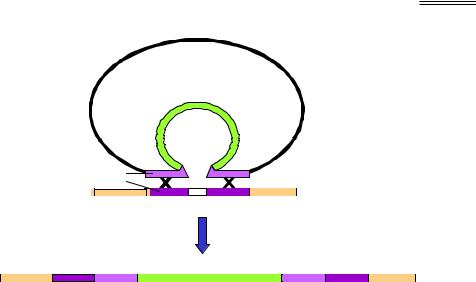
Рис. 9.10. Інтеграція гена у хромосомну ДНК
Крім того, часто буває доцільним вбудовування гена-мішені, що кодує бажаний білок, у хромосому клітини-хазяїна: клітина позбавляється при цьому зайвих витрат на реплікацію плазміди та синтез зайвих білків, гени яких несе плазміда. Здійснити інтеграцію можна за рахунок гомологічної рекомбінації між геномною ДНК і ділянками, що фланкують ген-мішень у плазміді (рис. 9.10).
ГЕНЕТИЧНА ІНЖЕНЕРІЯ МІКРОБІОЛОГІЧНИХ СИСТЕМ
Генетично модифіковані мікрооорганізми використовуються зде-
більшого як біореактори, що продукують білки для потреб медицини.
Восновному це невеликі білки, що не піддаються посттрансляційним модифікаціям. Одним із перших промислових застосувань генетичної інженерії було отримання шляхом експресії у клітинах E. coli (за принциповою схемою рис. 9.9) гормону росту людини – соматотропіну.
Ворганізмі він секретується передньою часткою гіпофіза, а його дефіцит є причиною захворювання – гіпофізарної карликовості.
287

Генетика
Отримання соматостатину являє собою цікавий приклад цілеспрямованого конструювання білків за допомогою методів генної інженерії. Це короткий пептид (містить 14 амінокислотних залишків), який синтезується у шлунково-кишковому тракті й гальмує вивільнення з гіпофізу гормону росту. Отримати соматостатин у клітинах бактерій у значних кількостях є складним завданням, оскільки він швидко руйнується протеолітичними ферментами. Щоб "обійти" внутрішньоклітинні бактеріальні протеази, було сконструйовано химерний білок-попередник. У його складі як N-кінцеву ділянку було використано білок бактерії, до якого приєднали сам соматостатин: звичайно, усе це було зроблено на рівні ДНК, зв'язувальним елементом у цій конструкції було використано триплет АТG, що кодує метіонін. Після виділення з клітин бактерій химерний білок обробляли бромціаном, унаслідок чого відбувалось його розщеплення за залишком метіоніну, і таким чином вилучався фізіологічно активний поліпептид. За аналогічною схемою було розроблено процес отримання інсуліну.
Шляхом експресії в E. coli отримують також інтерферони всіх трьох груп: α-, β- та γ-інтерферони – антивірусні білки, які синтезуються імунокомпетентними клітинами. Проте недоліком використання бактеріальних клітин для отримання β- і γ-інтерферонів (природні інтерферони цих двох груп – глікопротеїди) є відсутність у бактерій систем, що забезпечують посттрансляційні модифікації білків. Роль глікозилювання β- і γ-інтерферонів не до кінця зрозуміла і, хоча неглікозильовані форми цих білків практично повністю зберігають противірусну активність, це спонукає до розробки й використання систем експресії рекомбінантних інтерферонів в еукаріотичних клітинах.
Важливе місце в генетичній інженерії мікроорганізмів посідає виробництво рекомбінантних вакцин. Вони мають цілий ряд переваг перед традиційними вакцинами: характеризуються відсутністю (або значним зниженням вмісту) баластних компонентів, майже повною нешкідливістю та низькою вартістю. Можна назвати три основні підходи, які використовують для отримання таких вакцин:
•Модифікація мікроорганізму шляхом делеції генів, що відповідають за вірулентність. При цьому зберігається здатність викликати імунну відповідь, і мікроорганізм можна використовувати як живу вакцину.
•Перенесення антигенних детермінант патогенного мікроорганізму на непатогенний, який можна використовувати як вакцину.
288

 Розділ 9. Генетична інженерія та методи молекулярної генетики
Розділ 9. Генетична інженерія та методи молекулярної генетики
•Клонування та експресія генів білків, котрі містять анигенні детермінанти. Білки використовують як вакцину, що провокує імунну відповідь.
Велике значення має використання мікроорганізмів для промисло-
вого виробництва органічних сполук. У такому виробництві, крім кла-
сичних технологій, усе ширше використовують технологію рекомбінантних ДНК, яка дозволяє спрямовано змінювати метаболізм мікроорганізмів, уводячи нові гени або модифікуючи такі, що вже існують. Прикладами є використання рекомбінантних мікроорганізмів для промислового синтезу L-аскорбінової кислоти (вітаміну С), барвника індиго, антибіотиків, цінних біополімерів тощо.
Мікроорганізми можуть приносити користь не тільки завдяки якомусь певному продукту, який ними синтезується, а й своєю дією на довкілля. Зокрема, бактерії можна використовувати для деградації ксенобіотиків (неприродних синтетичних хімічних речовин – гербіцидів, пестицидів, холодоагентів, хімічних відходів). Головну групу ґрунтових мікроорганізмів, що руйнують ксенобіотики, становлять бактерії роду Pseudomonas. Різні штами Pseudomonas здатні розщеплювати понад 100 органічних сполук, але кожен окремий штам використовує як джерело вуглецю тільки певну групу споріднених сполук і не використовує інших. Шляхом перенесення плазмід, які кодують ферменти різних катаболічних шляхів, в один реципієнтний штам було створено "супербацилу", що має надзвичайні катаболічні властивості – вона здатна руйнувати більшість вуглеводнів нафти. Тепер генетично модифіковані штами природних ґрунтових мікроорганізмів використовуються для комплексної біологічного очищення стічних вод.
ГЕНЕТИЧНА ІНЖЕНЕРІЯ РОСЛИН
Одна з переваг рослинних клітин – їхня тотипотентність: з однієї клітини можна регенерувати цілу рослину. Отже, із клітин, сконструйованих генно-інженерними методами, можна отримати рослини, усі клітини яких несуть чужорідний ген чи гени. Часто такі трансгенні рослини, створені de novo, розмножують вегетативно. Генетична модифікація рослин може здійснюватись за допомогою спеціальних векторів або шляхом прямого перенесення генів.
289

Генетика
Поширеним методом уведення генів у рослинні геноми є використання ґрунтової бактерії Agrobacterium tumefaciens. Агробактерії мають здатність інтегрувати свій генетичний матеріал у клітини дводольних рослин. Вони містять великі (близько 200 тис. пар основ) Ті-плазміди (tumor inducing), які несуть так звану Т-ДНК – ділянку, здатну інтегруватися в ядерний геном рослинної клітини. До складу Т-ДНК входять гени фітогормонів, продукти експресії яких індукують у трансформованих рослин утворення пухлин – корончастих галів. Гени, що відповідають за перенесення та інтеграцію Т-ДНК у геном рослин (vir-гени), знаходяться в іншій ділянці Ті-плазміди. Трансгенні рослини отримують, використовуючи модифіковану Т- ДНК, в якій онкогени замінені на будь-який ген, котрий бажано інтегрувати в рослинний геном. Таку неонкогенну плазміду конструюють генно-інженерними методами, клонують в E. coli, а потім вектор уводять в A. tumefaciens: vir-гени забезпечують перенесення та інтеграцію бажаної ділянки. За допомогою агробактерій трансформовано велику кількість видів дводольних рослин, однак модифікація однодольних рослин (головні зернові культури – рис, пшениця та кукурудза) таким шляхом ускладнена.
Безвекторні системи дають можливість прямого перенесення чужорідної ДНК у будь-які рослинні клітини або протопласти (клітини, в яких відсутня клітинна стінка). При безвекторному перенесенні використовують методи електропорації, мікроін'єкції та біолістичний метод. Мікроін'єкцію проводять під мікроскопом за допомогою скляної голки, уводячи через неї ДНК у ядро клітини. Бомбардування клітин (біолістика) – інший дуже ефективний метод уведення ДНК у рослинну клітину. При цьому золоті або вольфрамові сферичні кульки діаметром 0,4–1,2 мкм покривають шаром ДНК, яку осаджують CaCl2, спермідином або поліетиленгліколем, і "вистрілюють" кульками в суспензію клітин зі спеціальної "рушниці". Кульки пробивають клітинну стінку, за рахунок чого ДНК потрапляє всередину клітини та з певною імовірністю інтегрується в рослинну ДНК за допомогою не зовсім зрозумілого механізму. Пряме введення ДНК у протопласти рослин можна здійснити й за допомогою ліпосом – сферичних частинок, мембрани яких містять фосфоліпіди. Частинки обволікають трансформуючу ДНК і тим самим захищають її від нуклеаз. За допомогою ліпосом у протопласти рослин вдається ввести ДНК Ті-плазмід, а також цілі хромосоми.
290
