
- •Билет №3
- •Билет №4
- •Билет №5
- •Билет №6
- •Билет №7
- •Билет №8
- •Тимоловая проба
- •Билет №11
- •Высаливание белков
- •Исследование денатурации белков
- •Билет №12
- •Билет №13
- •Биуретовая реакция
- •Ксантопротеиновая реакция
- •Реакция Миллона
- •Билет №14
- •Тимоловая проба
- •Билет №15
- •Влияние активаторов и ингибиторов на активность амилазы
- •Билет №16
- •Билет №17
- •Билет №18
Исследование денатурации белков
Денатурация белков - это изменение структурной организации оелковой молекулы (третичной, четвертичной и даже вторичной структуры), приводящее к изменению физико-химических и биологических свойств белка. Денатурирующие факторы делятся на химические (кислоты, тяжелые металлы), физические (ультразвук, высокая и низкая температура), биологические (протеолитические ферменты - трипсин).
Реактивы 1) 1% и 10% СН3СООН, 2) ацетон, 3) 10% ТХУ, 4) конц. HN03, 5) 1% CuS04, 6) конц. H2S04, 7) 5% Pb(CH3COO)2, 8) танин, 9) суль-фосалициловая кислота, 10) 10% NaOH, 11) насыщенный раствор NaCL.
Материалы исследования Сыворотка крови, яичный белок.
Принцип Денатурация снижает гидрофильность белков и устойчивость их в растворе.
Исследование химической денатурации
Проведение анализа
В ряд пронумерованных пробирок вносят по 5 капель 1% ра-ii вора яичного белка и добавляют реактивы, пользуясь указаниями таблицы (см. ниже). Необратимость осаждения белка устанавливают добавлением к осадку 10-20 капель дистиллированной ноды.
Практическое значение
Реакции химической денатурации используют для осаждения белка в биологическом материале с целью дальнейшего определения в фильтрате низкомолекулярных веществ; для выявления присутствия белка в различных физиологических жидкостях и количественного анализа; для связывания солей тяжелых металлов при лечении отравлений и для профилактики их на производстве; для обезвреживания отходов в санитарной практике; для дезинфекции кожи, слизистых покровов.
Исследование денатурации белков при нагревании в различных средах
Проведение анализа
В пять пронумерованных пробирок наливают по 10 капель ра-пюра яичного белка.
1 к) пробу нагревают и наблюдают помутнение раствора. •*£
Во 2-ю пробу добавляют 2 капли 1% СН3СООН (слабокислая среда). Нагревают, наблюдают сначала помутнение, а при дальнейшем нагревании - белый хлопьевидный осадок. Белок теряет заряд, приближается к изоэлектрическому состоянию.
В 1-ю пробу добавляют 2 капли 10% СН3СООН (сильнокислая среда). Нагревают. Осадок при этом не образуется, так как частицы белка перезаряжаются и приобретают положительный заряд. -
В 4-ю пробу добавляют 2 капли 10% СН3СООН и 1 каплю насыщенного раствора NaCI (сильнокислая среда + электролит). Нагревают. Выпадает осадок белка, так как происходит нейтрализация заряда на частицах белка.
И 5-ю пробу добавляют 2 капли 10% раствора NaOH (щелочная среда). Нагревают. Осадок не образуется, так как положительный заряд на частицах белка усиливается.
Билет №12
1)
Ф И З И К О - Х И М И Ч Е С К И Е С В О Й С Т В А Б Е Л К О В
К свойствам белков относят амфотерность, растворимость, способность к де-
натурации, коллоидные свойства.
А М Ф О Т Е Р Н О С Т Ь
Белки содержат кислые (СООН) и основные (NH2) группы. Благодаря этому они
обладают буферными свойствами. Однако при физиологических рН их буферная
емкость ограничена. Только гемоглобин, который содержит до 8% гистидина обла-
дает существенной буферной емкостью, т.к. рI гистидина 7,6. Амфотерность позво-
ляет разделить белки по заряду. Аналогично аминокислотам, они заряжаются поло-
жительно при уменьшении рН, и отрицательно при его увеличении. При нейтраль-
ных рН заряд белка зависит от соотношения кислых и основных аминокислот. Если
преобладают кислые – то и заряд отрицательный, если основные – положительный,
при рI заряд равен 0.
Р А С Т В О Р И М О С Т Ь
Так как белки несут много заряженных групп, то они водорастворимы. Раство-
римость связана:
• со взаимоотталкиванием молекул
• с гидратацией белков – чем больше полярных аминокислот, тем больше
гидратная оболочка (на 100 г белка может быть 30-50 г воды)
Таким образом, растворимость белков зависит от заряда и наличия гидратной
оболочки. Исчезновение одного или обоих этих факторов ведет к осаждению бел-
ков.
Методы осаждения белков
1. Высаливание — добавление солевых растворов (Na2SO4, (NH4)2SO4).
Анионы и катионы соли взаимодействуют с зарядами белка и, в результате, за-
ряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновре-
менно пропадает гидратная оболочка. Это ведет к «слипанию» молекул и осажде-
нию. Так как белки плазмы крови отличаются по размерам, заряду, строению, то
можно подобрать такие количества соли, которые вызовут осаждение менее устой-
чивых белков, пока другие еще будут растворены.
Например, таким способом можно определять соотношение аль-
бумины/глобулины. Альбумины, как более полярные молекулы, ос-
таются в растворенном u1089 состоянии при 50% насыщении раствора
нейтральными солями, в то время как глобулины в этих условиях
уже осаждаются. В норме соотношение равно 1,5-2,3.
19
Однако, не следует забывать, что при низких концентрациях соли способны
взаимодействовать с ионными группами белков, отвечающих за внутримолекуляр-
ные взаимодействия, приводить к их раскрытию и повышать растворимость.
2. Осаждение водоотнимающими средствами (ацетон, этанол)
При этом происходит лишение белка гидратной оболочки, но не заряда, рас-
творимость несколько снижается, но денатурации не наступает
Например, антисептическое действие этанола.
3. Изменение рН ведет к исчезновению заряда в изоэлектрической точке, исчез-
новению гидратной оболочки и снижению растворимости белков.
Д Е Н А Т У Р А Ц И Я
Это разрыв связей, стабилизирующих четвертичную, третичную, вторичную
структуры.
1. Физическая: повышение температуры, ультрафиолетовое и микроволновое
излучение, механические воздействия, ионизация заряженными частицами.
2. Химическая:
• Кислоты и щелочи образуют водородные связи с пептидными группами
• Органические растворители образуют водородные связи и вызывают дегид-
ратацию
• Алкалоиды и тяжелые металлы образуют связи с полярными группами и раз-
рывают систему водородных и ионных связей.
К О Л Л О И Д Н Ы Е С В О Й С Т В А:
1. Рассеивание луча света, проходящего через белковый раствор – эффект Тин-
даля (светящийся конус)
2. Малая скорость диффузии
3. Неспособность проникать через полунепроницаемые мембраны
Например, работа искусственной почки, диализ.
4. Создание онкотического давления, то есть перемещение воды в сторону более
высокой концентрации белка.
Например, формирование отеков.
5. Высокая вязкость – силы сцепления между молекулами.
Например, образование гелей и студней.
2)
Суточная потребность
400 мкг
Источники
Растительная пища, дрожжи, мясо, печень, желток яиц.
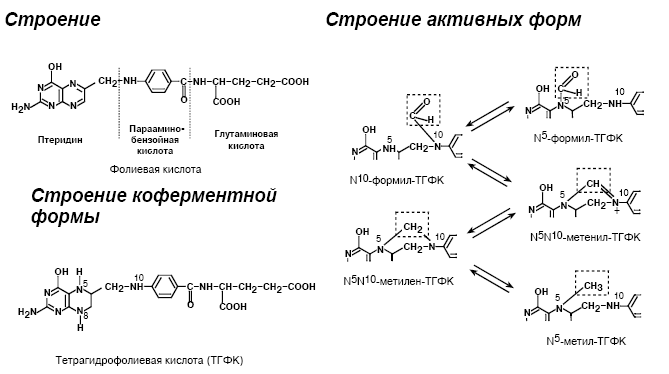
Биохимические функции
Перенос одноуглеродных фрагментов
• формила – N5-Формил-ТГФК и N10-Формил-ТГФК
• метенила – N5,N10-метенил-ТГФК
• метилена – N5,N10-метилен-ТГФК
• метил – N5-метил-ТГФК
• формимин – N5-Формимин-ТГФК
1. Участие в синтезе пуриновых и пиримидиновых оснований
2. Участие в обмене аминокислот: обратимое превращение глицина и серина,
синтез метионина из гомоцистеина.
Гиповитаминоз
Мегалобластическая анемия– нарушение синтеза пуринов и дТТФ, что влечет
снижение синтеза ДНК и скорости деления клеток. Клетки не теряют способности
расти, но не делятся.
Лейкопения – по той же причине.
Поражение слизистых: гастриты, энтериты, конъюктивит, глоссит.
Замедление роста, ухудшение заживления ран, иммунодефициты.
3)
