
- •1.Представление о пространственном и электронном строении молекул органических веществ. Понятие карбкатион, карбанион, радикал; факторы, влияющие на их стабильность.
- •2.Номенклатура органических соединений: систематическая (iupac), радикально-функциональная, тривиальные названия. Основные принципы номенклатуры iupac.
- •5.Алканы, нахождение в природе. Основные направления переработки и использования алканов.
- •6.Алканы. Химические свойства: галогенирование (механизм), нитрование, окисление, сульфохлорирование, сульфоокисление.
- •Iupac рекомендует называть геометрические изомеры по следующей номенклатуре:
- •Реакция Коупа
- •8. Химические свойства алкенов: реакции электрофильного присоединения (галогенирование, гидрогалогенирование, гидратация), их механизм. Правило Марковникова и его объяснение.
- •9.Стереохимия реакций присоединения к двойной связи алкенов (на примере бронирования циклогексена, цис- и транс-алкенов).
- •10. Реакции радикального присоединения к двойным связям алкенов (присоединение по Карашу). Механизм, объяснение региоселективности.
- •11. Реакции аллильного замещения в алкенах. Аллильный радикал, его строение и причина повышенной стабильности.
- •12. Реакции окисления алкенов. Озонолиз, эпоксидирование, реакция Прилежаева, гидроксилирование. Окисление алкенов, катализируемое солями палладия(II)
2.Номенклатура органических соединений: систематическая (iupac), радикально-функциональная, тривиальные названия. Основные принципы номенклатуры iupac.
Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению.
В настоящее время общепринятой является систематическая номенклатура ИЮПАК.
В1919 г. с целью стандартизации химической номенклатуры, химических терминов, атомных масс, способов проведения эксперимента и предоставления полученных результатов был организован Международный союз по теоретической и прикладной химии – ИЮПАК. Съезды ИЮПАК в 1957 и 1965 гг. рекомендовали разработанную ею номенклатуру к использованию, и она стала называться номенклатурой ИЮПАК. Правила этой номенклатуры выходили в разные годы отдельными изданиями, а в 1979 г. были собраны в «Голубой книге», которая представляет собой наиболее полный свод современных правил номенклатуры органических соединений.
Система принципов и правил такой номенклатуры носит название «систематическая номенклатура». В номенклатуре ИЮПАК подчёркивается, что правила систематической номенклатуры не обязательно дают уникальное название для каждого соединения (то есть могут существовать разные названия одного вещества, не противоречащие правилам ИЮПАК), но эти названия всегда будут однозначными (одному названию будет соответствовать только одно вещество). Противоположностью систематических названий являются традиционные, полусистематические или тривиальные названия, которые широко используются для распространённых соединений (например, «уксусная кислота», «глицин» и т. п.). Номенклатура ИЮПАК допускает использование таких названий, особенно в устной речи, однако постепенно стремится сократить их число
Однако в органической химии сохраняются и тривиальные (обыденные) названия использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях, как правило, отражались природные источники и способы получения, особо заметные свойства и области применения.
Например, - лактоза (молочный сахар) выделена из молока (от лат. lactum – молоко);
- пальмитиновая кислота – из пальмового масла; - пировиноградная кислота получена при пиролизе виноградной кислоты;- глицерин назван (отражен) за его сладкий
Тривиальные названия особенно распространены среди природных соединений – аминокислот, углеводов, алкалоидов, стероидов. Употребление некоторых укоренившихся тривиальных названий (уксусная кислота, толуол, бензойная кислота, и др.) разрешено правилами ИЮПАК.
Заместительная номенклатура
В основе заместительной номенклатуры лежит выбор родоначальной структуры.
Название строят как сложное слово, состоящее из корня, (название родоначальной структуры; суффиксов, отражающих степень насыщенности (наличие двойных или тройных связей); перфиксов и суффиксов, обозначающих число, характер и местонахождение заместителей.
Составление названия органического соединения по заместительной номенклатуре производят в описанной ниже последовательности.
1. Определяют старшую характеристическую группу (если она присутствует) и родоначальную структуру соединения.
В качестве родоначальной структуры используют главную цепь атомов углерода в ациклических соединениях и основную циклическую структуру в карбоциклических и гетероциклических соединениях.
2. Нумеруют атомы родоначальной структуры с условием, чтобы старшая хакактеристическая группа получила наименьший номер. Если это правило не позволяет выбрать однозначно направление нумерации, то цепь (или цикл) нумеруют так, чтобы заместители получили наименьшие номера. В гетероцикле начало нумеации определяет гетероатом.
3. Называют родоначальную структуру, обозначая старшую характеристическую группусуфиксом. Степень насыщенности родоначальной структуры отражают в её названии суффиксами: -ан в случае насыщенного углеродного скелета;
-ен - при наличии двойной связи; -ин – при наличии тройной связи.
4. Называют заместители, обозначаемые перфиксами, в едином алфавитном порядке. Положение каждого заместителя и каждой кратной связи указывают цифрам, соответствующими номеру атома углерода, с которым связан заместитель (для кратной связи указывают наименьший номер). Цифры ставят перед перфиксами и после суффиксов (цифра, указывающая положение старшей характеристической группы или кратной связи, может стоять и перед названием родоначальной структуры). Например, изопрен CH2=C(CH3)-CH=CH2 2-метилбутдиен-1,3; коламин H2NCH2CH2OH – 2-аминоэтанол; измасленный альдегид – (CH3)2CHCH=О – 2-метилпропаналь; масляная кислота – CH3(CH2)2COOH – бутановая кислота; молочная кислота CH3CH(OH)COOH – 2-гидроксипропионовая кислота.
Кроме заместительной номенклатуры, в основе которой лежит выбор родоначальной структуры (главной углеродной цепи или основного цикла) и соединение рассматривают как продукт замещения этой структуры, правила ИЮПАК* включают также радикально-функциональную номенклатуру. Радикально-функциональная номенклатура используется реже. Обычно она применяется для некоторых классов органических соединений (кетонов, простых эфиров, спиртов, галогенопроизводных и др.). В этом случае название составляют из названий углеводородных радикалов, а наличие функциональной группы в отличие от заместительной номенклатуры отражают не суффиксом, а названием соответствующего класса соединений. Например: C2H5OH - этиловый спирт; C2H5Cl - этилхлорид; CH3–O–C2H5 - метилэтиловый эфир; CH3–CO–CH=CH2 - метилвинилкетон.
3.Изомерия органических веществ. Виды изомерии. Стериоизомерия (геометрическая и оптическая). Способы представления энантиомеров на плоскости. Проекционные формулы Фишера.
Изомерия – это явление существования разных веществ с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой. Существует два вида изомерии: структурная и пространственная.
Структурную изомерию различают на: Изомерия углеродного скелета. Изомерия положения кратной связи. Изомерия положения функциональной группы. Межклассовая изомерия.
-
Изомерия углеродного скелета.
![]()
Пентан
Составим изомер
![]() 2
метилбутан
2
метилбутан
-
Изомерия положения кратной связи
.![]()
Пентен – 1
![]() Пентен
– 2
Пентен
– 2
-
Изомерия положения функциональной группы
.![]() Пентанол
– 2
Пентанол
– 2
![]() Пентанол
– 3
Пентанол
– 3
4. Межклассовая изомерия.
![]() Бутанон
– 2
Бутанон
– 2
![]() Бутаналь
Бутаналь
Пространственная изомерия подразделяется на:Геометрическая изомерия.Оптическая изомерия.Стереоизомеры (пространственные изомеры) — химические соединения, имеющие одинаковое строение, но отличающиеся пространственным расположением атомов[1][2]. Стереоизомеры имеют одинаковую конституцию, но различные конфигурацию и/или конформацию
1. Геометрическая изомерия.
![]() Бутен
– 2
Бутен
– 2
Заместители могут располагаться либо по одну строну плоскости двойной связи (цис-изомер), либо по разные (транс-изомер).
![]() Бутен
-2 (цис-изомер)
Бутен
-2 (цис-изомер)
![]() Бутен-2 (транс-изомер)
Бутен-2 (транс-изомер)
2. Оптическая изомерия.
Явление изомерии возникает, если молекула несовместима со своим изображением в зеркале.
![]() изомерия
а-аминопропионовой кислоты.
изомерия
а-аминопропионовой кислоты.
Проекция Фишера (проекционная формула Фишера, формула Фишера) — способ изображения трёхмерной молекулы в виде проекции, в которой вертикальные связи удаляются за проекционную плоскость, а горизонтальные связи выступают перед этой плоскостью[1]. Данные формулы были предложены Э. Фишером в 1891 году для изображения структур углеводов[2].
В проекции Фишера химические связи изображаются в виде горизонтальных и вертикальных линий, на перекрестьях которых находятся стереоцентры. Углеродный скелет изображают вертикально, при этом сверху находится атом углерода, с которого начинается нумерация скелета (например, альдегидныйС-атом для альдоз). Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Данное условие важно для правильного построения проекции Фишера, а также при восстановлении трёхмерной структуры молекулы из её проекции. По этой причине проекцию Фишера нельзя вращать на 90° или 270°, так как это приведёт к изменению конфигурации стереоцентров. Согласно рекомендациям ИЮПАК, атомы водорода следует изображать в явном виде, однако структуры без атомов водорода также считаются приемлемыми[3].
4.Понятие стереоцентра в органических молекулах. Энантиомерия и деастереомерия. R/S номенклатура для органических веществ, содержащих стереоцентры. Особенности номенклатуры для веществ, с несколькими стереоцентрами.
Изомерия— явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др оптически активными веществами и физических свойств в хиральной среде).
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ-диастереомеры
отличаются друг от друга конфигурацией
части имеющихся в них элементов
хиральности. Так, диастереомерами
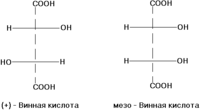
являются (+)-винная
кислота и мезо-винная кислота,
D-глюкоза
и D-манноза,
например: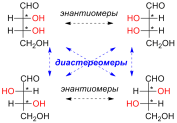
![]()
π—диастереомерия (геометрическая изомерия)
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
R/S-номенклатура является наиболее широко используемой в данное время, поскольку позволяет охарактеризовать энантиомер по его абсолютной конфигурации. Это стало возможным благодаря открытию рентгеноструктурного анализа, позволяющего установить точное пространственное расположение атомов в молекуле.
Данный вид номенклатуры основывается на присвоении хиральному атому углерода обозначения R или S на основании взаимного расположения четырёх связанных с ним заместителей. При этом для каждого из заместителей определяют старшинство в соответствии с правилами Кана — Ингольда — Прелога, затем молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию атома углерода обозначают R (лат. rectus — правый). В противоположном случае конфигурацию обозначают S (лат. sinister — левый)[2][3].
Если соединение содержит лишь один хиральный центр, то его конфигурация указывается в названии в виде приставки. Если в соединении находится несколько стереоцентров, необходимо обозначить конфигурацию каждого.R/S-номенклатура не имеет непосредственной связи с (+/–)-обозначениями. Например, R-изомер может быть как правовращающим, так и левовращающим, в зависимости от конкретных заместителей при хиральном атоме.
