
ЭКЗАМЕН ПО ФИЗИКЕ / Физика / 31
.doc31.Степени свободы молекул. Распределение энергии по степеням свободы. Молекулярно-кинетическая теория теплоемкости газов. Удельная и молярная теплоемкости
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
![]()
Единила удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг К)).
Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
![]() (53.1)
(53.1)
где =m/М—количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль К)).
Удельная теплоемкость с связана с молярной Сm, соотношением
![]() (53.2)
(53.2)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным
В молекулярно-кинетической теории пользуются моделью идеального газа, удовлетворяющей следующим условиям:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Опытным путем, задолго до появления молекулярно-кинетической теории, был открыт целый ряд законов, описывающих поведение идеальных газов, которые мы и рассмотрим.
Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная;
рv = const при Т, m = сonst
42.1
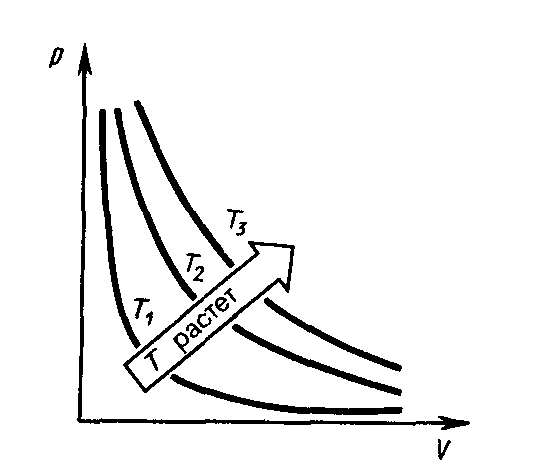
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой.Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура (рис.38).
Законы Гей-Люссака: 1) объем данной массы при постоянном давлении изменяется линейно с температурой:
V = V0 (1 + t) при p ,m = const
42.2
2) давление данной массы газы при постоянном объеме изменяется линейно с температурой:
p = p0 (1+t) при V, m = const
42.3
В этих уравнениях t - температура по шкале Цельсия, р0 и V0 - давление и объем при О0С, коэффициент = 1/273.15 К-1.
Процесс, протекающий при постоянном давлении, называется и з о б а р н ы м. На диаграмме в координатах V, t (рис.39) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме , называется и з о х о р н ым. На диаграмме в координатах p, t (рис.40) он изображается прямой, называемой изохорой.
Из 42.2 и 42.3 следует, что изобары и изохоры пересекают ось температур в точке t = - 1/ = - 273.15 0С, определяемой из условия 1+ t = 0. Если сместить начало

отсчета в эту точку, то происходит переход к шкале Кельвина (рис.40) откуда Т = t + 1/
Вводя в формулы 42.2 и 42.3 термодинамическую температуру, закона Гей-Люссака можно придать более удобный вид:
V = V0 (1 + t) = V0 [1+( T - 1/)] = V0T
p = p0(1+ t) = p0[1+( T - 1/)] = p0 T
или
V1/V2 = T1/T2 при p, m = const
41.4
p1/p2 = T1/T2 при V, m = const
41.5
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях ( р = 1.013 105 Па, Т = 273, 15 К) этот объем равен 22.41 10-3 м3/ моль.
По определению, в одном моле различных веществ содержится одно и тоже число молекул, называемое постоянной Авогадро:
N a = 6.022 10 23 моль-1.
Закон Дальтона : давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е.
р = р1 + р2 + ......+ рn
где р1,......, рn - парциальные давления - давления, которые оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси при той же температуре.
43. Уравнение Клайперона-Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением з, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния.
Пусть некоторая масса газа занимает объем V1, имеет давление р1 и находится при температуре Т1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2, Т2 (рис.41). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического ( изотерма 1-1), 20 изохорного (изохора 1-2).

В соответствии с законами Бойля - Мариотта 42.1 и Гей-Люссака 42.5 запишем:
р1V1 = p1V2
43.1
р1/ p2 = T1/T2
43.2
Исключив из уравнений 43.1 и 43.2 р1, получим
р1V1/T1 = p2V2 / T2
Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина рV/ Т остается постоянной, т.е.
рV / T = B = const
43.3
Выражение 43.3 является уравнением Клайперона, в котором В - газовая постоянная, различная для разных газов.
Уравнению
рVm = RT
43.4
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клайперона-Менделеева.
Числовое значение молярной газовой постоянной определим из формулы 43.4 полагая, что моль газа находится при нормальных условиях ( р = 1.013 105 Па. Т = 273, 15 К, Vm = 22.41 10-3 м3/ моль, R = 8.31 Дж / моль К).
Уравнение Клайперона-Менделеева для массы m газа
pV = m/M RT = RT
43.5
где = m/M - число молей.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
k = R/Na = 1.38 10-23 Дж /К
Исходя из этого, уравнение состояния запишем в виде
р = RT / Vm = k Na T / Vm = k n T
где Na / Vm = n - концентрация молекул.
Понятие числа степеней свободы - числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу однотомного газа (рис.47,а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
![]()
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
![]()
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий Na молекул:
![]() (50.1)
(50.1)
Внутренняя энергия для произвольной массы т газа.
![]()
где М — молярная масса, — количество вещества.
