
Чалова Химия
.pdf61
4.Расстановка коэффициентов электронного баланса (с учетом состава соединений) перед окислителем и восстановителем и продуктами их превращений:
K2Cr2O7 + 6KI + H2SO4 → Cr2(SO4)3 + 3I2 + K2SO4 + H2O
5.Определение коэффициентов материального баланса для всех остальных элементов:
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
6. Проверка по суммарному числу атомов кислорода в левой и в правой части уравнения:
число атомов 0 |
число атомов 0 |
в левой части уравнения |
в правой части уравнения |
[7 + 7∙4] = 35 |
[(3∙4 + 4∙4 + 7)] = 35 |
Метод ионно-электронного баланса применяют для составления уравне-
ний ОВР, протекающих в водных растворах. Он включает следующие этапы:
1.Составление схемы реакции с учетом диссоциации сильных электролитов на ионы:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O (молекуляр-
наяформа)
K++MnO4– +2Na++SO32–+2H++SO42-→Mn2++SO42-+2Na++SO42–+H2O (ионная форма)
2. Определение частиц, изменивших в результате реакции состав или заряд:
MnO4– |
→ |
Mn2+ |
SO32– |
→ |
SO42– |
3.Составление полуреакций окисления и восстановления. Причем матери-
альный баланс подбирается с использованием частиц H2O и H+ - для реакций в кислой среде и частиц H2O и OH– - для реакций в щелочной среде
MnO4– + 8H+ → Mn2+ + 4H2O
SO32– + H2O → SO42– + 2H+
4.Определение заряда каждой из систем до и после превращения; определение числа «отданных» восстановителем и «принятых» окислителем
электронов:
MnO4– + 8H+ + 5e– |
→ Mn2+ + |
4H2O |
(процесс восстановления) |
|||
суммарный заряд |
суммарный заряд |
|
|
число переданных |
||
до превращения |
после превращения |
|
|
электронов |
||
[–1+8(+1)]=+7 |
[+2+4∙0]=+2 |
2H+ |
|
|
n1= +7–2= +5 |
|
SO32– + H2O – 2e |
→ SO42– + |
(процесс окисления) |
||||
суммарный заряд |
суммарный заряд |
|
|
число переданных |
||
до превращения |
после превращения |
|
|
электронов |
||
[–2+0]=–2 |
[–2+2∙(+1)]=0 |
|
|
n2= –2–0= –2 |
||
5. Определение коэффициентов электронного баланса: |
|
|||||
|
Наименьшее общее |
коэффициенты элек- |
||||
MnO4– + 8H+ + 5e → Mn2+ + 4H2O |
кратное |
|
|
тронного баланса |
||
|
5∙2=10 |
|
10 : 5=2 |
|||
SO32– + H2O – 2e → SO42– + 2H+ |
|
|
|
|
10 : 2=5 |
|
|
|
|
|
|||

62
6.Сложение полуреакций окисления и восстановления, умноженных на со ответствующие коэффициенты электронного баланса, «приведение по
добных членов» и составление краткого ионного уравнения:
2MnO4– + 16H+ + 10e + SO32– + 5H2O – 10e →2Mn2+ + 8H2O + 5SO42– + 10H+
2MnO4– + 6H+ + 5SO32– → 2Mn2+ + 5SO42– + 3H2O (краткое ионное уравнение)
7.Составление молекулярного уравнения. Коэффициенты, полученные в кратком ионном уравнении, переносятся в молекулярное (с учетом состава соединений):
2KMnO4 + 3H2SO4 + 5Na2SO3 → 2MnSO4 + 5Na2SO4 + 3H2O + K2SO4
8.Определение коэффициентов перед элементами, не участвовавшими в ОВР (например, К).
9.Проверка по суммарному числу атомов кислорода в левой и правой части
уравнения:
суммарное число атомов 0 |
суммарное число атомов 0 |
в левой части уравнения |
в правой части уравнения |
[2∙4+3∙4+5∙3]=35 |
[2∙4+5∙4+3+4]=35 |
9.2.Направление протекания окислительно-восстановительных реакций
Условием протекания окислительно-восстановительных реакций является наличие двух сопряженных окислительно-восстановительных пар, причем взаимодействие осуществляется между сильным окислителем и сильным восстановителем с образованием слабого окислителя и слабого восстановителя:
окислитель (1) + восстановитель (2) → восстановитель (1) + окислитель (2)
сильные |
слабые |
Свойства сопряженной окислительно-восстановительной пары характеризует
окислительно-восстановительный потенциал (φок./вос.).
Чем больше величина окислительно-восстановительного потенциала, тем более сильным окислителем является окисленная форма системы и тем слабее выражены восстановительные свойства восстановленной формы.
Чем меньше величина окислительно-восстановительного потенциала, тем более сильным восстановителем является восстановленная форма системы.
В самопроизвольных окислительно-восстановительных реакциях окислитель имеет больший (более положительный), а восстановитель – меньший (менее положительный) окислительно-восстановительный потенциал.
φок(1) > φвос(2)
Следовательно, разность окислительно-восстановительных потен-
циалов - электродвижущая сила (ЭДС) – самопроизвольно протекающих окислительно-восстановительных реакций положительна.
ЭДС = φок(1) – φвос(2) > 0
63
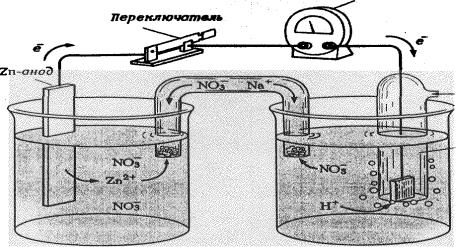
Определить абсолютное значение окислительно-восстановительного потенциала сопряженной окислительно-восстановительной пары нельзя. Но можно измерить разность потенциалов между двумя окислительно-восстанови- тельными системами (рис. 5)
За систему сравнения выбран стандартный водородный электрод: платиновая пластина, погружённая в раствор кислоты с концентрацией ионов [Н+]=1 моль/л, которая при 101,325 кПа и 298 К омывается водородом.
Стандартный окислительно-восстановительный потенциал для системы Н2 
 2Н+ + 2е–,
2Н+ + 2е–,
возникающий в стандартном водородном электроде, принят равным нулю: φо(Н+/Н2) = 0,00 В.
Окислительно-восстановительный потенциал электрохимической системы в стандартных условиях, измеренный относительно стандартного водородного электрода называют стандартным окислительно-восстано-
вительным потенциалом. Значения стандартных окислительно-восстанови- тельных потенциалов, измеренные экспериментально, приводят в таблицах «Стандартные окислительно-восстановительные потенциалы» (табл.3 приложения).
Вольтметр
а) |
б) |
Рис. 5. Гальванический элемент с водородным электродом: а) цинковый электрод; б) водородный электрод
9.3. Химические свойства металлов
9.3.1.Ряд стандартных окислительно-восстановительных потенциалов металлов
Металлы в реакциях с любыми простыми или сложными веществами
проявляют восстановительные свойства. Химическую активность металлов в реакциях с водными растворами окислителей характеризует окислительно-
восстановительный потенциал Меo n / Me . Ряд стандартных окислительно-
восстановительных потенциалов металлов (ряд напряжений металлов, ряд стандартных электродных потенциалов металлов) – последователь-

64
ность, в которой металлы расположены в порядке увеличения стандарт-
ных окислительно-восстановительных потенциалов для систем |
|
|
|||||||||||||||||||
|
|
Ме |
– |
ne |
|
|
|
Men+ |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
восст. форма |
|
|
|
|
|
окисл. Форма |
|
|
|
|
|
|
|
|
|
||||||
|
|
Восстановительная способность металлов увеличивается |
|
|
|
|
|
||||||||||||||
|
|
неблагородные металлы |
|
|
|
|
|
|
|
|
|
|
благородные металлы |
||||||||
|
|
Li |
K |
Ca |
Na |
Mg |
Al |
Mn |
Zn |
Cr |
Fe |
Cd |
Ni |
Pb |
Н2 |
Cu |
Ag |
Hg |
Au |
||
|
|
Li+ |
K+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Mn2+ |
Zn2+ |
Cr3+ |
Fe2+ |
Cd2+ |
Ni2+ |
Pb2+ |
Н+ |
Cu2+ |
Ag+ |
Hg2+ |
Au3+ |
||
o n |
/ Me |
o -3,04 |
-2,92 |
-2,87 |
-2,71 |
-2,36 |
|
-1,66 |
-1,18 |
-0,76 |
-0,74 |
-0,41 |
-0,40 |
-0,25 |
-0,13 |
0 |
+0,34 |
+0,80 |
+0,85 |
+1,41 |
|
Ме |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Окислительная способность катионов металлов увеличивается Стандартный электродный потенциал пары металл/катион металла увеличивается
Анализ ряда стандартных окислительно-восстановительных потенциалов металлов
1.Чем левее металл в ряду, тем он химически активнее, легче окисляется и труднее восстанавливается из ионов.
Чем правее стоит металл в ряду, тем меньше его восстановительная способность и тем более выражена окислительная способность катионов металла.
2.Каждый металл, не разлагающий воду, вытесняет все последующие, правее стоящие металлы, из растворов их солей.
Например
|
|
2е |
|
|
|
|
|
|
|
|
|
o |
|
|
2 |
|
|
o |
o |
||
|
|
|
|
|
|
|||||
Fe |
SnCl |
|
|
|||||||
2 |
→ FeCl2 Sn ; |
Fe 2 / Fe 0,44 |
< Sn2 / Sn = -0,14 |
|||||||
восстановитель |
|
|
|
|||||||
|
|
|
|
окислитель |
|
|
|
|||
3.Металлы, стоящие в ряду левее водорода, характеризуются отрицательными значениями окислительно-восстановительных потенциалов и вытесняют молекулярный водород из растворов кислот (HCl, CH3COOH, RCOOH, H2SO4(разб.)…)
2Мео + 2nH+ → 2Men+ + nH2
восстановитель окислитель
o |
n |
/ Me(вос л) |
< o |
/ |
H2 |
( |
ок ль) |
|
|
|
Ме |
|
H |
|
|
|
|||||
Например: |
|
|
|
|
|
|
|
|
|
|
Fe + 2HCl |
→ FeCl2 |
+ |
|
H2 |
||||||
o |
n |
/ Me(вос л) |
= -0,44 < |
|
|
o |
|
/ H2 |
(ок ль) |
|
Ме |
|
|
|
|
|
H |
|
|||
Металлы, стоящие в ряду правее водорода, характеризуются положительными значениями окислительно-восстановительных потенциалов и не вытесняют молекулярный водород из растворов кислот.

65
Например: |
|
|
|
|
|
|
||
Cu |
|
+ |
HCl |
|
|
|
|
|
|
|
> o |
|
|
||||
o |
2 |
/ Cu |
0,34 |
|
/ H 2 |
|||
Сu |
|
|
|
|
H |
|
||
9.3.2.Взаимодействие металлов с водой
Окислителем в воде является ион Н+. Окислительные свойства системы
2H+ + 2e |
|
|
H2 |
(pH<7) |
|||
|
|
||||||
|
|
||||||
или |
H2 + 2OH– |
|
|||||
2H2O + 2e |
|
|
(pH≥7) |
||||
|
|
|
|||||
|
|||||||
зависят в соответствии с уравнением Нернста от рН раствора (для |
|||||||
Т=298К и PH2 101,3кПа ): |
|
||||||
H / H 2 Ho / H 2 |
|
0,059 |
lg[H ]2 |
0 0,059lg[H ] |
|||
|
|||||||
|
|
|
|
2 |
|
|
|
H / H 2 0,059 pH
Внейтральной водной среде рН=7 и H / H 2 0,41B . Термодинамически воз-
можна реакция воды с металлами, для которых
o |
n |
/ Me |
o |
< |
H |
|
0,041B , |
Me |
|
|
|
|
/ H2 |
т.е. стоящими в ряду стандартных окислительно-восстановительных потенциалов металлов левее Cd. Однако большинство из них покрыты защитными оксидными пленками, нерастворимыми в воде, которые и «пассивируют» металлы. Поэтому активно взаимодействуют с водой только щелочные (IA группа) и щелочно-земельные металлы. Продуктами реакции являются молекулярный водород и растворимые гидроксиды металлов.
2Me + 2nH2O → 2Me(OH)n + nH2
Me: |
Li, Na, K, Rb, Cs, Fr |
(IA – подгруппа) |
|
Ca, Sr, Ba, Ra |
(IIA – подгруппа) |
9.3.3.Взаимодействие металлов с водными растворами щелочей
Сводными растворами щелочей взаимодействуют металлы, оксиды и гидроксиды которых растворимы в щелочах, и выполняется условие протекания окислительно-восстановительных реакции
[oMe(OH )4 ]n 4 / Me |
< H 2O / H 2 |
0,082 |
К ним относятся «амфотерные» металлы : Be, Al, Ga, Sn, Pb, Zn. Продуктами реакции являются молекулярный водород и гидроксокомплексы
2Me + 2nH2O + (8–2n)OH- → 2[Me(OH)4]n-4 + nH2
Например:
Zn + 2H2O + 2NaOH → Na2[Zn(OH)4] + H2
66
9.3.4.Взаимодействие металлов с растворами кислот, окисляющими ионом Н+
К этой группе относятся кислоты, анионы которых не проявляют окисли-
тельных свойств. Например, HF, HCl, HBr, HI, H2CO3, H2S, H3PO4, H2SO4(разб.), RCOOH….
Окислителем в них является ион Н+, по отношению к которому термодинамически неустойчивы все металлы, стоящие в ряду стандартных окислитель- но-восстановительных потенциалов левее водорода
Меn / Ме |
< Ho / H 2 |
0 |
Продуктами реакции металлов с растворами кислот, окисляющими ионом Н+ являются молекулярный водород и соль металла (в меньшей степени окисле-
ния).
2Ме + 2nH+ → 2Men+ + nH2
Например:
2Al + 6HCl → 2AlCl3+3H2
+2
Fe + H2SO4 → FeSO4 + H2
разб.
Большинство металлов покрыто оксидами основного или амфотерного характера, растворимыми в кислотах. Поэтому оксидные пленки не пассивируют металлы в кислой среде, за исключением молибдена, вольфрама…, на поверхности которых оксиды – MoO3, WO3 – проявляют кислотные свойства.
Пассивирование металлов в кислой среде возможно, если образующаяся на поверхности металла соль, плохо растворима. Например:
Pb + 2HCl |
→ |
PbCl2↓ + H2 |
хол. |
|
бел.ос. |
или Pb + H2SO4 |
→ |
PbSO4↓ + H2 |
разб. |
|
бел.ос. |
9.3.5.Взаимодействие металлов с концентрированной серной кислотой
Вразбавленной серной кислоте окислителем является ион Н+, в концентрированной – анион SO42-, за счет S+6. Восстановление сульфат - аниона возможно до серы (S), диоксида серы (SO2) или сероводорода (H2S).
→ H2
SO2↑ (газ с резким запахом) S↓ (белый осадок)
H2S↑ (газ с характерным запахом «тухлых яиц»)
Концентрированная серная кислота окисляет металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов левее серебра. Продуктами реакции металлов с концентрированной серной кислотой являются соль – сульфат металла в высокой степени окисления, вода и продукт восстановления S+6 (SO2, S или H2S). Взаимодействие, как правило, протекает не селективно, по нескольким направлениям
67
Например
 MgSO4 + H2O + SO2
MgSO4 + H2O + SO2
Mg + H2SO4 конц MgSO4 + H2O + S
MgSO4 + H2O + S
 MgSO4 + H2O + H2S
MgSO4 + H2O + H2S
Некоторые металлы (Be, Al, Fe, Co, Ni, V, Nb…) «на холоду» концентрированной серной кислотой пассивируются.
9.3.6.Взаимодействие металлов с азотной кислотой
Вазотной кислоте окислителем является анион – NO3–, восстановление которого возможно до любого из продуктов, в соответствии со схемой
NH4+ |
|
NO2 |
N2H5+ |
HNO3 |
HNO2 |
+NH3OH |
|
NO |
N2 N2O
Окислительно-восстановительные потенциалы для всех реакций восстановления HNO3 близки, поэтому процессы взаимодействия металлов и азотной кислоты неселективные.
Продуктами взаимодействия металла с азотной кислотой являются соль-нитрат металла в высокой степени окисления, вода и продукты восстановления N+5 (NO2, HNO2, NO…, NH+4), состав которых определяется активностью металла и концентрацией кислоты. Концентрированная азотная кислота восстанавливается преимущественно до оксида азота (IV); разбавленная – преимущественно до NO с неактивными металлами или до NH4+ – с активными металлами
HNO3 (конц) . |
|
NO2 |
|
||
|
|
|
|
NO |
(с неактивными металлами) |
|
|
|
|
||
HNO3(разб.) |
|
|
NH4+ |
(с активными металлами) |
|
|
|
||||
|
|||||
Например |
|
|
|
|
|
1. Сu + |
4HNO3 |
конц. |
→ Cu(NO3)2 + 2NO2 + 2H2O |
||
3Cu + |
8HNO3 |
разб. |
→ 3Сu(NO3)2 + 2NO + 4H2O |
||
2. 4Zn + 10HNO3 разб. → 4Zn(NO3)2 + NH4NO3 + 3H2O
3. Fe + 4HNO3 разб. → Fe(NO3)3 + NO + 2H2O
Окисляются азотной кислотой металлы, стоящие в ряду стандартных окисли- тельно-восстановительных потенциалов до серебра включительно. Некоторые металлы (Be, Al, Cr, Fe, Co, Ni…) концентрированной азотной кислотой на холоде пассивируются.
68
9.4.Лабораторная работа № 5 Химические свойства металлов
Опыт 1. Взаимодействие металлов с соляной кислотой.
Ряд стандартных окислительно-восстановительных потенциалов металлов
В пять пробирок налить по 1 мл 2 М раствора соляной кислоты и поместить в каждую пробирку по одному кусочку металла Mg, Zn, Fe, Pb, Cu. Наблюдать за изменениями в пробирках в течение 5-10 минут. Пробирку со свинцом нагреть, после охлаждения добавить 2 капли сульфида натрия.
-Отметить, как протекают реакции в каждой из пробирок, что выделяется;
-расположить металлы в порядке уменьшения их активности по отношению к соляной кислоте;
-какой металл не взаимодействует с соляной кислотой;
-составить уравнения реакций
Mg + HCl → …;
Zn + HCl → …;
Fe + HCl → …;
-определить окислитель и восстановители;
-выписать из табл.3 приложения значения стандартных окислительно- восстановитель-ных потенциалов электрохимических систем
o |
|
2 |
/ Mg |
o ...; |
o |
|
2 |
/ Zn |
o |
...; |
|||||
Mg |
|
|
|
Zn |
|
|
|
|
|||||||
o |
2 |
/ Fe |
o |
...; |
o |
|
|
2 |
/ Pb |
o ...; |
|||||
Fe |
|
|
|
|
|
Pb |
|
|
|
||||||
o |
2 |
/ Cu |
o |
...; |
o |
|
/ |
H2 |
...; |
||||||
Cu |
|
|
|
|
H |
|
|
|
|
||||||
-рассчитать ЭДС проведенных реакций
ЭДС = φок . – φвос.
-указать, какие из проведенных реакций термодинамически возможны;
-сформулировать условие самопроизвольного протекания окислительновосстановительной реакции;
-отметить, какие изменения происходят в пробирке со свинцом после нагревания;
-составить уравнение реакции
Pb + HCl → …;
- составить уравнение реакции, подтверждающей наличие ионов Pb2+ в растворе
PbCl2 + Na2S → …;
-ответить, почему свинец не взаимодействует с соляной кислотой при комнатной температуре;
-объяснить, что такое «пассивирование металла»;
-сформулировать, какие металлы могут вытеснять молекулярный водород из кислот.
69
Опыт 2. Взаимодействие металлического цинка с растворами солей
В пять пробирок внести по грануле металлического цинка и прилить по 1мл раствора соли в первую пробирку–хлорида магния; во вторую–сульфата железа (II); в третью – хлорида олова (II); в четвертую – нитрата свинца (II); в пятую – сульфата меди (II). Наблюдать за изменениями в пробирках в течение 5-10 минут. Используя универсальный индикатор, измерить рН в растворах солей.
-Отметить, как протекают реакции в каждой из пробирок, что выделяется;
-ответить, реакция металлов с водными растворами – гомогенная или гетерогенная;
-ответить, с раствором какой соли цинк не взаимодействует;
-составить уравнения основных реакций:
Zn + FeSO4 …;
Zn + SnCl2 …;
Zn + Pb(NO3)2 …;
Zn + CuSO4 …;
-указать восстановитель и окислитель;
-используя значения стандартных окислительно-восстановительных потенциалов (табл.3 приложения), рассчитать ЭДС проведенных реакций:
ЭДС = φок - φвос;.
-расположить растворы солей в порядке увеличения ЭДС и активности их взаимодействия с цинком;
-используя ряд стандартных окислительно-восстановительных потенциалов, сформулировать, какие металлы могут быть «вытеснены» из растворов их солей цинком;
-по измеренной величине рН, ответить, какая среда в каждом из растворов солей;
-ответить, какой газ выделяется;
-составить уравнения побочных реакций:
Me2+ + H2O 
 MeOH+ + H+ (уравнение гидролиза)
MeOH+ + H+ (уравнение гидролиза)
Zn + H+ …
Опыт 3. Взаимодействие металлов - Ca и Mg - с водой
В две пробирки налить по 2-3 мл дистиллированной воды и добавить 2 капли раствора фенолфталеина. В одну пробирку поместить немного металлического магния, в другую-кальция. Наблюдать за изменениями в пробирках в течение 3-5 минут. Пробирку с магнием нагреть на спиртовке до кипения.
-Отметить, как протекает реакция с Mg при комнатной температуре; с Mg при нагревании;
-сравнить активность металлов Ca и Mg ;
-составить уравнения реакций:
Ca + H2O
Mg + H2O ;
- указать восстановители и окислитель; какой газ выделяется;
70
-рассчитать потенциал «водородного электрода» H / H 2 0,059 pH
при рН=7;
-рассчитать ЭДС реакций: ЭДС = φок. – φвос.;
-ответить, почему при комнатной температуре магний практически не взаимодействует с водой;
-что «пассивирует» Mg и почему при нагревании реакция осуществляется;
-отметить, в какой пробирке окраска фенолфталеина более интенсивная;
-используя рис. 2, по окраске фенолфталеина указать, какая среда в растворах полученных продуктов;
-ответить, какие металлы активно взаимодействуют с водой.
Опыт 4. Взаимодействие металлов – Al, Sn и Zn с водным раствором щелочи
Налить в три пробирки по 1-2 мл концентрированного раствора щелочи - гидроксида натрия - и поместить в каждую из пробирок один из металлов (в первую – алюминиевую стружку, во вторую – гранулу цинка, в третью – гранулу олова). Пробирки осторожно нагреть на спиртовке.
-Отметить, как протекает реакция металлических Al, Zn, и Sn с водным раствором щелочи;
-растворы каких веществ называют щелочами, привести примеры;
-сравнить активность металлических Al, Zn и Sn по отношению к водному раствору щелочи;
-ответить, чем покрыт каждый из металлов;
-составить уравнения реакции растворения оксидных пленок металлов в растворе гидроксида натрия, учитывая, что образуются гидроксокомплексы
Al2O3 + NaOH + H2O …
ZnO + NaOH + H2O …
SnO2 + NaOH + H2O …;
-составить уравнения реакций металла с раствором гидроксида натрия, учитывая, что образуются соответствующие гидроксокомплексы с координационным числом, равным четырем:
Al + NaOH + H2O …
Zn + NaOH + H2O …
Sn + NaOH + H2O …;
-указать восстановители и окислитель;
-ответить, какой газ выделяется;
-выписать (табл.3 приложения) значения стандартных окислительно-
восстановительных потенциалов электрохимических систем
Me + 4OH- - ne 
 [Me(OH)4]n-4:
[Me(OH)4]n-4:
o |
|
1 |
…; |
o |
2 |
…; |
[ Al (OH ) |
4 ] |
/ Al |
[Sn(OH )4 ] |
|
/ Sn |
|
o |
|
2 |
… .; |
|
|
|
[Zn(OH )4 ] |
|
/ Zn |
|
|
|
|
- сравнить их значения с соответствующими потенциалами для процессов окисления в кислой среде:
