
- •Волновая функция.
- •Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •Типы гибридизации
- •Эффективные заряды атомов в молекулах
- •Ионная связь, как крайний случай поляризации ковалентной связи
- •Ионная связь, её свойства, отличие от ковалентной связи
- •Металлическая связь
- •Водородная связь
- •Константа химического равновесия
- •Билет №23
- •Билет №25
Билет №23
Электролиз.
Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиза
расплавов: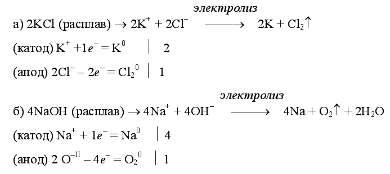
Электролиз
воды проводится
всегда в присутствии инертного электролита
(для увеличения электропроводности
очень слабого электролита - воды):![]()
В
зависимости от инертного электролита электролиз
проводится в нейтральной, кислотной
или щелочной среде. При выборе инертного
электролита необходимо учесть, что
никогда не восстанавливаются на катоде
в водном растворе катионы металлов,
являющихся типичными восстановителями
(например Li+,
Cs+,
K+,
Ca2+,
Na+,
Mg2+,
Al3+)
и никогда не окисляется на аноде кислород
O−II анионов
оксокислот с элементом в высшей степени
окисления (например ClO4−,
SO42−,
NO3−,
PO43−,
CO32−,
SiO44−,
MnO4−),
вместо них окисляется вода![]()
Примеры электролиза растворов солей:
(на
аноде окисляются анионы Сl−,
а не кислород O−II молекул
воды, так как электроотрицательность
хлора меньше, чем кислорода, и следовательно,
хлор отдает электроны легче, чем кислород)![]()
(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде).
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
Билет №24
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды.
Водородная и кислородная коррозия Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
2H3O+ + 2e− → 2H2O + H2 или 2H2O + 2e− → 2OH− + H2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O2 + 2H2O + 4e− → 4OH−
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 4Fe + 3O2 → 2Fe2O3
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде)..
