
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот и оснований при 25оС
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы в водных растворах при 25оС
- •Библиографический список
- •Содержание
8.3.3. Взаимодействие металлов с водными растворами щелочей
С водными растворами щелочей взаимодействуют металлы, оксиды и гидроксиды которых растворимы в щелочах, и выполняется условие протекания окислительно-восстановительных реакции
![]() <
<
![]()
К ним относятся «амфотерные» металлы : Be, Al, Ga, Sn, Pb, Zn.
Продуктами реакции являются молекулярный водород и гидроксокомплексы
2Me + 2nH2O + (8–2n)OH- → 2[Me(OH)4]n-4 + nH2
Например:
Zn + 2H2O + 2NaOH → Na2[Zn(OH)4] + H2
8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
ионом Н+
К этой группе относятся кислоты, анионы которых не проявляют окислительных свойств. Например, HF, HCl, HBr, HI, H2CO3, H2S, H3PO4, H2SO4(разб.), RCOOH….
Окислителем в них является ион Н+, по отношению к которому термодинамически неустойчивы все металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов левее водорода
![]() <
<
![]()
Продуктами реакции металлов с растворами кислот, окисляющими ионом Н+ являются молекулярный водород и соль металла (в меньшей степени окисления).
2Ме + 2nH+ → 2Men+ + nH2
Например:
2Al + 6HCl → 2AlCl3+3H2
+2
Fe + H2SO4 → FeSO4 + H2
разб.
Большинство металлов покрыто оксидами основного или амфотерного характера, растворимыми в кислотах. Поэтому оксидные пленки не пассивируют металлы в кислой среде, за исключением молибдена, вольфрама…, на поверхности которых оксиды – MoO3, WO3 – проявляют кислотные свойства.
Пассивирование металлов в кислой среде возможно, если образующаяся на поверхности металла соль, плохо растворима. Например:
Pb + 2HCl → PbCl2↓ + H2
хол. бел.ос.
или Pb + H2SO4 → PbSO4↓ + H2
разб. бел.ос.
8.3.5. Взаимодействие металлов с концентрированной серной кислотой
В разбавленной серной кислоте окислителем является ион Н+, в концентрированной – анион SO42-, за счет S+6. Восстановление сульфат - аниона возможно до серы (S), диоксида серы (SO2) или сероводорода (H2S).
H2SO4(разб.) → H2
 SO2↑
(газ с резким запахом)
SO2↑
(газ с резким запахом)
H
 2SO4(конц.)
S↓
(белый осадок)
2SO4(конц.)
S↓
(белый осадок)
H2S↑ (газ с характерным запахом «тухлых яиц»)
Концентрированная серная кислота окисляет металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов левее серебра. Продуктами реакции металлов с концентрированной серной кислотой являются соль – сульфат металла в высокой степени окисления, вода и продукт восстановления S+6 (SO2, S или H2S). Взаимодействие, как правило, протекает не селективно, по нескольким направлениям
Например
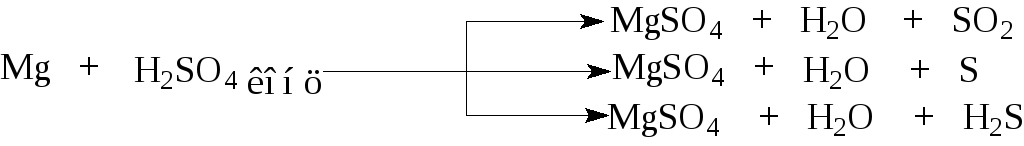
Некоторые металлы (Be, Al, Fe, Co, Ni, V, Nb…) «на холоду» концентрированной серной кислотой пассивируются.
