
Химия биомолекул и наносистем
.pdf
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Вариативный курс «Химия биомолекул и наносистем»
для студентов лечебного, педиатрического
истоматологического факультетов
истудентов-лечебников медикобиологического факультета
Подготовлено соответствии с ФГОС-3 в рамках реализации
Программы развития РНИМУ
Общая редакция — зав. кафедрой химии, проф. В.В. Негребецкий
1
Вариативный курс лекций «Химия биомолекул и наносистем» подготовлен в качестве методического пособия лекторским коллективом кафедры химии для студентов лечебного, педиатрического и стоматологического факультетов и студентовлечебников медико-биологического факультета РНИМУ в соответствии с федеральными государственными образовательными стандартами высшего профессионального образования (ФГОС-3) и Рабочими Программами по дисциплине «Химия» по специальностям «Лечебное дело», «Педиатрия», «Стоматология» в рамкахреализацииПрограммыразвития РНИМУ.
Настоящее пособие в дополнение к рисункам, формулам и уравнениям реакций включает определения основных понятий и терминов, необходимые студентам для подготовки к занятиям.
Вариативный курс сгруппирован по темам и состоит из двух разделов: (1) биоорганическая химия и (2) физическая химия поверхностных явлений, дисперсных систем и растворов ВМС».
Общая редакция — зав. кафедрой ОБОХимии, проф. В.В. Негребецкий
2

Часть 1. Биорганическая химия
проф. Ю.И. Бауков, проф. И.Ю. Белавин, проф. В.В. Негребецкий
Тема В-01 Биологически важные окислительно-
восстановительные реакции органических соединений
Общая редакция — зав. кафедрой химии, проф. В.В. Негребецкий
3

Биологически важные окислительно-восстанови- тельные реакции органических соединений
●Обмен веществ
●Окисление и восстановление
●Окисление органическихсоединений
●Восстановление органических соединений
●Окисление и восстановлениеазот- и серосодержащих органическихсоединений
●Кислород – главный окислитель в организме
●Система ФАД– ФАДН2
●Система НАД+– НАДН
●Система дисульфид– тиол
●Система хинон– гидрохинон
●Окисление с участием молекулярного кислорода
4

Окислительно-восстановительные реакции органических соединений
–реакции, включающие перенос электронов
•Удовлетворение энергетических потребностей организма.
•Превращение компонентовпищи в компоненты клетки.
•Удаление ксенобиотиков.
•Окислители как наиболее агрессивные стрессоры внешней среды.
5
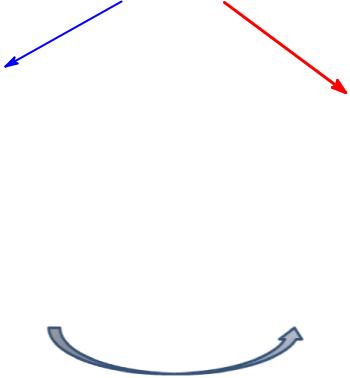
Обмен веществ (метаболизм)
распад сложных соединений |
биосинтез сложных соединений |
||
(катаболизм) |
(анаболизм) |
||
|
окисление |
восстановление |
|
|
|
|
|
выделение энергии |
потребление энергии |
 тепло
тепло
6
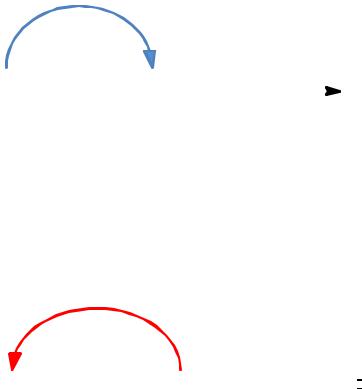
Окисление – процесс удаления водорода с образованием
кратной связи или новой связи между атомом углерода и гетероатомом, более электроотрицательным, чем водород, например, атомамиO, N, S и т. д.
e─
субстрат + окислитель |
|
окисленный + |
восстановленная |
|
форма окислителя |
||
|
|
продукт |
−включаетпереход электронов от органического субстрата к реагенту — окислителю.
Восстановление − процесс, обратный окислению, −
сопровождается образованием новых связей с водородом. e─
|
|
|
|
|
|
восстановлен- |
окисленная форма |
субстрат + восстановитель |
|
|
|
|
|
ный продукт + |
восстановителя |
|
|
|
|
|
− включаетперенос электронов от востановителя к
органическому субстрату
7

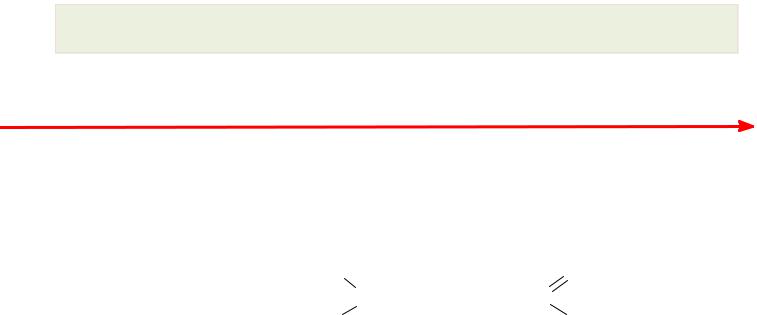
Перенос электронов в реакциях неорганических соединений
Fe3+ + e  Fe2+
Fe2+
Fe3+ + Cu+ |
|
Fe2+ + Cu2+ |
|
Перенос электронов в реакциях органических соединений
H3C—H + 1/2 O2 |
|
H3C— OH |
|
Степень окисления — заряд, которым обладал бы атом элемента в химическомсоединении, если электроны в каждой связи этого атома сместить к более электроотрицательному атому.
8
Степень окисления атома углерода
Увеличение степени окисления
–4 –2
CH4 CH3Cl
CH3OH
CH3NH2
– 3
CH3–CH 3
0 |
|
|
+2 |
|
+4 |
|||
CH2Cl2 |
CHCl3 |
CCl4 |
||||||
H |
|
|
O |
|
||||
C |
|
|
O |
H–C |
CO2 |
|||
|
||||||||
|
||||||||
H |
|
|
OH |
|
||||
H2C |
|
NH |
HC |
|
N |
|
||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|||||||
|
|
|
|
|
||||
|
–2 |
– 1 |
|||
CH2 |
|
CH2 |
H–C |
|
C–H |
|
|
||||
|
|||||
|
|
||||
|
|||||
|
|
||||
9

Изменение степени окисления атома углерода при окислении и дегидрировании
|
|
|
O |
|
|
O |
R CH3 |
R CH2OH |
R C |
|
R C |
CO2 |
|
|
|
|
H |
|
|
OH |
|
|
|
|
R |
|
|
|
R CH2 |
NH2 |
|
C |
NH |
|
|
|
|
|
H |
|
|
|
C |
C |
|
C |
C |
|
|
H |
H |
|
|
|
|
окисление [O]
восстановление [H]
10
