
- •Лекция 6 ОКСИД УГЛЕРОДА и СИНТЕЗ-ГАЗ
- •1. Наиболее важные для химической технологии свойства оксида углерода и синтез-газа. Области их
- •Адсорбенты фильтрующих противогазов не сорбируют СО, поэтому применяют противогазы изолирующего типа или имеющие
- •Области применения
- •Из синтез-газа получают (в зависимости от условий) метанол, высшие спирты или смеси углеводородов
- •2. Промышленные методы получения оксида углерода и синтез-газа
- •2.1 Получение синтез-газа газификацией угля
- •В качестве реакционных узлов преимущественно используются две конструкции газогенераторов (см. рис. 1 «а»
- •Синтез-газ, выходя из генератора при 700÷800 С, проходит системы утилизации тепла, очистки от
- •2.2 Получение синтез-газа каталитической конверсией углеводородов
- •Равновесие реакции (16) при повышении температуры смещается влево. В избытке водяного пара превращение
- •Недостатки: большая потребность в жаростойких трубах, небольшой полезный объем печи (катализатор занимает малый
- •В этом случае объемное отношение водяного пара к СН4 можно брать равными от
- •Технология каталитической конверсии
- •Принципиальная схема окислительной конверсии метана (или природного газа) под давлением изображена на рис.
- •Конвертор охлаждается кипящим в рубашке конденсатом; при этом генерируется пар давлением 2÷3 МПа,
- •Конвертированный газ поступает в абсорбер 9, где поглощается диоксид углерода, а очищенный газ
- •На получение этим методом 1 м3 очищенного синтез-газа расходуется 0,35÷0,40 м3 природного газа,
- •3. Получение концентрированного оксида углерода
- •2 метод. Другой метод состоит в извлечении остаточного оксида углерода при производстве водорода

Лекция 6 ОКСИД УГЛЕРОДА и СИНТЕЗ-ГАЗ
1.Наиболее важные для химической технологии свойства оксида углерода и синтез-газа. Области их применения.
2.Промышленные методы получения синтез-газа:
2.1Получение синтез-газа газификацией угля
2.2Получение синтез-газа каталитической конверсией углеводородов
3.Получение концентрированного оксида углерода.

1. Наиболее важные для химической технологии свойства оксида углерода и синтез-газа. Области их применения
Оксид углерода (СО) и синтез-газ (смесь СО и Н2) являются одной из пяти главных групп исходных веществ для получения многих тысяч разнообразных продуктов основного органического и нефтехимического синтеза.
Оксид углерода представляет собой бесцветный, трудно сжижаемый газ, несколько легче воздуха, в чистом виде без запаха. Температура конденсации при атмосферном давлении равна -192 С, температура затвердевания -205 С. С воздухом образует взрывоопасные смеси в пределах концентраций 12,5÷74,0%об. Является весьма сильным ядом, токсичен (угарный газ). ПДК в воздухе рабочей зоны производственных помещений составляет 20 мг м3.

Адсорбенты фильтрующих противогазов не сорбируют СО, поэтому применяют противогазы изолирующего типа или имеющие специальный гопкалитовый патрон, заполненный оксидом марганца МnО2, катализирующий окисление СО до СО2. Оксид углерода сорбируется не только некоторыми твердыми телами, но и теми жидкостями, в которых он мало растворим. Хорошо сорбируют СО также водно-аммиачные растворы солей одновалентной меди, с которыми он легко образует комплексы при низких температурах. Из этих комплексов оксид углерода
десорбируют при нагревании (подобно диеновым углеводородам и ацетилену).
Второй компонент синтез-газа – водород – наиболее трудно сжижаемый газ: температура конденсации при атмосферном давлении равна минус 252,8 С, температура плавления минус 259,2 С. С воздухом образует взрывоопасные смеси в пределах 4,0÷75,0 % об. Таким образом, производство синтез-газа и производства, где он используется в качестве исходного сырья либо промежуточного продукта, относятся к особо взрыво- и пожароопасным (категория А).
Области применения
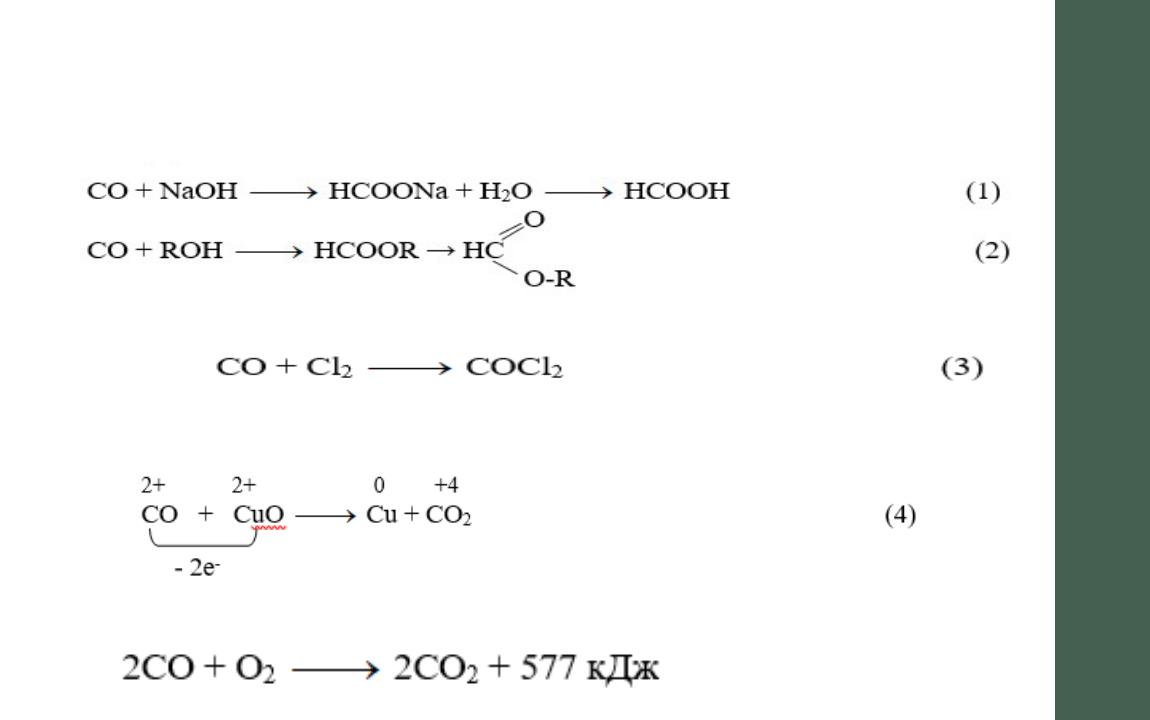
Чистый оксид углерода в промышленном органическом синтезе используется в качестве исходного сырья, например, для получения муравьиной кислоты и ее эфиров:
Хлорированием получают ценный промежуточный продукт – фосген
Оксид углерода может восстанавливать большинство металлов из их оксидов:
Используется как качественное топливо:

Из синтез-газа получают (в зависимости от условий) метанол, высшие спирты или смеси углеводородов – компоненты моторных топлив:
Реакциями оксосинтеза получают альдегиды и спирты, например:
Водород используется в синтезе аммиака и моторных топлив, гидрировании ненасыщенных жиров и масел и т.д. Водородно-кислородным пламенем (Т=2800 С) пользуются для сварки и резки металлов, для плавления тугоплавких металлов. Однако при нагревании смеси Н2:О2 = 2:1 (так называемый гремучий газ) взрыв:
2Н2+О2=2Н2О+ Н, Н 298=-241,8 кДж 1моль Н2О.

2. Промышленные методы получения оксида углерода и синтез-газа
Первые промышленные методы получения оксида углерода и синтез-газа базировались на газификации угля. В настоящее время преобладают варианты получения синтез-газа каталитической и высокотемпературной конверсией углеводородов. Сырьем в этом случае служат метан, природный газ и жидкие фракции нефти.
Соотношение СО и Н2 в синтез-газе для использования его в органическом синтезе
удовлетворительна в пределах от 1 : 1 до 1 : (2,0÷2,3) об.
В настоящее время СО и Н2 тоже выделяют из синтез-газа.

2.1 Получение синтез-газа газификацией угля
Методов получения синтез-газа газификацией угля несколько. Рассмотрим наиболее совершенный и имеющий практическое применение метод. Он основывается на взаимодействии с углем водяного пара по обратимой эндотермической реакции:
Эндотермичность реакции (9) компенсируется теплом сгорания угля, происходящего при непрерывном продувании парокислородной смеси в газогенератор
Равновесие смещается вправо при 1000÷1100 С, когда скорость процесса является достаточно высокой. Одновременно происходит конверсия СО в СО2 водяным паром, причем состав газа близок к равновесному

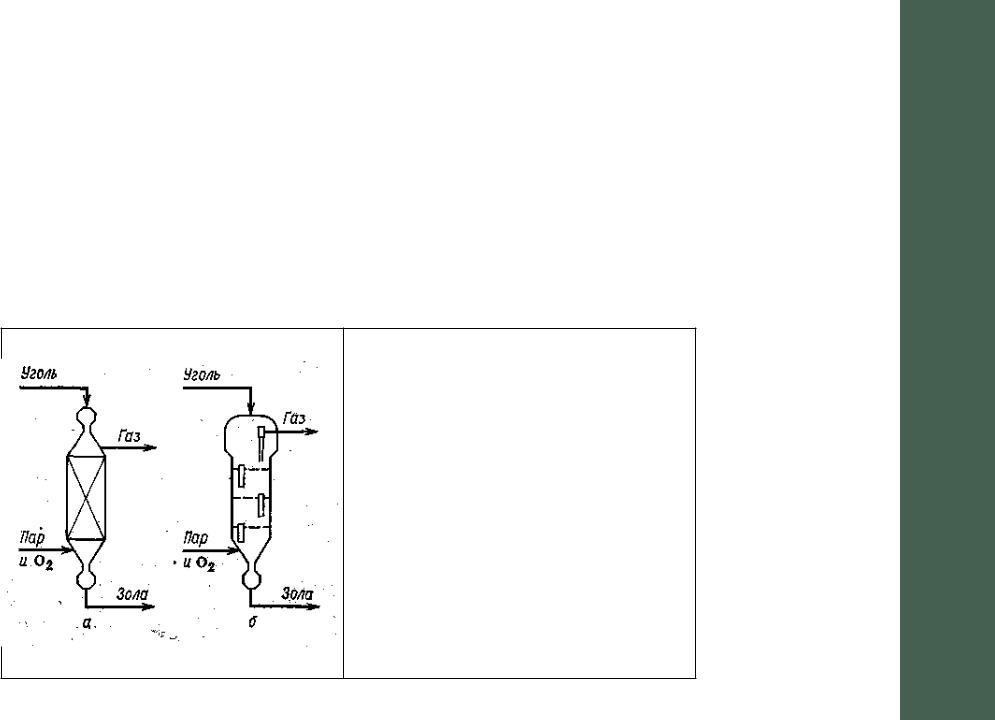
В качестве реакционных узлов преимущественно используются две конструкции газогенераторов (см. рис. 1 «а» и «б»). В первой из них слой мелкокускового угля перемещается сверху вниз по мере выгорания его нижних слоев противотоком к потоку парокислородной смеси. Это обеспечивает эффективное распределение различных стадий процесса по высоте генератора и рациональное использование тепла. Так, парогазовая смесь в нижней части генератора подогревается раскаленными остатками газификации. Выше располагается зона горения, где свежие порции угля быстро сгорают в токе кислорода. В верхней части находится собственно зона газификации, коксования и подсушки угля. В газогенераторе конструкции «б» мелкоизмельченный уголь находится в токе газов в псевдоожиженном состоянии. Противоток угля и газа происходит в каждой секции аппарата, в котором протекают также стадии подогрева парогазовой смеси, горения угля и собственно газификации и подсушки угля. Оба генератора футерованы огнеупорным кирпичом и имеют водяную рубашку.
Синтез-газ, выходя из генератора при 700÷800 С, проходит системы утилизации тепла, очистки от смол, сернистых соединений и диоксида углерода, затем его направляют потребителю. Для повышения производительности установок газификации, работающих при атмосферном давлении, стало использование давлений до 2÷3 МПа.
Недостатки: Большие капитальные вложения на стадиях измельчения и транспортировки угля и сложная система очистки синтез-газа.
Рис. 1. Газогенераторы для паро-кислородной конверсии угля «а» - газогенератор со
сплошным слоем угля; «б»-секционированный газогенератор с псевдоожиженным слоем угля.

2.2 Получение синтез-газа каталитической конверсией углеводородов
Синтез-газ по этому методу получают конверсией углеводорода водяным паром на катализаторе Ni на Аl2О3 по обратимой и эндотермической реакции при температуре 800÷900 С.
Равновесие в реакции (13) смещается вправо, как это видно из кривой 1 рис 6.2, при повышении температуры до 800÷900 С. Этому способствует также избыток водяного пара: при атмосферном давлении оптимальное объемное отношение пара к метану 2:1, а при повышенном давлении должно быть уже около 4:1.
Образующийся по реакции (14) СО конвертирует далее с водяным паром до СО2 по экзотермической реакции (16):
