
Лекция 42-1 Процессы конденсации по карбонильной группе
Теоретические основы реакций конденсации по карбонильной группе.
Технология получения дифенилолпропана.
Теоретические основы реакций конденсации по карбогруппе
Процессы присоединения и конденсации по карбонильной группе занимают очень важное место в промышленности основного органического и нефтехимического синтеза. Благодаря доступности многих альдегидов и кетонов и их высокой реакционной способности этим путем можно синтезировать мономеры и исходные вещества для получения полимерных материалов (дифенилолпропан, пентаэритрит и другие многоатомные спирты, изопрен, капролактам), промежуточные продукты органического синтеза (высшие спирты, альдегиды и кетоны), растворители (оксоланы; изобутилметилкетон) и многие другие ценные продукты.
О масштабах синтеза некоторых из перечисленных продуктов можно судить по их ежегодному производству в США: капролактам − свыше 500 тыс. т, 2-этилгексанол − около 400 тыс. т, дифенилолпропан −150 тыс. т, пентаэритрит − около 70 тыс. т, изобутилметилкетон − свыше 100 тыс. т и т. д.
Взаимодействие альдегидов и кетонов с различными веществами в зависимости от условий может остановиться на стадии присоединения этих веществ по карбонильной группе
![]()
может сопровождаться дальнейшей конденсацией со второй молекулой реагента и отщеплением воды, как, например, при образовании ацеталей
![]()
или завершиться внутримолекулярной дегидратацией, что особенно характерно для реакций с азотистыми основаниями:
![]()
Важнейшие из этих процессов можно свести к двум основным типам.
1. Реакции альдегидов и кетонов с основаниями в широком смысле; к ним относятся соединения с неподеленными электронными парами на гетероатоме (азотистые основания, спирты) и π-электронными системами (олефины, ароматические соединения). Активирование карбонильной группы в этом случае достигается чаще всего при помощи протонных кислот (серной, соляной). Они протонируют кислородный атом карбонильной группы, вызывая появление частичного положительного заряда на атоме углерода и в итоге образование иона карбония:
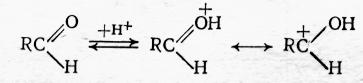
Ион карбония способен к прямой атаке другой молекулы, имеющей избыточную электронную плотность; этим и обусловлено протекание конденсации карбонильных соединений с ароматическими веществами, олефинами и т. д.
2. Реакции альдегидов и кетонов со слабыми кислотами (HCN) и псевдокислотами (карбонильные и нитросоединения и другие вещества с активированным атомом водорода), т. е. реакции альдольной конденсации в широком смысле слова. Для этих превращений характерен катализ щелочами и вообще основаниями, превращающими кислотный реагент в сопряженное ему основание, которое становится сильным нуклеофилом, способным к прямой атаке карбонильного углерода:
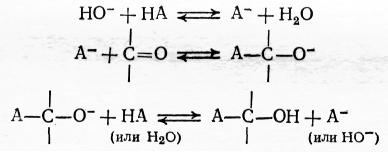
Реакционная способность карбонильных соединений во всех рассмотренных превращениях зависит от степени поляризации карбонильной группы, т. е. от величины частичного положительного заряда на углеродном атоме. Поскольку алкильные группы оказывают положительный индуктивный эффект, они в некоторой степени нейтрализуют этот заряд. Следовательно, у альдегидов удлинение и разветвление алкильной группы ведет к снижению реакционной способности, а введение в нее атомов хлора − к ее повышению:
![]()
Кетоны обладают значительно меньшей реакционной способностью вследствие индуктивного влияния двух алкильных групп:
![]()
Результат и условия реакции зависят, конечно, и от активности компонента, атакующего карбонильную группу.
Все реакции конденсации по карбонильной группе экзотермичны, но по величине теплового эффекта их можно разделить на две большие группы. К первой относятся сильно экзотермические и практически необратимые реакции конденсации карбонильных соединений с ароматическими веществами и олефинами (тепловой эффект 104÷106 кДж/моль, или 25÷35 ккал/моль). Ко второй принадлежат обратимые процессы образования ацеталей и циангидринов, собственно альдольные конденсации и реакции с азотистыми основаниями. Стадия присоединения в этих обратимых реакциях имеет сравнительно небольшой тепловой эффект (21÷63 кДж/моль, или 5÷15 ккал/моль), но из-за последующих реакций конденсации или дегидратации он может значительно изменяться в ту или другую сторону, определяя равновесные отношения суммарного процесса. Обычно равновесие значительно смещается вправо, когда за присоединением следует дегидратация или когда образуются сравнительно стабильные вещества с пяти-шестичленными циклами.
Конденсация альдегидов и кетонов с ароматическими соединениями
Реакции альдегидов и кетонов с ароматическими соединениями имеют много сходства с процессами алкилирования и тоже принадлежат к реакциям электрофильного замещения. Обычными катализаторами являются протонные кислоты (серная, сульфокислоты, хлористый водород, катионообменные смолы), которые переводят карбонильные соединения в положительно заряженный ион, атакующий далее ароматическое ядро через промежуточное образование π- и σ-комплексов:
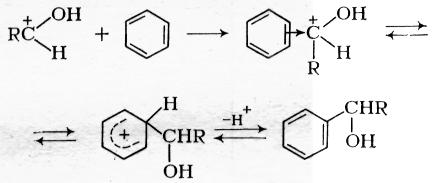
Образовавшийся ароматический спирт в условиях кислотного катализа реагирует дальше по типу процессов алкилировании спиртами и дает диарилалкан:
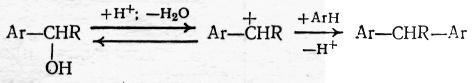
Применение апротонных кислот в качестве катализаторов менее эффективно, поскольку они разлагаются выделяющейся водой. Однако при хлорметилировании нередко используют протонную кислоту (НС1) в сочетании с хлористым цинком, что повышает кислотность системы:
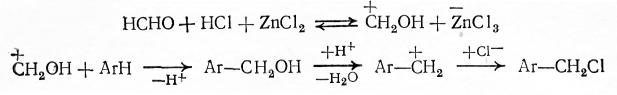
Реакционная способность карбонильных и ароматических соединений изменяется в данных процессах в обычном порядке. Галогенбензолы еще способны к этим превращениям, но ароматические вещества с более электроотрицательными группами в реакцию не вступают. Наоборот, фенол взаимодействует с реакционно-способными альдегидами (особенно с формальдегидом) не только при кислотном катализе, но и при щелочном, что обусловлено переходом фенола в более активную форму фенолята, способного прямо взаимодействовать с альдегидом:
![]()
На таких реакциях фенолов основано получение феноло-альдегидных полимеров.
Кинетика этих реакций при кислотном катализе удовлетворяет уравнению r= kaH +[ArH][RCHO],
показывающему, что самой медленной стадией является взаимодействие молекулы альдегида, активированной протоном, с ароматическим соединением.
Ориентация вступающей группы такая же, как и при других процессах электрофильного замещения в ядро: с хлорбензолом, фенолом и алкилбензолами получаются главным образом пара-изомеры с небольшой примесью орто-замещенного соединения.
Побочными продуктами конденсации карбонильных соединений с ароматическими являются ди- и полизамещенные вещества, т.к. первоначально образовавшиеся соединения способны к дальнейшему взаимодействию с альдегидом или кетоном:
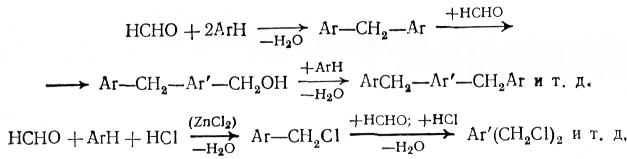
Для уменьшения образования этих веществ применяют избыток аренов.
