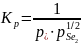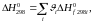- •Аннотация
- •Введение
- •1 Краткое описание структуры, свойств и применения соединения
- •Описание структуры
- •Свойства селенида германия
- •Применение селенида германия
- •Данные для термодинамического анализа
- •Aнализ основного процесса
- •Расчет параметров реакции при стандартных условиях
- •Расчет параметров реакции при произвольно выбранных температурах
- •2.3 Выбор рабочей точки и анализ условий протекания процесса
- •Анализ процессов сублимации
- •3.1 Анализ сублимации олова Ge
- •Анализ сублимации
- •Построение Pi – t диаграмм и оценка диапазона изменения соотношения давлений реагирующих веществ
- •4.1 Определение границ области гомогенности для двух компонентов
- •4.2 Определение линии стехиометрии и построение pi – t-диаграмм
- •Нахождение парциальных давлений паров и температур компонентов
- •5.1 Расчет давлений двух компонентов
- •Расчет рабочих температур двух компонентов
- •Оценка возможности окисления компонента а
- •Заключение
- •Список литературы
Данные для термодинамического анализа
Таблица 1 – Исходные термодинамические данные [3]
|
|
|
|
|
|
|
|
|
|
||||||
|
-82,5 |
78,2 |
45,1 |
16,4 |
-33,1 |
948 |
1143 |
|
0 |
31,1 |
23,35 |
3,9 |
- |
1210 |
3104 |
|
374,5 |
167,8 |
29,47 |
-3,66 |
- |
- |
- |
|
0 |
42,3 |
17,89 |
25,1 |
6,7 |
493 |
958 |
|
136,7 |
243,6 |
21,46 |
1,51 |
- |
- |
- |
|
0 |
205,1 |
29,15 |
6,48 |
- |
55 |
0 |
|
-557,7 |
55,2 |
68,92 |
9,86 |
-476,5 |
1409 |
- |
Таблица 2 – Термодинамические свойства фазовых переходов [3]
Элемент |
Вид перехода |
|
|
|
Ge |
Плавление |
1210 |
36940 |
30,53 |
Ge |
Кипение |
3104 |
330900 |
106,60 |
Se |
Плавление |
493 |
6700 |
11,88 |
Se |
Кипение |
958 |
29288 |
30,543 |
Aнализ основного процесса
Расчет параметров реакции при стандартных условиях
Уравнение реакции имеет следующий вид
 =
=
Константа равновесия основного процесса вычисляется по формуле:
|
|
где
 и
и
 –
парциальные равновесные давления
веществ
–
парциальные равновесные давления
веществ
 и
.
и
.
Расчет параметров реакции при температуре 298 К произведем по формулам (1), (2), (3) и (4):
При стандартных условиях изменение энергии Гиббса находится по уравнению Гиббса-Гельмгольца
|
(1) |
где
 –
тепловой
эффект реакции (изменение энтальпии)
при 298 K;
–
тепловой
эффект реакции (изменение энтальпии)
при 298 K;
 – изменение
энтропии при 298 K.
– изменение
энтропии при 298 K.
Расчет необходимых термодинамических параметров реакции при стандартных условиях проводится по формулам (2), (3) и (4)
Энтальпия системы:
|
(2) |
где
 – количество вещества i-го
элемента;
– количество вещества i-го
элемента;
 – энтальпия
образования i-го
вещества.
– энтальпия
образования i-го
вещества.
|
(3) |
Энтропия системы:
где
 –
энтропия
образования i-го
вещества.
–
энтропия
образования i-го
вещества.
|
(4) |
где
 – удельная теплоемкость i-го
элемента,
– удельная теплоемкость i-го
элемента,
 .
.
Произведем расчет параметров





Тогда изменение энергии Гиббса при стандартных условиях по формуле (1):

Логарифм константы равновесия рассчитаем, исходя из формулы (5):
|
(5) |
где
 – универсальная газовая постоянная.
– универсальная газовая постоянная.
 – изменение
энергии Гиббса;
– изменение
энергии Гиббса;






 ,К
,К ,К
,К








 ,К
,К