
- •56. Поляризация и перенапряжение при электролизе.
- •Концентрационная поляризация.
- •Химическая поляризация.
- •57. Классификация химических источников тока.
- •58. Коррозия металлов. Химическая и электрохимическая коррозия.
- •59. Основные методы борьбы с коррозией. Почвенная коррозия.
- •Влияние влажности грунта на почвенную коррозию металла.
- •Пористость (воздухопроницаемость) грунта
- •Кислотность грунта.
- •Электропроводность грунта.
- •Минералогический состав и неоднородность грунта.
- •Температура грунта
- •Влияние микроорганизмов на почвенную коррозию металлов.
- •Нанесение защитных покрытий. Изоляция
- •Создание искусственной атмосферы
- •Электрохимическая защита металла от почвенной коррозии
- •Специальные методы укладки
- •60. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •5. Смешанная связь.
56. Поляризация и перенапряжение при электролизе.
ПОЛЯРИЗАЦИЯ в электрохимии, отклонение значения электродного потенциала от равновесного при пропускании электрического тока. Величина поляризации зависит от плотности тока i, т.е. силы тока, отнесенной к единице поверхности электрода, и обычно тем больше, чем больше i. При одном и том же значении i поляризация зависит от природы электрода и типа протекающей на его поверхности реакции, состава раствора, температуры и др. факторов и может колебаться от долей мВ до нескольких В. Знак поляризации зависит от направления протекания тока и при изменении направления меняется на обратный.
Причиной поляризации служит малая скорость одной или нескольких стадий суммарного электродного процесса. Если лимитирующей стадией является подвод реагирующего вещества к поверхности электрода, поляризация обусловлена тем, что из-за протекания тока концентрация cs вещества у поверхности отличается от объемной концентрации сu (концентрационная поляризация). В простейшем случае разряда ионов металла на электроде из того же металла или анодного растворения металла концентрационная поляризация
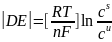 ,
,
где n-число электронов, участвующих в электродном процессе, T – температура, F – постоянная Фарадея, R - газовая постоянная.
При катодном осаждении металла DЕ < 0, при анодном растворении металла DЕ > С. Связь между величинами DЕ и i может быть выражена в виде:
![]()
где
iд -
предельный диффузионный ток, отвечающий
условию cs =
0. Из этого ур-ния следует, что при |DЕ| ![]()
 зависимость между i и DЕ линейна. При
больших отрицательных DЕ примерно i =
iд,
а при больших положительных DЕ (анодное
растворение металла) i экспоненциально
возрастает с ростом DЕ.
зависимость между i и DЕ линейна. При
больших отрицательных DЕ примерно i =
iд,
а при больших положительных DЕ (анодное
растворение металла) i экспоненциально
возрастает с ростом DЕ.
Перенапряжение электрохимическое, отклонение электродного потенциала от его равновесного (по отношению к приэлектродному составу раствора) термодинамического значения при поляризации электрода внешним током. При заметном удалении от равновесия перенапряжение (h) и плотность поляризующего тока (i) обычно связаны соотношением
h = а + b lg i (уравнение Тафеля),
где а и b — эмпирические постоянные. Перенапряжение зависит от температуры, природы электродного материала и состава раствора. Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов (см. Ингибиторы химические), что является одной из положительных сторон перенапряжения. В то же время перенапряжение в промышленном электролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.
Химическая и концентрационная поляризация при электролизе.
В процессе электролиза всегда возникает некоторая разность потенциалов между электродами, направленная противоположно той, которую мы накладываем извне. Это явление получило название поляризации.
