
Лабы Гульнову / ионоселективка (4)
.docxПРИМИНЕНИЕ ИОНОСЕЛЕКТВИНЫХ ЭЛЕКТРОДОВ ДЛЯ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
Мы намешали в начале неверно реагенты и вышла хуета, поэтому тут чисто можно посмотреть че мы делали и какие выводы можно написать, если вы тоже проебались
Аннотация
В ходе исследования установлено, что, поскольку теоретическая и практическая крутизна водородной функции электродов прибора равны, электроды находятся в исправном состоянии. Также точность проведенного эксперимента доказывает равенство теоретической и практической констант диссоциации лимонной кислоты. Установлено, что при разведении фосфатного буфера в два раза буферная емкость снижается: при добавлении щелочи буферная емкость раствора с меньшей концентрацией снижается в полтора раза, при добавлении кислоты – снижается в два раза. В ходе эксперимента также было выяснено, что буферная емкость исследуемой биологической жидкости находится ниже нормы.
Введение
Ионселективные электроды (ИСЭ) – это разновидность химических сенсоров; датчик, который дает прямую информацию о концентрации анализируемого объекта. ИСЭ отвечают всем основным требованиям, предъявляемым к химическим сенсорам (малые габариты, простота эксплуатации, обратимость процессов, возможность непрерывного измерения и автоматизированного использования).
Мембрана – основной компонент любого ИСЭ. Она разделяет внутренний раствор с постоянной концентрацией определяемого иона и исследуемый раствор. Одновременно мембрана служит средством электролитического контакта между ними. Мембрана обладает ионообменными свойствами, причем проницаемость ее к ионам разного типа различна. Таким образом, ИСЭ – это аналитические устройства, позволяющие с помощью ионочувствительной мембраны узнавать конкретный тип ионов и давать информацию об их количестве в виде электрического сигнала – потенциала, который связан с активностью (концентрацией) определяемого иона в анализируемом растворе.
Области применения ИСЭ чрезвычайно разнообразны. С помощью потенциометрических сенсоров можно решать как прикладные, так и фундаментальные задачи. Это изучение сложных равновесий, термодинамики растворов электролитов (определение коэффициентов активности), мониторинг конкретных ионов в проточных системах для автоматизированного контроля производственных процессов и объектов окружающей среды. Существенной особенностью ионометрии является определение активности ионов, что в сочетании с возможностью неразрушающего воздействия на анализируемый объект делает этот метод уникальным при проведении медико-биологических исследований.
Материалы и методы
pH-метр, центрифуга, буферные растворы различных концентраций, соляная кислота, щелочь NaOH.
Протокол эксперимента
Подготовка прибора к работе – электроды помещаются в дистиллированную воду на несколько минут (пока показания прибора не стабилизируются).
Определение крутизны водородной функции электродов прибора. Для этого используются буферные растворы с различными значениями pH, для каждого из которых измеряется величина потенциала электродной системы. После этого строится график экспериментальной зависимости потенциала φ от pH и определяется крутизна электродной функции в мВ/pH.
Определение константы диссоциации слабой кислоты. Проводится титрование раствора 10 мл р-ра лимонной кислоты концентрации 0.1М. Измеряется исходная величина pH, а затем добавляется последовательно по 0.5 мл раствора NaOH (0.1M) с фиксацией значений pH, пока они не превысят значение 7.5. На основании полученных данных определяются константы диссоциации исследуемой кислоты.
Определение буферной емкости растворов. Проводится титрование 10 мл фосфатного буфера концентрации 0.1М: а) соляной кислотой и б) щелочью NaOH в последовательности, описанной в п.2.3. Титрование прекращается тогда, когда рН раствора изменяется ровно на 1. Аналогично титруется 10 мл фосфатного буфера концентрацией 0.05 М. Далее вычисляется буферная емкость растворов согласна утверждению, что буферная емкость - это количество кислоты или щелочи (моль или ммоль), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Определение буферной емкости биологической жидкости на примере слюны. Проводится сбор слюны объемом 6 мл. Слюна разливается одинаковыми дозами в эппендорфы и центрифугируется в течение 20 мин на скорости 5000 об/с. Верхняя фракция собирается в пенициллиновый флакон с помощью микропипетки, при этом суммируется получившийся объем пробы. Проводится титрование образца слюны соляной кислотой концентрацией 0.1М, до тех пор, пока рН не сдвинется на 1. Буферная емкость слюны рассчитывается согласна определению, приведенному в п. 2.4.
Результаты
Определение крутизны водородной функции:
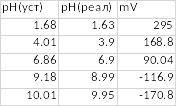
Таб.1. Данные для построения водородной функции стеклянного электрода.
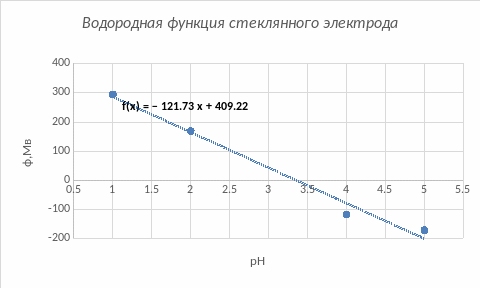
Рис.1. График водородной функции стеклянного электрода.
Теоретическое (58 мВ/pH) и практическое (54,8 мВ/pH) значения крутизны водородной функции примерно близки друг к другу. Это значит, что прибор исправен и готов к работе.
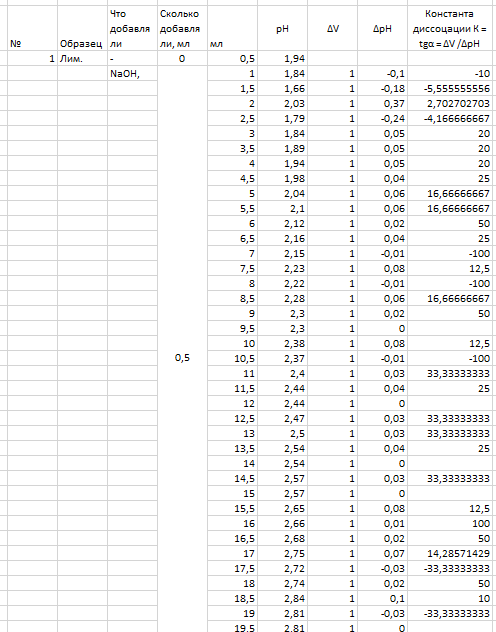
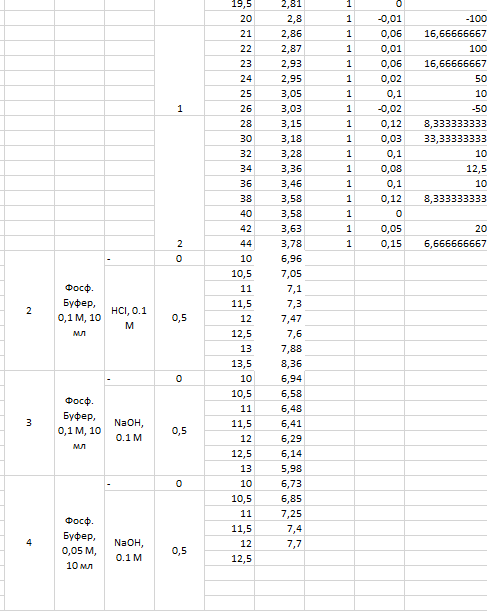
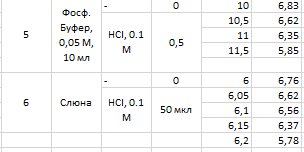
Таб.2. Экспериментальные данные и расчет константы диссоциации (по формуле tgα=ΔV/Δp).
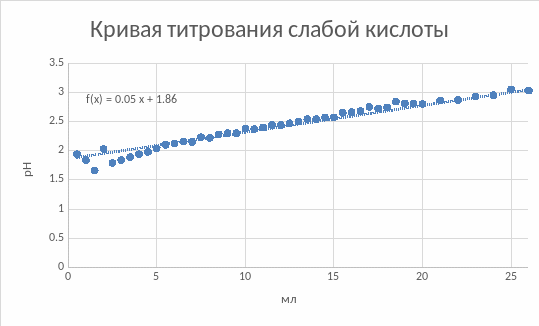
Рис.3. Кривая титрования лимонной кислоты.
В сравнении с теоретическими (3,128, 4,761 и 6,388).
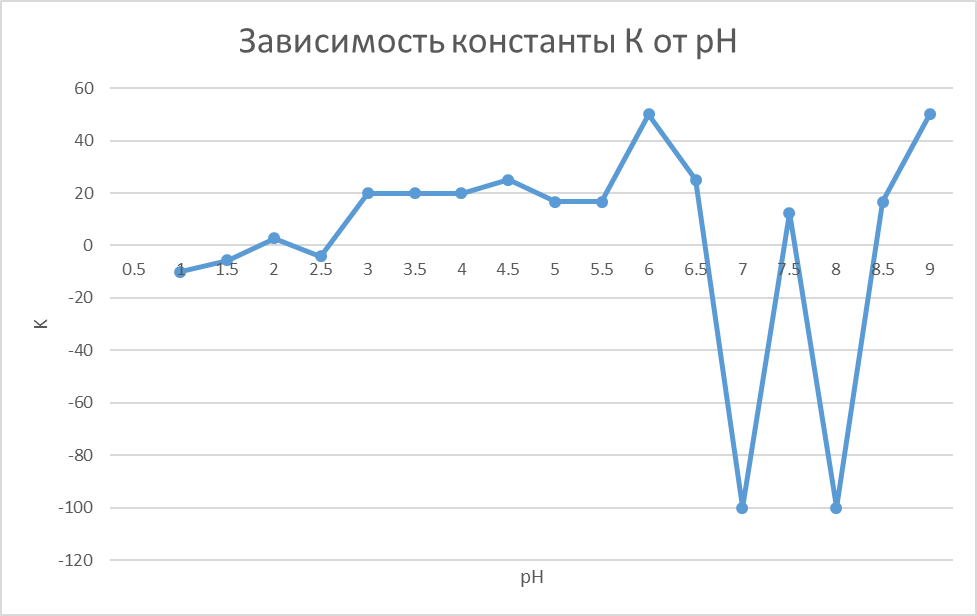
Рис.2. Зависимость tgα от pH.
Исходя из данных на рис. 3, максимумы константы диссоциации лимонной кислоты наблюдаются при pH, равном 6 и 9. Это определяется по пикам на графике.
Определение буферной емкости растворов:
Буфер |
Вещество |
Буферная ёмкость, моль/л |
фосфатный буфер, 0,1М |
NaOH 0,1 M |
0,03 |
фосфатный буфер, 0,1М |
НCl 0,1 М |
0,03 |
фосфатный буфер 0,05М |
НCl 0,1 М |
0,015 |
фосфатный буфер 0,05М |
NaOH 0,1 M |
0,02 |
Таб.3. Буферные емкости растворов.
Буферная емкость находилось по формуле:
В =
 ,
где
,
где
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф – объём буферного раствора,
∆рН – изменение рН.
Определение буферной емкости слюны:
Буферная емкость слюны = 0,0002/0,006=0,033333 моль/л.
Добавление 200 мкл кислоты привело к изменению pH на 0,98, следовательно, буферная емкость исследуемой слюны равна 0,0033 моль/л = 3,3 ммоль/л.
Обсуждение
Практическая крутизна водородной функции электродов прибора составила 54,8 мВ/рН, что достаточно близко к теоретическому значению (58 мВ/рН).
Кривая титрования напоминает прямую.
Максимумы константы диссоциации лимонной кислоты наблюдаются при pH, равном 6 и 9. В методическом указании рекомендовалось использовать растворы с рН 1,68, 3,56, 4,01, 6,85 и 9,13.
Кривая титрования лимонной кислоты в данном эксперименте вышла очень близкой к прямой линии.
Буферная емкость слюны 3,3 моль/л, что ниже нормы 4,45-4,65 ммоль/л.
Буферная емкость фосфатного буфера, 0,1М (0,03) примерна равна теоретическому значению (0,029).
Выводы
В крутизне водородной функции все реальные точки близки к теоретическим, кроме одной со значением 6,9, вероятнее всего это связано с тем, что электрод был недостаточное количество времени погружен в раствор.
Экспериментальные значения константы диссоциации лимонной кислоты не совпадают с теоретическими, в связи с ошибкой в расчетах навески.
Буферная емкость слюны ниже нормы, что может говорить о плохой нейтрализации кислоты.
Буферная емкость фосфатного буфера при разведении в 2 раза уменьшается в 2 и 1.5 раза. Наблюдаемая разница в уменьшении буферной ёмкости при титровании NaOH и HCl происходит из-за нелинейности кривой титрования и разного начального рН.
Если начальный рН буфера был больше pKa (буфер больше насыщен солью), добавление HCl сдвигает рН к pKa. В этой области кривая титрования может быть круче, чем в области, где рН меньше pKa. Это значает, что для изменения рН на единицу потребуется меньше количества HCl, чем NaOH. При разбавлении, уменьшение буферной емкости может быть меньше, чем двукратное, поскольку система уже находится в области более крутого участка кривой титрования.
