
Учебники / Глыбочко урология
.pdf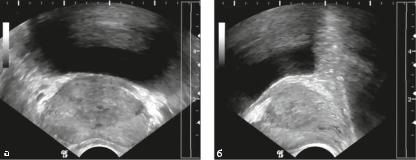
Гиперплазия простаты |
|
331 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 17.3. Трансректальная эхограмма при гиперплазии простаты
Трансректальное УЗИ (рис. 17.3) простаты можно выполнить и при опорожненном мочевом пузыре. Эхография с применением датчика, вводимого в прямую кишку, позволяет более точно оценить размер и изучить структуру простаты. При необходимости при трансректальном сканировании можно использовать режим ЦДК для оценки нарушений крово обращения в ткани простаты. Это особенно важно в диагностировании подозрительных на рак простаты гипоэхогенных и гиперваскуляризованных участков в периферической зоне железы.
Ультразвуковая микционная цистоуретроскопия в оценке динамических изменений шейки мочевого пузыря простатического отдела моче испускательного канала и простаты во время мочеиспускания может дать важную информацию о состоянии этих органов в процессе опорожнения мочевого пузыря. Визуализация расположения и смещения аденоматозной ткани простаты по отношению к уретре, «закладывание» мочеиспускательного канала средней или боковыми долями аденомы простаты дают возможность определить тактику лечения больного.
УЗИ почек позволяет диагностировать патологические изменения этих органов у больных с гиперплазией простаты.
Применение рентгенологических исследований (ЭУ, нисходящей или восходящей цистографии, микционной или ретроградной уретрографии) в настоящее время ограничено. В отдельных случаях как вспомогательный метод для дифференцировки гиперплазии и рака простаты используют МРТ малого таза с контрастированием.
О расстройствах мочеиспускания у больных с гиперплазией простаты судят на основании их жалоб, количестве остаточной мочи и результатах
332 |
|
Глава 17 |
|
|
|
оценки мочеиспускания. Простым ориентировочным тестом является определение средней скорости потока мочи (Q, мл/с). Для этого необходимы мерный сосуд и секундомер. Начиная мочиться в мерный сосуд, пациент включает секундомер, а заканчивая — выключает. Разделив объем выделенной мочи (V, мл) на время мочеиспускания (Т, с), можно получить среднюю скорость потока мочи. Показатель Q > 8–9 мл/с указывает на сохранное мочеиспускание.
Более точно о расстройствах мочеиспускания позволяет судить уро флоуметрия — исследование, дающее возможность суммарно оценить акт мочеиспускания. Важным условием достоверности результатов урофлоуметрии является то, что пациент должен испытывать адекватный позыв на мочеиспускание и наполнить мочевой пузырь минимум до 150 мл. Он мочится в специальный прибор — урофлоуметр. Основной параметр уро флоуметрии — максимальная объемная скорость потока мочи (Qмакс, мл/с). Значение более 15 мл/с указывает на адекватное мочеиспускание.
Среди лабораторных показателей нет характерных для гиперплазии простаты. Важной является оценка уровня ПСА в сыворотке, который служит маркером рака простаты. Повышение уровня ПСА > 4 нг/мл является весьма подозрительным в отношении возможного злокачественного поражения простаты. В этой ситуации показана биопсия простаты под ультразвуковым контролем с целью подтвердить или исключить рак.
Определение креатинина сыворотки является тестом, при повышении показателей которого можно предположить наличие ХПН. Развитие и прогрессирование ХПН требует незамедлительного восстановления нарушенного оттока мочи из мочевых путей.
Цистоскопия также рутинно не применяется для диагностики гиперплазии простаты. Однако эндоскопическое исследование обязательно показано при гематурии для исключения наличия сочетанной опухоли мочевого пузыря или уретры. При гиперплазии простаты макрогематурия может возникать из варикозно-расширенных вен слизистой оболочки шейки мочевого пузыря. Гиперплазированная простата определяется в виде до лей, покрытых слизистой мочеиспускательного канала, вдающихся в его просвет и вызывающих сдавление и деформацию уретры.
Дифференциальная диагностика. Гиперплазию простаты необходимо дифференцировать в первую очередь со злокачественным поражением — раком простаты, а также с хроническим простатитом и его исходом в склероз простаты. Следует также помнить о различных
Гиперплазия простаты |
|
333 |
|
|
|
заболеваниях, сопровождающихся расстройствами мочеиспускания: стриктура мочеиспускательного канала и нейрогенный мочевой пузырь.
Современные методы позволяют диагностировать гиперплазию простаты, оценить нарушения функций мочевых путей, к которым она привела, выявить осложнения заболевания, а следовательно, определить лечебную тактику.
Лечение. Выбор того или иного вида лечения при гиперплазии простаты осуществляется индивидуально с учетом возраста пациента, его сопутствующих заболеваний, выраженности клинических проявлений, размера и направления роста гиперплазированной простаты, наличия осложнений течения заболевания и других факторов.
Успехи в познании патогенеза гиперплазии простаты и достижения фармакологии привели к созданию медикаментозных средств для лечения гиперплазии простаты, обладающих патогенетическими механизмами действия. Их можно разделить на три группы.
1.α1-адреноблокаторы (альфузозин, доксазозин, тамсулозин, теразозин, силодозин). Препараты этой группы блокируют α1-адренорецепторы гиперплазированной простаты и тем самым ликвидируют динамиче-
ский компонент инфравезикальной обструкции. Воздействие на α1- адренорецепторы детрузора и его сосудов благоприятно влияет на кро-
вообращение стенки пузыря, повышает энергетические запасы клеток и улучшает сократительную способность мускулатуры мочевого пузыря. Данные препараты не уменьшают объем простаты и влияют только на симптомы. Они подходят для длительного непрерывного применения, но отмена препаратов приводит к быстрому возвращению исходных жалоб.
2. Ингибиторы 5-редуктазы (финастерид, дутастерид). Эти лекарственные средства блокируют 5α-редуктазу клеток простаты и прерывают звено метаболизма тестостерона в 5α-дигидротестостерон. Именно этот механизм ответствен за процессы собственно клеточной пролиферации. Таким образом, их применение останавливает рост гиперплазированной ткани и даже способствует ее медленному уменьшению в объеме. Недостатком препаратов является очень медленное развитие эффекта, а также возможные снижение либидо и эректильная дисфункция, которые, правда, возникают менее чем у 10 % пациентов.
3. Препараты растительного происхождения (липидостероловый экстракт пальмы ползучей, липидостероловый экстракт сливы африканской
334 |
|
Глава 17 |
|
|
|
идр.). Препараты растительного происхождения обладают сложными патогенетическими механизмами воздействия при гиперплазии простаты. Основными из них являются ингибирование активности 5α-редуктазы, противоотечное и противовоспалительное свойства
иблокирование тканевых факторов роста.
Комбинированная медикаментозная терапия (например, ингибиторами 5α-редуктазы и α-адреноблокаторами) позволяет более эффективно использовать патогенетически направленные свойства препаратов различных групп, воздействующих на различные патогенетические механизмы.
В последние годы в арсенал врача добавились новые эффективные возможности консервативного лечения симптомов нарушенного мочеиспускания у больных с гиперплазией простаты. М-холинолитики (толтеродин, фезотерадин, солифенацин) доказали свою эффективность при выраженных накопительных симптомах, а ингибиторы фосфодиэстеразы 5-го типа (тадалафил, силденафил и др.) продемонстрировали возможность снижения выраженности симптомов нарушенного мочеиспускания. Также расширились возможности различного рода комбинаций групп лекарственных средств, что позволяет воздействовать на различные патогенетические звенья.
К сожалению, медикаментозная терапия не позволяет излечить больного от гиперплазии простаты. Однако зачастую благодаря эффективной лекарственной терапии можно столь значительно повысить качество жизни пациента, что он отказывается от операции. Эффект, достигнутый при консервативной терапии, необходимо поддерживать повторными курсами медикаментозного лечения.
Единственным радикальным методом лечения является оперативный. При объеме гиперплазированной простаты более 80 см3 удаление аденомы может осуществляться из открытого доступа (позадилонная или чреспузырная аденомэктомия). В настоящее время данная операция выполняется также и лапароскопически, и робот-ассистированно. Однако «золотым стандартом» стали эндоскопические (трансуретральные) операции (рис. 17.4), выполняемые электрической петлей (трансуретральная моно- и биполярная электрорезекция, биполярная энуклеация гиперплазии простаты) или с применением лазера (лазерная вапоризация и лазерная энуклеация гиперплазии простаты). Независимо от вида операции ее суть сводится к удалению ткани гиперплазии до хирургической капсулы. При ТУР ткань железы удаляется послойно. Энуклеирующие методики подразумевают вылущивание одной или сразу обеих долей,

Гиперплазия простаты |
|
335 |
|
|
|
Рис. 17.4. Схема трансуретральной резекции гиперплазии простаты
двигаясь инструментом сразу вдоль капсулы. Такая техника имеет преимущества при большом объеме простаты, т. к. позволяет добиться меньшей кровопотери и сокращения времени операции.
Показаниями к операции являются:
■объем остаточной мочи более 50 мл;
■эпизод острой задержки мочи в анамнезе;
■жалобы на дизурию, несмотря на проводимую медикаментозную терапию, при наличии сниженной скорости мочеиспускания по данным урофлоуметрии;
■камни мочевого пузыря, сформировавшиеся вследствие хронической задержки мочи;
■в отдельных случаях — хронический, упорно рецидивирующий простатит на фоне гиперплазии простаты.
Казалось бы, крайне заманчиво быстро и легко избавиться от гипер-
плазированной простаты оперативным путем. Однако приблизительно у 30 % больных сохраняются жалобы, которые беспокоили до операции. Кроме того, любое оперативное вмешательство у пожилого мужчины

336 |
|
Глава 17 |
|
|
|
с различными сопутствующими заболеваниями может представлять значительный риск в отношении возможности развития осложнений и даже угрозы жизни пациента.
Именно поэтому в последнее время много внимания уделяется разработке малоинвазивных технологий. К ним можно отнести:
■трансуретральную микроволновую термотерапию;
■трансуретральное электрочастотное воздействие;
■установку простатических стентов и систем UroLift.
Они обладают достаточно высокой эффективностью, но значительно
меньшим риском серьезных осложнений. В случае неэффективности медикаментозной терапии и невозможности оперативного удаления гиперплазированной простаты такие малоинвазивные технологии могут стать выходом для пациентов с соматически отягощенным статусом.
Важно помнить, что никакой из методов лечения гиперплазии простаты, в т. ч. хирургический, не предохраняет в дальнейшем от развития рака простаты, т. к. после ТУР и аденомэктомии остается определенный объем ткани простаты в периферии железы. Со временем там, так же как и в неоперированной железе, может возникнуть аденокарцинома. Поэтому даже больные после оперативного лечения гиперплазии простаты нуждаются в регулярном (1 раз в год) контроле уровня ПСА крови.
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ
■■ Гиперплазия простаты представляет собой доброкачественное разрастание ткани транзиторной (переходной, промежуточной) зоны простаты.
■■ Гиперплазия простаты является одним из наиболее распространенных заболеваний мужчин пожилого и старческого возраста.
■■ Развитие гиперплазии простаты происходит в результате гормональной дисре гуляции роста простаты. Важнейшее значение принадлежит нарушению гормо нальной регуляции роста клеток простаты андрогенами, эстрогенами и тканевыми факторами роста.
■■ Постепенное прогрессирующее разрастание ткани транзиторной зоны проста ты приводит к нарушению мочеиспускания вследствие механической и дина мической инфравезикальной обструкции. Это, в свою очередь, может лежать в основе тяжелых осложнений гиперплазии простаты: гнойно-воспалительного процесса в мочевых путях, необратимой утраты сократимости мочевого пузыря,

Гиперплазия простаты |
|
337 |
|
|
|
камней мочевого пузыря, ХПН и др. Доброкачественная гиперплазия простаты — отнюдь не безобидное заболевание.
■■ Диагноз гиперплазии простаты устанавливают на основании жалоб, данных пальцевого ректального, а также трансабдоминального и трансректального УЗИ. Нарушения мочеиспускания оценивают с помощью урофлоуметрии.
■■ В дифференциальной диагностике с раком простаты важное значение принад лежит нормальному показателю ПСА сыворотки (< 4 нг/мл). Это исследование необходимо выполнять всем мужчинам старше 50 лет.
■■ Выбор вида лечения — консервативного или оперативного — осуществляется индивидуально с учетом выраженности нарушений мочеиспускания и количе ства остаточной мочи, размера гиперплазированной простаты, возраста пациента и тяжести сопутствующих заболеваний.
■■ Единственным радикальным методом удаления ткани гиперплазированной про статы является операция — эндоскопическая (трансуретральная) резекция (или энуклеация) гиперплазии простаты или аденомэктомия (лапароскопическая, робот-ассистированная или открытая).
■■ Патогенетически направленная медикаментозная терапия — α1-адреноблокаторы, ингибиторы 5α-редуктазы, препараты растительного происхождения, М-холинолитики, ингибиторы фосфодиэстеразы 5-го типа и различные комби нации групп препаратов — позволяет эффективно помогать тем пациентам с гиперплазией простаты, которым оперативное лечение не показано или не может быть осуществлено.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. После какого возраста вероятно развитие гиперплазии простаты?
2. Каковы факторы риска прогрессирования гиперплазии простаты?
3. Каким способом разрешают острую задержку мочеиспускания?
4. Что называют «золотым стандартом» оперативного лечения больных с аденомой простаты?
5. По какому критерию стадируют гиперплазию простаты? Какие стадии выделяют? 6. Каковы показания к хирургическому лечению гиперплазии простаты?

18Рак простаты
Рак простаты (предстательной железы, РПЖ) обычно возникает у мужчин старше 50–60 лет. У лиц молодого возраста он встречается крайне редко. Исключение составляет саркома простаты. РПЖ поражает молодых людей и даже встречается в детском и юношеском возрасте, что связывают с эмбриональной этиологией опухоли.
Эпидемиология. РПЖ является одним из наиболее распространенных злокачественных заболеваний у мужчин. Ежегодно в мире регистрируют более 550 000 новых случаев РПЖ. Именно с этим связан тот факт, что диагностике и лечению данной патологии в последнее время уделяется все больше внимания как за рубежом, так и в России. Наиболее высокие показатели заболеваемости РПЖ отмечены в США, Канаде и в ряде стран Европы, где он выходит на 1-е место в структуре онкологических заболеваний. РПЖ занимает 2-е место в структуре заболеваемости злокачественными новообразованиями мужского населения России и составляет 14,3 %. У мужчин в возрасте старше 60 лет этот показатель увеличивается до 18,5 %. В 2014 г. в России выявлено 37 168 новых случаев РПЖ, при этом средний возраст мужчин с впервые диагностированным РПЖ составил 64,4 года (в 2003 г. этот показатель был несколько вы- ше — 70,4 года). Стандартизованный показатель заболеваемости РПЖ в 2014 г. в России составил 39,8 случая на 100 000 мужского населения. При среднегодовом темпе роста 7,11 % прирост заболеваемости РПЖ с 2004 по 2014 г. составил 116,68 %. У мужчин в возрасте 60–69 лет РПЖ является причиной смерти в 6,2 случая, а в возрастной группе старше 70 лет достигает 14,16 %, занимая 2-е место после опухолей трахеи, бронхов и легкого.
Этиология. Среди этиологических причин возникновения РПЖ выделяют генетическую предрасположенность и влияние канцерогенных факторов. Отмечено, что РПЖ гораздо чаще болеют европейцы и американцы,
338
Рак простаты |
|
339 |
|
|
|
нежели народы азиатского континента. На сегодня трудно определить, чем это обусловлено: характером питания, национальной культурой, образом жизни или чем-то иным. Имеются данные, что прием пищи, насыщенной животными жирами и богатой калориями, способствует развитию и прогрессированию РПЖ. Самый высокий риск развития этого заболевания у мужчин, которые потребляют в большом количестве молоко, сыр, яйца и мясо. Гораздо реже болеют вегетарианцы. Отмечено ингибирующее влияние соевой и рисовой диет, а также регулярный длительный прием витамина Е. Низкое содержание неко торых микроэлементов (селен, цинк) повышает риск заболевания РПЖ.
Патогенез заболевания во многом определяется функцией половых желез и концентрацией мужских половых гормонов (андрогенов) в сыворотке. Однако половая активность не влияет на риск развития РПЖ. Андрогены являются стимуляторами роста, развития и функциональной активности железы в норме. С возрастом у мужчин в простате увеличивается выработка 5α-редуктазы, отвечающей за перевод тестостерона в дигидротестостерон, что приводит к нарастанию уровня последнего в тканях железы. Дигидротестостерон, в свою очередь, индуцирует в простатических клетках синтез инсулиноподобного фактора роста. Образовавшиеся в достаточном количестве дигидротестостерон и инсулиноподобный фактор роста действуют аутокринно на стромальную клетку, а также паракринным путем достигают эпителиальные клетки простаты, усиливая в них синтез РНК белков. Таким образом, повышенное содержание дигидротестостерона в простате вполне может быть одним из пусковых механизмов как доброкачественных, так и злокачественных гиперпластических процессов. С открытием гена НРС1 (наследственный РПЖ 1) на хромосоме 1 доказана предрасположенность человека, носящего этот ген, к РПЖ.
В зависимости от формы, характера расположения железистых структур в опухоли и соотношения эпителиального и соединительнотканного компонентов гистологически различают несколько видов рака. Если РПЖ возникает из железистого эпителия, его называют аденокарциномой, если из плоского эпителия — плоскоклеточным. Тубулярный рак развивается из узких каналов, выстланных эпителием (кубическим или призматическим), в просвете которых может находиться секрет. Альвеолярный рак возникает за счет концевых отделов ветвящихся желез. Это так называемые дифференцированные формы рака.
340 |
|
Глава 18 |
|
|
|
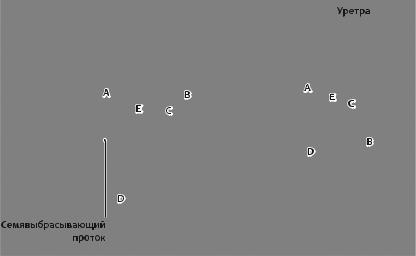
Рис. 18.1. Схема деления простаты на зоны:
A — центральная зона; B — фиброзно-мышечная строма; C — переходная зона; D — периферическая зона; E — периуретральная зона
Рак наиболее часто (90 %) развивается из периферических отделов (зон) простаты, в то время как гиперплазия — из центральной и транзиторной зон (рис. 18.1). Примерно в 50 % случаев отмечено сочетание рака и гиперплазии простаты.
Классификация. В основу современной клинической классификации TNM положены три критерия: величина первичной опухоли (Т) (рис. 18.2), наличие метастазов в регионарных лимфатических узлах (N), появление отдаленных метастазов (М).
Классификация рака простаты по системе TNM (2017)
Т — первичная опухоль Тх — первичная опухоль не может быть оценена.
T0 — первичная опухоль не определяется.
T1 — опухоль клинически не проявляется, не определяется, не пальпируется. Т1а — случайно обнаружена при гистологическом исследовании, составляет
≤ 5 % резецированной ткани.
