
|
МИНОБРНАУКИ РОССИИ |
Федеральное государственное бюджетное образовательное учреждение высшего образования «МИРЭА – Российский технологический университет» РТУ МИРЭА
|
Институт тонких химических технологий имени М.В. Ломоносова |
Реферат на тему:
«Катионные липосомы в генной терапии»
Работу выполнила студентка группы: ХБМО-01-24 Смирнова М.А.
Руководитель работы: Шастина Н.С.
Москва 2024
Оглавление
Список сокращений 2
Введение 3
Основная часть 4
Выводы 10
Список литературы 11
Список сокращений
ДНК-дезоксирибонуклеиновая кислота
НК-нуклеиновая кислота
Введение
Генная терапия представляет собой медицинское вмешательство, основанное на модификации генетического материала живых клеток. Клетки могут модифицироваться ex vivо или in vivo [1].
Одним из ключевых элементов успешной генной терапии является разработка эффективных систем доставки генов, способных преодолеть барьеры клеточной мембраны и доставить терапевтический генетический материал в целевые клетки.
Катионные липосомы – это искусственно синтезированные везикулы, состоящие из липидного бислоя, с поверхностным зарядом, обусловленным наличием катионных липидов. [2] Их способность образовывать комплексы с анионными молекулами ДНК, формируя липоплексы, делает их идеальными кандидатами для доставки генов. В этом реферате мы рассмотрим механизмы действия катионных липосом, проанализируем их преимущества и недостатки в качестве векторов доставки генов, а также проанализируем текущее состояние их применения в клинических испытаниях. Данный обзор представит аргументы в пользу того, что катионные липосомы представляют собой многообещающий инструмент в генной терапии.
Основная часть
Краткое описание генной терапии: Понятие генной терапии, цели и принципы. Основные направления генной терапии.
Потенциал генной терапии заключается в возможности коррекции генетических дефектов, лежащих в основе наследственных заболеваний, а также в усилении иммунного ответа против рака. Одним из наиболее перспективных применений генной терапии является лечение наследственных заболеваний. Например, муковисцидоз, гемофилия и болезнь Хантингтона вызваны мутациями в определенных генах [3]. Введение исправленной копии гена в клетки пациента может компенсировать дефектный ген и восстановить нормальную функцию. Это позволит значительно улучшить качество жизни пациентов и продлить ее. Помимо лечения наследственных заболеваний, генная терапия также имеет огромный потенциал в онкологии [4]. Она может быть использована для усиления иммунного ответа против опухолей, доставки генов, индуцирующих апоптоз раковых клеток, и даже для модификации иммунных клеток, чтобы они могли более эффективно уничтожать опухолевые клетки.
В подавляющем большинстве исследований для системной доставки НК в клетки используются вирусные векторы: ретровирусы, лентивирусы, аденовирусы и аденоассоциированные вирусы, которые характеризуются высокой эффективностью трансфекции клеток и обеспечивают высокий уровень экспрессии генов. Однако эти векторы имеют ряд недостатков: канцерогенность, иммуногенность, тропизм к широкому спектру клеток [5], а также трудозатратное получение.
Из-за существенных недостатков и были найдены способы для доставки НК при помощи липосом, так как у них отсутствуют ограничения в размере переносимых терапевтических НК, они просты в синтезе и их возможно модифицировать. Самый большой недостаток невирусных векторов – низкая эффективностью трансфекции. Одним из возможных вариантов решения данной проблемы является использование в качестве невирусных векторов липосом с их разнообразной морфологией, составом, способностью включать в себя многие терапевтические биомолекулы [6].
Катионные липосомы, рассматриваемые нами — это искусственные мембранные везикулы, которые состоят из липидного бислоя, содержащего катионные липиды. Регулируя величину поверхностного заряда липосом, путем изменения липидного состава, можно контролировать степень взаимодействия липосом с отрицательно заряженными НК. Образование данных структур обусловлено электростатическими взаимодействиями НК и липосом.
В ядре липосомы заключаются НК, которые могут регулировать клеточную экспрессию специфических генов, контролируя уровень экспрессии функциональных белков. К терапевтическим НК относятся малые интерферирующие РНК (small interfering RNA, siRNA), антисмысловые, антигенные и иммуностимулирующие олигодезоксирибонуклеотиды (ОДН), плазмидные ДНК (пДНК), а также рибозимы [7]. Одним из первых типов НК, рассматриваемых в качестве объекта генной терапии, были пДНК. Поверхность липосом может быть модифицирована РЕG, для увеличения стабильности [8].
Состав липосом, как говорилось ранее может различаться, в структуру липосом входят: фосфолипиды чаще, фосфатидилхолин (PC) и фосфатидилэтаноламин (PE), холестерин-увеличивает стабильность липосом и регулирует их текучесть, а также заряженные молекулы-катионные липиды. Среди катионных липидов для конструирования катионных липосом наиболее широко применяются: N-(1-(2,3-диолеилокси)пропил)-N,N,Nтриметиламмоний хлорид (DOTMA); N-(1-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмоний хлорид (DOTAP); 3β-[N-(N’,N’-диметиламиноэтан)-карбамоил]холестерин гидрохлорид (DC-Chol); диоктадециламидоглицилспермин (DOGS); 2,3-диолеилокси-N-[2-(сперминкарбоксамидо)- этил]-N,N-диметил-1-пропиламмоний пентафторацетат (DOSPA). Структурыне формулы данных веществ преведены на Рис. 1
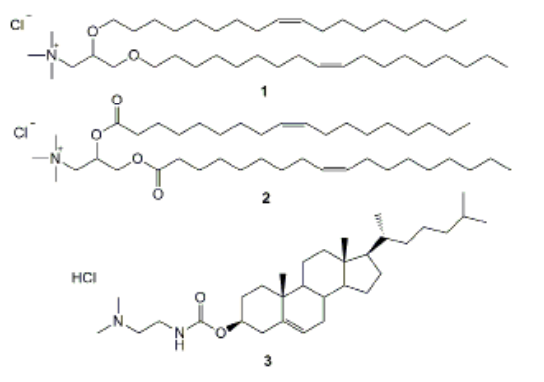
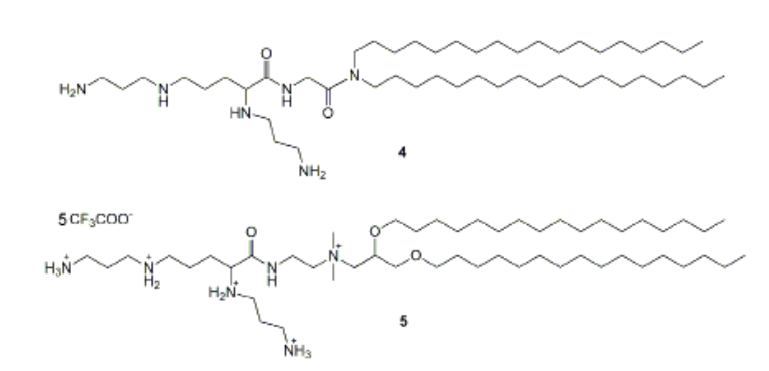
Рисунок 1. Структурные формулы 1-DOTMA; 2-DOTAP; 3-DC-Chol; 4-DOGS; 5-DOSPA.
Общепризнано, что проникновение липоплексов через клеточную мембрану обусловлено электростатическим взаимодействием между катионными липидами липоплексов и отрицательно заряженной поверхностью клетки [9]. Эндоцитоз является наиболее распространенным путем проникновения липоплексов и включает в себя множество механизмов поглощения, таких как клатрин- и кавеолин-опосредованный эндоцитоз; макропиноцитоз; а также пути, которые являются как клатрин-, так и кавеолин-независимыми. Дополнительный механизм поглощения – фагоцитоз – доступен лишь специальным клеткам, таким как макрофаги и дендритные клетки. «Выбор» механизма поглощения обусловлен размером поглощаемых липоплексов, типом трансфицируемых клеток и составом катионных липосом.
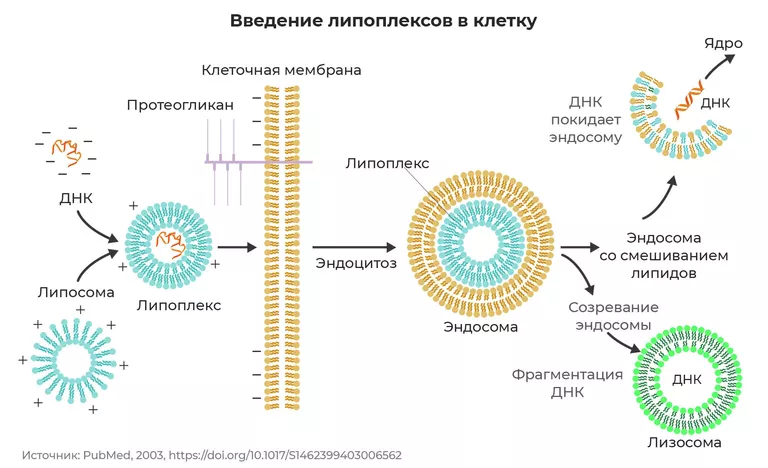
Рисунок 2. Механизм проникновения катионной липосомы через мембрану.
После проникновения внутрь клетки важным этапом транспортного пути липоплексов является их выход из эндосом. Существует несколько механизмов высвобождения НК. Липосомы на основе монокатионных липидов преимущественно высвобождают свое содержимое в цитозоль с помощью механизма липидного смешивания. Сущность данного механизма заключается в слиянии мембран липоплекса и эндосом; при этом катионные липиды стимулируют перемещение отрицательно заряженных фосфолипидов мембраны к внутренней поверхности эндосом. В результате происходит дестабилизация эндосомальной мембраны и высвобождение НК в цитоплазму [10]. Следует отметить, что наличие в составе липосом специальных липидов-хелперов способствует слиянию липоплексов с эндосомальной мембраной и ее дестабилизации.
Второй механизм высвобождения НК из липоплексов называется «эффектом протонной губки». Он характерен для катионных липидов, содержащих большое количество вторичных или третичных аминогрупп, которые имеют значения pKa между физиологическим и лизосомальным рН (обычно 5.5–6.0). При закислении среды внутри эндосом аминогруппы катионных липидов протонируются, что способствует дополнительному притоку несвязанных хлорид-анионов. Чтобы компенсировать увеличенное поглощение ионов, в эндосомы поступают дополнительные молекулы воды, вызывая ее осмотическое набухание и разрыв [10].
После высвобождения из эндосом и попадания в цитоплазму НК должна быть доставлена в целевой компартмент клетки для достижения желаемого биологического действия. Для НК, активность которых проявляется в цитоплазме, таких как олигодезоксирибонуклеотиды и siRNA, этот барьер неактуален, а для пДНК целевым компартментом является ядро.
Подвижность больших молекул, таких как пДНК, в цитоплазме чрезвычайно низка, что делает их восприимчивыми к деградации под действием цитоплазматических нуклеаз. Определяющим фактором для скорости передвижения пДНК через цитоплазму является размер и структура молекулы пДНК; кольцевая пДНК движется быстрее, чем линейная [11]. Влияние плотности упаковки пДНК на эффективность доставки изучено недостаточно, однако уплотнение структуры может приводить к повышению подвижности и устойчивости пДНК к цитоплазматическим нуклеазам.
Наконец, для экспрессии пДНК требуется преодоление последнего внутриклеточного барьера – ядерной мембраны. При делении клеток пДНК могут проникать в ядро во время нарушения целостности ядерной мембраны; однако в неделящихся клетках пДНК проходят сквозь мембрану через комплекс ядерных пор, который способен переносить молекулы размером до 9 нм и массой менее 40 кДа путем свободной диффузии [12]. Введение в состав липоплексов пептидной последовательности «сигнала ядерной локализации» способствует более эффективному переносу пДНК через ядерную мембрану [10]. Таким образом, при проведении трансфекции клеток липоплексами необходимо учитывать не только их характеристики, но и существование внеклеточных и внутриклеточных барьеров.
Катионные липосомы являются одним из самых универсальных инструментов для доставки нуклеиновых кислот в клетки, однако применение липосом для целей генной терапии ограничено неспецифичностью такой доставки. Это связано с наличием различных биологических барьеров на пути комплекса липосом с нуклеиновыми кислотами; например, с нестабильностью в биологических жидкостях; взаимодействиями с белками сыворотки крови, плазматической и ядерной мембранами; а также с эндосомной деградацией.
Не смотря на перечисленные недостатки, так как катионные липосомы имеют ряд преимуществ относительно других носителей, они успешно используются в промышленности. На сегодняшний день существует ряд коммерческих препаратов на основе катионных липидов: липофектамины (Lipofectamine 2000, Lipofectamine 3000, Lipofectamine RNAiMAX, Lipofectamine MessengerMAX, Lipofectamine CRISPRMAX, Lipofectamine LTX, Lipofectamine Stem), липофектин (Lipofectin), липофектейс (LipofectACE), трансфектейс (TransfectACE), трансфектам (Transfectam), селлфектин (Cellfectin и Cellfectin II) и др. [13,14,15]. C момента запуска в масштабное производство в 1993 году липофектамин и его аналоги наиболее часто используются для трансфекции клеток. Обладая высокой эффективностью трансфекции широкого диапазона клеточных линий и способностью переносить различные типы НК, липофектамины считаются «золотым стандартом» среди трансфицирующих реагентов и наиболее часто используются для сравнительной оценки эффективности при разработке как новых КЛ, так и альтернативных методов трансфекции [16]. Lipofectamine 2000 (Lf 2000) представляет собой смесь поликатионнного липида 5 и нейтрального липида DOPE в мольном соотношении 3:1 [17]. При выборе подходящего трансфицирующего агента необходимо учитывать тип доставляемой НК. Существуют универсальные реагенты Lf 2000 и Lf 3000, которые используются для доставки ДНК и РНК. Lipofectamine RNAiMAX и Lipofectamine MessengerMAX были разработаны специально для трансфекции клеток siRNA и микроРНК, соответственно [18,19].
Выводы
Катионные липосомы, особенно Липофектамины, представляют собой мощный инструмент для доставки нуклеиновых кислот, широко применяемый в современных биомедицинских исследованиях и практических приложениях. Их способность образовывать комплексы с нуклеиновыми кислотами, а затем проникать в клетки, делает их идеальными векторами для генной терапии, доставки siRNA и вакцинации. Однако, несмотря на свою эффективность, Липофектамины могут вызывать токсические эффекты и не всегда достигают желаемого уровня доставки в целевые ткани. Поэтому дальнейшие исследования направлены на оптимизацию состава и структуры катионных липосом, чтобы повысить эффективность доставки, снизить токсичность и обеспечить адресную доставку нуклеиновых кислот в клетки-мишени.

