
- •0. Вопрос без вопроса блять, но ранее был первым, теперь лох. Законы, регулирующие обращение лекарственных средств в рф, и их характеристика.
- •1. Государственный контроль в сфере обращения лекарственных средств в рф.
- •2. Понятие качества лекарственных средств и определяющие его факторы.
- •3. Пути обеспечения качества лекарственных средств.
- •4. Перечислите и охарактеризуйте основные требования к производству лс в соответствии с gmp.
- •5. Каковы различия в понятиях «Контроль качества» и «Система обеспечения качества лс» и фишка нового года «Управления качеством лс»?
- •6. Преимущества перехода отечественных фармацевтических предприятий на выпуск продукции в соответствии с правилами gmp для производителей и потребителей.
- •7. Охарактеризуйте виды отношений при обращении лекарственных средств, которые регулируются фз «Об обращении лекарственных средств»
- •8. Статус, назначение и характеристика Государственной фармакопеи рф.
- •9. Понятие фармакопейной статьи и ее требования к лекарственному средству. Приведите примеры.
- •Фармацевтическая субстанция:
- •Лекарственный препарат
- •10. Нормативная документация, регламентирующая производство и качество лекарственных препаратов
- •11. Охарактеризуйте систему стандартов gxp.
- •12. Перечислите и обоснуйте основные лицензионные требования и условия при осуществлении деятельности по производству лекарственных средств.
- •13. Опишите порядок государственной регистрации лекарственных средств в рф.
- •14. Охарактеризуйте препараты, подлежащие и не подлежащие государственной регистрации в рф. Для каких лекарственных средств проводится ускоренная экспертиза?
- •15. Охарактеризуйте информацию, содержащуюся в регистрационном удостоверении лекарственного препарата. Кем выдается этот документ и на какой срок?
- •16. Что такое гармонизация системы технического регулирования в сфере обращения лекарственных средств?
- •17. Охарактеризуйте этапы создания лекарственного препарата.
- •18. Охарактеризуйте этапы испытания лекарственного средства.
- •19. Порядок проведения клинических испытаний в рф.
- •20. Как осуществляется регистрация лекарственного средства и в соответствии с какими нормативными документами?
- •21. Охарактеризуйте правила лабораторной практики (glp).
- •22. Дайте развернутую характеристику правил клинической практики (gсp).
- •23. Перечислите основные требования правил gmp к производству лекарственных средств.
- •24. Требования к качеству лекарственных веществ, вспомогательных веществ и материалов
- •25. Требования gmp к процессу производства готовых лекарственных препаратов
- •26. Способы очистки и стерилизации воздуха. Механизмы осаждения частиц аэрозоля на волокнистых фильтрах. Классификация воздушных фильтров.
- •27. Объекты, документация и методы самоинспекции.
- •28. Основные правила планировки производственных зданий в соответствии с gmp.
- •29. Виды производственных зон фармацевтического предприятия и требования к ним.
- •30. Требования gmp к оборудованию для производства лекарственных средств.
- •31. Предотвращение перекрестного загрязнения при производстве биотехнологических препаратов.
- •32. Виды стандартных операционных процедур в фармацевтическом производстве, принципы создания и содержание.
- •33. Классификация производственных помещений по классам чистоты. Требования к эксплуатации и обслуживанию чистых помещений.
- •34. Критерии отбора персонала при приеме на работу.
- •37. Опишите круг обязанностей руководящих работников фармацевтического предприятия.
- •37. Личная гигиена и обязанности персонала чистых помещений.
- •38. Организация работ по валидации. Этапы валидации. Виды валидации.
- •39. Определение стадий технологического процесса, требующих проверки при валидации. Документирование валидации технологического процесса.
- •40. Составные элементы фармацевтической системы качества.
- •41. Поясните важность принципа независимости службы производства и службы качества. Как на фармпредприятии обеспечивается реализация этого принципа gmp?
- •42. Функции отдела контроля качества фармпредприятия.
- •43. Определите понятие «Риск». Опишите основные виды рисков для качества лекарственного средства в фармацевтической отрасли.
- •44. Охарактеризуйте этапы управлением рисками для качества лекарственных средств.
- •45. Нормативная база управления качеством и обеспечения безопасности пищевой продукции в рф
- •Глава 3. Требования к процессам производства (изготовления), хранения, перевозки (транспортирования), реализации и утилизации пищевой продукции
- •46. Охарактеризуйте систему хассп и этапы ее функционирования.
- •47. Дайте определение терминов « контрольная точка» и «критический предел». Как их определяют?
- •Вопрос 3
- •1. Срок регистрации лекарственного средства закончился. Возможна его дальнейшая реализация? Если да, то, при каких условиях? Ответ обосновать.
- •4. Опишите последовательность действий фирмы-разработчика лекарственного средства при государственной регистрации этого лекарства
- •6. Объясните, почему лекарственные препараты-дженерики занимают значительную нишу на лекарственном рынке рф и других стран. Ответ обоснуйте.
- •7. Создание чистого помещения основано на принципе «комната в комнате». Поясните на примере зоны чистоты класса а, каким образом образуется рабочая зона чистого помещения.
- •8. Предложите и обоснуйте схему использования базовых элементов чистых помещений для операций, представляющих особый риск для качества продукции.
- •9. Какими приемами достигается обеспечение класса чистого помещения? Оцените эффективность ламинарного или турбулентного режимов течения стерильного воздуха в чистой зоне.
- •10. Предложите и обоснуйте оптимальную схему подбора фильтров очистки и стерилизации воздуха для чистых помещений (зон) класса а.
- •13. Кто является Уполномоченным лицом на фармацевтическом предприятии? Что входит в обязанности этого сотрудника? Кому могут быть, в случае необходимости, переданы его функции?
- •14. Кем, для чего и в какой форме создаются документы на фармацевтическом предприятии? Как работник получает информацию о проведении необходимых операций/действий и сообщает об их результатах?
- •Вопрос 44 как основа
- •17. Что отображает причинно-следственная диаграмма (диаграмма Исикавы)? На каком этапе управления рисками ее используют?
- •18. Объясните принцип ранжирования рисков. Какие действия следует предпринять, если уровень риска - а) высокий; б) средний; в) низкий?
17. Что отображает причинно-следственная диаграмма (диаграмма Исикавы)? На каком этапе управления рисками ее используют?
Диаграмма Исикавы
Причинно-следственная диаграмма, или диаграмма Исикавы, отображает причины и следствия определенной проблемы или ситуации. Диаграмма позволяет визуализировать различные факторы, которые могут привести к возникновению проблемы, и анализировать возможные взаимосвязи между ними. Диаграмма Исикавы часто используется на этапе управления рисками для идентификации и анализа причин возникновения определенного риска. С ее помощью можно определить основные факторы, которые могут повлиять на вероятность возникновения риска, и разработать соответствующие меры по его предотвращению или управлению. Таким образом, диаграмма Исикавы помогает в принятии информированных решений и планировании стратегий управления рисками.
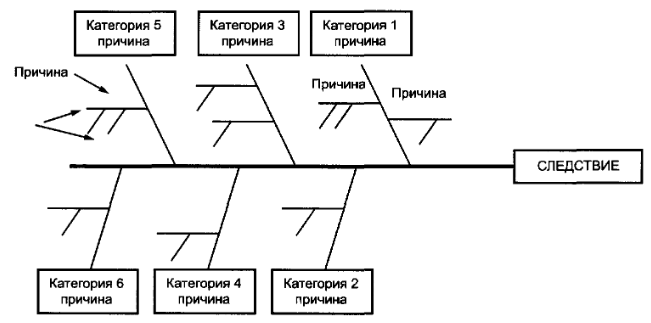
Диаграмма "рыбьего скелета" структурирована путем разделения причин на основные (главные) категории (представленные ребрами "рыбьего скелета") и более мелкими ответвлениями, конкретизирующими причины этих категорий
Качество
примера говно, но что есть
18. Объясните принцип ранжирования рисков. Какие действия следует предпринять, если уровень риска - а) высокий; б) средний; в) низкий?
Принцип ранжирования рисков предполагает классификацию и упорядочивание рисков по их важности и вероятности. Этот принцип основан на понимании, что не все риски имеют одинаковое влияние на организацию или проект, и некоторые риски являются более серьезными и вероятными, чем другие.
Процесс ранжирования рисков можно разделить на несколько шагов: 1. Идентификация рисков
2. Анализ рисков в виде убытков, временных задержек, ухудшения репутации и т.д. 3. Ранжирование рисков: упорядочивание рисков по их значимости с помощью определенных критериев. Это может быть основано на весе влияния риска, вероятности его возникновения или комбинации обоих факторов. Чем выше риск в рейтинге, тем более приоритетное внимание ему следует уделить. 4. Разработка стратегий управления рисками
Ранжирование рисков
Управление рисками: применение в производстве.
• классификация дефектов продукции: критические, существенные и прочие (канадская система)
• определение приоритетов в планах валидации, самоинспектирования
• Определение объема работы по расследованию отклонений и корректирующим действиям (САРА)
19. Как известно, по действующему законодательству процесс вывода на рынок лекарственного препарата занимает значительное время. Как Вы считаете, каким образом можно было бы сократить этот процесс? В каких случаях применяется облегченная процедура регистрации?
Существует несколько способов сократить процесс вывода на рынок лекарственного препарата, которые предприниматель может предпринять: 1. Подача заявки на ускоренное рассмотрение: В некоторых странах предприятие может подать заявку на ускоренное рассмотрение регистрационного досье. Это может сократить время процесса оценки и регистрации. 2. Проведение клинических исследований в странах с более гибкими правилами: Некоторые страны имеют более гибкие правила и процедуры для проведения клинических исследований. При выборе такой страны можно существенно сократить время получения данных, необходимых для регистрации. 3. Коллаборация с уже зарегистрированным лекарством: Если препарат содержит уже зарегистрированный активный ингредиент, можно рассмотреть возможность коллаборации с владельцем регистрации данного ингредиента для сокращения процедуры регистрации. Облегченная процедура регистрации может применяться в следующих случаях: 1. Биоэквивалентные препараты: Если препарат является биоэквивалентным или генерической версией уже зарегистрированного препарата, то процедура регистрации может быть упрощена и сокращена. 2. Срочная потребность: Если препарат обладает высокой медицинской значимостью и существует срочная потребность на рынке, то процедура регистрации может быть ускорена. 3. Известная активная субстанция: Если активная субстанция препарата уже известна и широко используется в других регистрированных препаратах, то процедура регистрации может быть облегчена. Однако, необходимо отметить, что каждая страна имеет свои правила и процедуры регистрации лекарственных препаратов, поэтому конкретные способы и облегченные процедуры могут различаться в зависимости от места регистрации.
20. Охарактеризуйте механизмы осаждения твердых частиц на волокнистых фильтрах. Частицы, какого размера обладают повышенной проницаемостью? По частицам какого размера проверяют эффективность воздушных фильтров?
Осаждение частиц на поверхности пор фильтрующего элемента происходит в результате совокупного действия эффекта зацепления, а также диффузионного, инерционно-го и механизмов. Пыль при фильтровании в основном задерживается в результате столкновения частиц с волокнами и нитями фильтровального материала и прилипания частиц к волокнам.
Касание. Частица переносится вдоль линии тока газа к нити или волокну (препятствию). Если частица движется мимо препятствия на расстоянии меньше своего радиуса, то она касается препятствия и захватывается.
Инерция. Частица находится на линии тока, следуя которой она прошла бы мимо препятствия, не касаясь его, но под действием инерции частица сходит с первоначальной линии тока. В результате она сталкивается с препятствием. Чем больше частица, тем больше ее инерция, лучше условия для захвата. При обычных скоростях течения в филь-трах этот механизм мало эффективен для частиц диаметром менее микрометра.
Диффузия. Частица настолько мала, что ее траектория становится хаотичной из-за броуновского движения. Захват может произойти, если случайное отклонение приводит частицу к волокну. Этот механизм становится наиболее важным, когда размер частиц меньше 0,1 мкм.
Ситовой эффект. Частица задерживается из-за того, что слишком велика, чтобы пройти через данную пору или канал.
Возможности осаждения за счет ситового эффекта, особенно при прохождении потока через чистую ткань, ограничены, т. к. в большинстве случаев размеры частиц значительно меньше размеров пор.
Воздушные фильтры в соответствии со своими характеристиками разделены на 6 группы:
Фильтры грубой очистки (gross) – G
• Фильтры тонкой очистки (fine) – F
• Фильтры средней очистки (medium) – М
• Фильтры EPA (Efficient Particulate Air filter) - Е
• Фильтры HEPA (High Efficiency Particulate Air) – H
• Фильтры ULPA (Ultra Low Penetration Air) - U
Размер частицы, для которой проскок является максимальным, называют размером наиболее проникающих частиц – Most Penetrating Particle Size (MPPS). MPPS зависит от скорости течения воздуха через фильтр (0,1–0,5 мкм).
Частицы с размерами от 0,1 до 1 микрона обладают повышенной проницаемостью, так как они находятся в указанном диапазоне размеров, где могут проникать через многие фильтры. Эффективность воздушных фильтров обычно проверяется с использованием частиц размером 0,3 микрона. Это размер частиц выбран в качестве худшего случая, так как частицы такого размера демонстрируют наименьшую вероятность задержки фильтрами и поэтому их использование позволяет оценить эффективность фильтра в значительной степени.
