
- •0. Вопрос без вопроса блять, но ранее был первым, теперь лох. Законы, регулирующие обращение лекарственных средств в рф, и их характеристика.
- •1. Государственный контроль в сфере обращения лекарственных средств в рф.
- •2. Понятие качества лекарственных средств и определяющие его факторы.
- •3. Пути обеспечения качества лекарственных средств.
- •4. Перечислите и охарактеризуйте основные требования к производству лс в соответствии с gmp.
- •5. Каковы различия в понятиях «Контроль качества» и «Система обеспечения качества лс» и фишка нового года «Управления качеством лс»?
- •6. Преимущества перехода отечественных фармацевтических предприятий на выпуск продукции в соответствии с правилами gmp для производителей и потребителей.
- •7. Охарактеризуйте виды отношений при обращении лекарственных средств, которые регулируются фз «Об обращении лекарственных средств»
- •8. Статус, назначение и характеристика Государственной фармакопеи рф.
- •9. Понятие фармакопейной статьи и ее требования к лекарственному средству. Приведите примеры.
- •Фармацевтическая субстанция:
- •Лекарственный препарат
- •10. Нормативная документация, регламентирующая производство и качество лекарственных препаратов
- •11. Охарактеризуйте систему стандартов gxp.
- •12. Перечислите и обоснуйте основные лицензионные требования и условия при осуществлении деятельности по производству лекарственных средств.
- •13. Опишите порядок государственной регистрации лекарственных средств в рф.
- •14. Охарактеризуйте препараты, подлежащие и не подлежащие государственной регистрации в рф. Для каких лекарственных средств проводится ускоренная экспертиза?
- •15. Охарактеризуйте информацию, содержащуюся в регистрационном удостоверении лекарственного препарата. Кем выдается этот документ и на какой срок?
- •16. Что такое гармонизация системы технического регулирования в сфере обращения лекарственных средств?
- •17. Охарактеризуйте этапы создания лекарственного препарата.
- •18. Охарактеризуйте этапы испытания лекарственного средства.
- •19. Порядок проведения клинических испытаний в рф.
- •20. Как осуществляется регистрация лекарственного средства и в соответствии с какими нормативными документами?
- •21. Охарактеризуйте правила лабораторной практики (glp).
- •22. Дайте развернутую характеристику правил клинической практики (gсp).
- •23. Перечислите основные требования правил gmp к производству лекарственных средств.
- •24. Требования к качеству лекарственных веществ, вспомогательных веществ и материалов
- •25. Требования gmp к процессу производства готовых лекарственных препаратов
- •26. Способы очистки и стерилизации воздуха. Механизмы осаждения частиц аэрозоля на волокнистых фильтрах. Классификация воздушных фильтров.
- •27. Объекты, документация и методы самоинспекции.
- •28. Основные правила планировки производственных зданий в соответствии с gmp.
- •29. Виды производственных зон фармацевтического предприятия и требования к ним.
- •30. Требования gmp к оборудованию для производства лекарственных средств.
- •31. Предотвращение перекрестного загрязнения при производстве биотехнологических препаратов.
- •32. Виды стандартных операционных процедур в фармацевтическом производстве, принципы создания и содержание.
- •33. Классификация производственных помещений по классам чистоты. Требования к эксплуатации и обслуживанию чистых помещений.
- •34. Критерии отбора персонала при приеме на работу.
- •37. Опишите круг обязанностей руководящих работников фармацевтического предприятия.
- •37. Личная гигиена и обязанности персонала чистых помещений.
- •38. Организация работ по валидации. Этапы валидации. Виды валидации.
- •39. Определение стадий технологического процесса, требующих проверки при валидации. Документирование валидации технологического процесса.
- •40. Составные элементы фармацевтической системы качества.
- •41. Поясните важность принципа независимости службы производства и службы качества. Как на фармпредприятии обеспечивается реализация этого принципа gmp?
- •42. Функции отдела контроля качества фармпредприятия.
- •43. Определите понятие «Риск». Опишите основные виды рисков для качества лекарственного средства в фармацевтической отрасли.
- •44. Охарактеризуйте этапы управлением рисками для качества лекарственных средств.
- •45. Нормативная база управления качеством и обеспечения безопасности пищевой продукции в рф
- •Глава 3. Требования к процессам производства (изготовления), хранения, перевозки (транспортирования), реализации и утилизации пищевой продукции
- •46. Охарактеризуйте систему хассп и этапы ее функционирования.
- •47. Дайте определение терминов « контрольная точка» и «критический предел». Как их определяют?
- •Вопрос 3
- •1. Срок регистрации лекарственного средства закончился. Возможна его дальнейшая реализация? Если да, то, при каких условиях? Ответ обосновать.
- •4. Опишите последовательность действий фирмы-разработчика лекарственного средства при государственной регистрации этого лекарства
- •6. Объясните, почему лекарственные препараты-дженерики занимают значительную нишу на лекарственном рынке рф и других стран. Ответ обоснуйте.
- •7. Создание чистого помещения основано на принципе «комната в комнате». Поясните на примере зоны чистоты класса а, каким образом образуется рабочая зона чистого помещения.
- •8. Предложите и обоснуйте схему использования базовых элементов чистых помещений для операций, представляющих особый риск для качества продукции.
- •9. Какими приемами достигается обеспечение класса чистого помещения? Оцените эффективность ламинарного или турбулентного режимов течения стерильного воздуха в чистой зоне.
- •10. Предложите и обоснуйте оптимальную схему подбора фильтров очистки и стерилизации воздуха для чистых помещений (зон) класса а.
- •13. Кто является Уполномоченным лицом на фармацевтическом предприятии? Что входит в обязанности этого сотрудника? Кому могут быть, в случае необходимости, переданы его функции?
- •14. Кем, для чего и в какой форме создаются документы на фармацевтическом предприятии? Как работник получает информацию о проведении необходимых операций/действий и сообщает об их результатах?
- •Вопрос 44 как основа
- •17. Что отображает причинно-следственная диаграмма (диаграмма Исикавы)? На каком этапе управления рисками ее используют?
- •18. Объясните принцип ранжирования рисков. Какие действия следует предпринять, если уровень риска - а) высокий; б) средний; в) низкий?
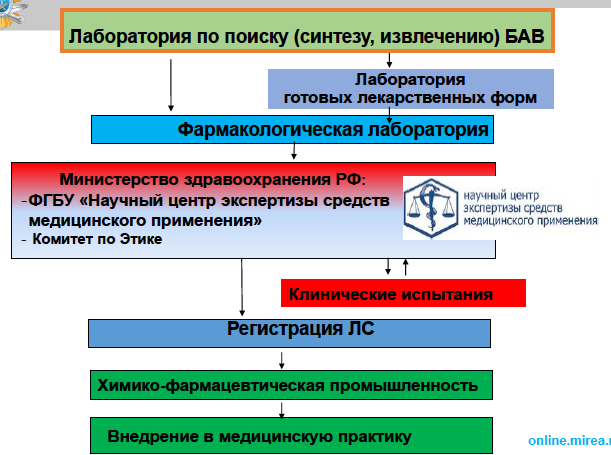
17. Охарактеризуйте этапы создания лекарственного препарата.
Поиск потенциального лекарственного средства
Тестирование лекарственного средства
Доклиническое исследование лекарственного средства
Подача заявления о государственной регистрации лекарственного препарата
Клинические испытания лекарственного средства
Экспертиза качества лекарственного препарата и отношения ожидаемой пользы к возможному риску
Включение лекарственного препарата в Государственный реестр лекарственных средств (РЛС)
Производство лекарственного препарата
Внедрение в медицинскую практику
R&D-период (research and development) начальный этап разработки ЛС
Создание препарата
Разработка препарата
Научное сопровождение препарата на этапе вывода на рынок
Что понимается под новым препаратом:
Новая молекула с новым механизмом действия
Новая молекула с известным механизмом действия
Модификация известной молекулы
Новая форма известного препарата
Разработка системы доставки лекарственного препарата
1. Поиск потенциального лекарственного средства:
- Теоретические модели (SAR – structure-activity relations)
- Экспериментальные модели – Скрининг (библиотеки веществ)
Разработка лекарственных средств:
Химический синтез препаратов
1. Получение препаратов из лекарственного сырья:
· животного происхождения
· растительного происхождения
· из минералов
2. Биотехнологическое получение - лекарственные вещества являются продуктами жизнедеятельности биообъектов:
использование микробиологического синтеза
методы генной инженерии
Замысел создания нового ЛВ. Возникает обычно в результате совместной работы ученых двух специальностей: фармакологов и химиков-синтетиков. Уже на этой стадии осуществляется предварительный отбор синтезированных соединений, которые, по мнению специалистов, могут быть потенциально биологически активными веществами.
Синтез предварительно отобранных структур. На этой стадии также осуществляется отбор, в результате которого вещества и т.д., не подвергаются дальнейшему исследованию.
Фармакологический скрининг и доклинические испытания. Основной этап, во время которого отсеиваются неперспективные вещества, синтезированные на предыдущем этапе.
Клиническая проверка. Ее выполняют только для перспективных БАВ, которые прошли все этапы фармакологического скрининга.
Регистрация препарата
Разработка технологии производства нового ЛВ и более рациональной ЛФ.
Подготовка нормативной документации, включающей способы контроля качества как самого ЛВ, так и его ЛФ.
Внедрение ЛВ в промышленное производство и отработка всех стадийного получения в заводских условиях.
18. Охарактеризуйте этапы испытания лекарственного средства.
Разработка и доклинические обычно 1-3 года
Этапы работ по результатам скрининга, как правило, закрыты. Исследователи проводят предварительный выбор вещества-лидера, а затем – окончательный выбор вещества-лидера. После этого вещество поступает в исследовательские группы, занимающиеся доклиническими испытаниями, подготовкой к клиническим испытаниям и созданием готовой лекарственной формы.
Тестирование лекарственного средства
Полученные вещества тестируются для подтверждения их фармакологической активности с применением биологических моделей различного организационного уровня: бесклеточный (молекулярный), клеточный, органы и ткани и на уровне целостного организма. Предварительное тестирование позволяет выявить перспективные молекулы для последующего их полного доклинического исследования на животных.
Доклинические испытания
Доклиническое исследование лекарственного средства -биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства (ФЗ от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств").
Нормативно правовые акты, регламентирующие проведение доклинических исследований лекарственных средств:
Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств»;
Приказ Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. N 708н "Об утверждении Правил лабораторной практики« (GLP)
Таким образом, для лекарственного вещества и разработанной для него лекарственной формы на этапе доклинических испытаний устанавливают специфическую активность в опытах на животных, изучают биологическую доступность, биологическую безвредность (острую и хроническую токсичность, местнораздражающее, аллергизирующее действие и т. д.), а также устойчивость при хранении. На основе полученных сведений составляется отчет и заключение о доклинических исследованиях будущего лекарственного средства. Затем клинические испытания
Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств"
Статья 11. Доклиническое исследование лекарственного средства для медицинского применения
1. Доклиническое исследование лекарственного средства для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства.
2. Доклиническое исследование лекарственного средства для медицинского применения проводится в соответствии с правилами лабораторной практики, утвержденными уполномоченным федеральным органом исполнительной власти.
3. Для организации и проведения доклинического исследования лекарственного средства для медицинского применения разработчики лекарственных средств могут привлекать научно-исследовательские организации, образовательные учреждения высшего профессионального образования, имеющие необходимую материально-техническую базу и квалифицированных специалистов в соответствующей области исследования
4. Доклиническое исследование лекарственного средства для медицинского применения проводится по утвержденному разработчиком лекарственного средства плану с ведением протокола этого исследования и составлением отчета, в котором содержатся результаты этого исследования и заключение о возможности проведения клинического исследования лекарственного препарата для медицинского применения.
5. Проведение проверок соблюдения правил лабораторной практики и правовых норм использования животных при проведении доклинических исследований лекарственных средств для медицинского применения осуществляется уполномоченным федеральным органом исполнительной власти.
6. Результаты доклинического исследования лекарственного средства для медицинского применения могут быть представлены в уполномоченный федеральный орган исполнительной власти в установленном порядке в целях государственной регистрации лекарственного препарата.
Про клинические далее
