
- •Список вопросов к экзамену 5 курса (каф. Дудниковой э. В.)
- •Ответы на вопросы
- •III степень тяжести:
- •2. Спазмофилия. Причины. Патогенез. Клинические формы. Диагностика. Лечение.
- •3. Гипервитаминоз д. Причины возникновения. Классификация. Клиника. Осложнения. Диагностика. Дифференциальный диагноз. Исходы. Лечение. Профилактика. Прогноз.
- •1. Этап разгрузки
- •2. Этап минимального питания
- •4. Этап оптимального питания
- •1 Степень
- •2 Степень
- •3 Степень
- •7. Железодефицитная анемия у детей раннего возраста. Этиология. Патогенез. Классификация. Клиника. Диагностика. Дифференциальная диагностика. Лечение. Профилактика.
- •III. Кома III – терминальная, всё отсутствует. Это неврологическая составляющая.
III. Кома III – терминальная, всё отсутствует. Это неврологическая составляющая.
В целом 3 клинических синдрома: лихорадка, интоксикационный и неврологических расстройств.
Лечение:
Общие принципы:
- Палата интенсивной терапии, ОРИТ;
- Этиотропная, патогенетическая, симптоматическая терапия (борьба с гипертермией, судорогами, гипервентиляцией и т.д.);
- Омоложение диеты;
- Дробное кормление.
! Патогенетическая терапия:



12. Острый бронхит у детей раннего возраста. Этиология. Патогенез. Классификация. Клиника и особенности патогенеза в зависимости от клинической формы. Диагностика. Принципы комплексной терапии. Показания к госпитализации.
Бронхит - воспаление слизистой оболочки в бронхах любого калибра без поражения легочной ткани.
Бронхит – всегда двусторонний диффузный процесс.
Этиология: - 90% случаев – респираторные вирусы (гриппа, парагриппа, респираторно-синцитиальный (РС), риновирус, аденовирус, метапневмовирус, коронавирус), а также энтеровирусы и др. представители пикорнавирусов; - до 10% случаев (но чаще у школьников) – M. pneumoniae, Chlamydophila pneumoniae, B. Pertussis; - крайне редко – S. pneumoniae, Moraxella catarrhalis, H. influenza; - грибы (Candida, Aspergillus) – при иммунодефиците.
Острый обструктивный бронхит чаще вызывается РС-вирусом, аденовирусом до 5 лет.
Патогенез:
АФО бронхов у детей:
- Узкий просвет бронхов – чаще обструкция; - Богатое кровоснабжение слизистой – быстрый отек и его распространение; - Слабое развитие мышечных и эластических волокон на 1 году жизни – меньше роль бронхоспазма.

Патогенез острого бронхита: вирус, тропный к респираторному эпителию, проникает в нижние дыхательные пути → внедрение в эпителий → размножение → повреждение клеток и угнетение барьеров стенки бронхов → изменение мукоцилиарного клиренса и нарушение состава слизи (увеличение фазы геля, снижение – золя) + поражение периферических нервов и нарушение нервной регуляции и трофики бронхиального древа + усиление местного кровообращения и развивающийся вследствие этого отек слизистой + гиперсекреция слизи + может быть рефлекторный бронхоспазм → нарушение работы респираторного эпителия и развитие воспалительного процесса в стенке бронха.
Факторы риска обструкции бронхов:
АФО у детей раннего возраста |
Неблагоприятный преморбидный фон |
Гиперплазия железистой ткани |
Отягощенный аллергоанамнез |
Секреция вязкой мокроты |
Наследственная предрасположенность к атопии, гиперреактивность бронхов |
Узость просвета бронхов |
Перинатальная патология |
Низкая коллатеральная вентиляция |
Гипотрофия |
Недостаточность местного иммунитета |
Гиперплазия тимуса |
Склонность к быстрому возникновению отека (обильная васкуляризация) |
Раннее искусственное вскармливание |
|
Перенесенное ОРВИ в 6-12 месяцев |

Виды обструкции: - обратимая (функциональная) – механизмы острого воспаления, бронхоспазм - необратимая – врожденные стенозы бронхов, облитерация и тд.
Для острого обструктивного бронхита у детей раннего возраста основным механизмом бронхообструкции является отек слизистой, а также выделение густой слизи в просвет бронха.
Классификация:
По клинической форме:
1) Острый простой бронхит 2) Острый обструктивный бронхит 3) Бронхиолит, в т.ч. облитерирующий
По характеру течения (в вопросе напрямую не спрашивается, но пусть будет)


Клиника острого простого бронхита:
Умеренное повышение температуры (чаще субфебрилитет, при гриппе – фебрилитет);
Интоксикация выражена слабо (вялости, снижения аппетита обычно нет; кроме гриппа, парагриппа – чаще выраженная);
Катаральные проявления: - грипп – чаще отсутствуют, мб сухой конъюнктивтит, трахеит; - парагрипп – опасен возможный обструктивный ларинготрахеит; - аденовирус – ринит, конъюнктивит; - риновирус – ринит; - метапневмовирус – катар не характерен.
Кашель – сухой, со 2 дня заболевания – влажный, мокрота слизистая;
Осмотр: ЧДД в пределах возрастной нормы, кожные покровы обычной окраски;
Перкуссия – ясный легочной звук над всей поверхностью легких;
Аускультация – на фоне жесткого дыхания – двусторонние диффузные сухие и/или крупно- и среднепузырчатые хрипы, уменьшающиеся после откашливания.
Острый простой бронхит, вызванный M. pneumoniae, C. pneumoniae:
Стойкое повышение температуры до 38-38,5 градусов в течение 5-7 дней без интоксикации (кашляет и бегает);
Конъюнктивит, фарингит;
Кашель с первых дней – выраженный, малопродуктивный, сохраняется до 3 недель, может сопровождаться болью за грудиной;
Часто – заболеваемость вспышками в ДДУ/школах/внутри семьи;
При хламидийном бронхите мб синусит и длительный кашель без лихорадки;
Аускультация – асимметричные рассеянные сухие и мелкопузырчатые хрипы.
Клиника острого обструктивного бронхита: ДН 1-2 степени
Экспираторная одышка (активный вдох → расширение бронхов → воздух входит в легкие → при пассивном выдохе воздух не выходит → экспираторная одышка с участием вспомогательной дыхательной мускулатуры → гипоксия → повышение ЧДД)
Сухие свистящие хрипы, слышные на расстоянии (воздух на выдохе с силой проходит через суженные бронхи)
Кашель сухой (малопродуктивный из-за густой мокроты), приступообразный, длительно сохраняется, через 5-7 дней – влажный
Втяжение уступчивых мест грудной клетки (межреберных промежутков, яремной вырезки, углубления мечевидного отростка)
Парадоксальное дыхание (втяжение грудной клетки, расширение живота)
Лихорадка
Осмотр – вздутие грудной клетки с увеличением переднезаднего размера, цианоз
Перкуссия – коробочный звук
Аускультация – удлинение выдоха, на фоне жесткого дыхания диффузные сухие, свистящие, а также крупно-, средне- и мелкопузырчатые влажные хрипы.
Как правило, обструкция проходит самостоятельно на 7-10 день заболевания.


Диагностика:
Объективное обследование;
ОАК (не проводить рутинно амбулаторно при типичной клинике): Показания к ОАК: - подозрение на бактериальную инфекцию - лихорадка более 39 градусов с симптомами интоксикации - ДН - отсутствие положительной динамики/лихорадка более 3 дней
На ОАК: - грипп – лейкопения, лимфоцитоз - риновирус – норма - аденовирус – норма/незначительный лейкоцитоз - микоплазма – норма/незначительный лейкоцитоз, повышенное СОЭ
ПЦР на микоплазму, хламидии, бордетеллу – при подозрении на этих возбудителей бронхита;
Ат к микоплазме, хламидии – минимум после 2 недель заболевания при неэффективности терапии (3-4 кратное повышение титра в дебюте и повторном взятии);
Экспресс-тест на вирус гриппа (иммунохроматография) при подозрении на вирус гриппа (показания – высокая температура, интоксикация, отсутствие выраженного катара, сухо конъюнктивит, сухой кашель) Экспресс-тест выполнять в максимально ранние сроки при подозрении (т.к. осельтамивир эффективен только в первые 2 дня болезни);
ОАМ – если лихорадка более 3 дней с высокой температурой тела, маленький ребенок (исключить инфекцию мочевыводящих путей);
Рентгенография грудной клетки – при подозрении на пневмонию;
Пульсоксиметрия, спирометрия – детям с острым обструктивным бронхитом и признаками ДН.
Лечение:
Острый простой бронхит:
Режим – активный, рекомендовано гулять (если нет лихорадки), проветривание помещений, увлажнение воздуха;
Диета – достаточное питье, ограничение соленого, острого, не вводим новый прикорм, кормление частое, дробное;
Этиотропная терапия – осельтамивир, занамивир (с 5 лет) при подтвержденном гриппе со среднетяжелым и тяжелым течением ЛИБО если грипп распространен в регионе + нет возможности проведения ПЦР/экспресс-теста; При доказанной бактериальной этиологии (микоплазма, хламидии, бордетелла) – кларитромицин (сусп. 7,5 мг/кг 2 раза в сутки)
Патогенетическая терапия: - муколитики (амброксол) + карбоцистеин (нормализует состав мокроты) – не даем на ночь; - постуральный дренаж; - отхаркивающие не используем (взрослым можно мукалтин); - противокашлевые – не используем (иногда – можно только на первые 2 дня сухого мучительного кашля).
Симптоматическая терапия: - элиминационная терапия; - жаропонижающие (парацетамол, ибупрофен); - сосудосуживающие коротким курсом; - при першении в горле – рассасывание леденцов, пастилок, мягкого мороженого; - спреи не используем! (неэффективны из-за внутриклеточной локализации вирусов + могут вызвать ларингоспазм у маленьких детей).
Острый обструктивный бронхит:
1) Купирование бронхообструкции:



Улучшение дренажной функции бронхов:
Муколитики – противопоказаны до снятия обструкции! После купирования обструкции при малопродуктивном кашле – амброксол
Активная оральная регидратация (щелочные минеральные воды 50 мл/кг)
Постуральный дренаж
Оптимальный способ введения ЛС – аэрозольный через ингаляции (быстро поступает в бронхиальное дерево, действует местно и более активно, меньше выраженность побочных эффектов).
Показания для госпитализации детей с обструктивным бронхитом:
Неэффективность домашнего лечения в течение 1-3 часов
Выраженная тяжесть состояния
Дети группы высокого риска
Социальные показания
Необходимость установления природы и подбора средств терапии при впервые возникших приступах удушья.

13. Острый бронхиолит у детей раннего возраста. Этиопатогенез. Клинические проявления. Диагностика. Лечение.
Острый бронхиолит – это воспалительное заболевание нижних дыхательных путей с преимущественным поражением мелких бронхов и бронхиол и развивается у детей в возрасте до 2 лет (наиболее часто - у детей в возрасте до 1 года).
Этиология:
60-70% - РС-вирус, риновирус (у недоношенных, детей с бронхолегочной дисплазией, на искусственном вскармливании). Очень редко – вирусы гриппа, парагриппа, аденивирус, коронавирус, метапневмовирус, бокавирус.
Факторы риска развития бронхиолита: - наличие старших детей в семье - возраст до 6 месяцев - рождение за ≤ 6 мес. до начала РСВ-сезона - большая семья (≥ 4 человек) - грудное вскармливание ≤ 2 месяцев - посещение детского сада - дети от многоплодной беременности
Патогенез:
Некроз и десквамация эпителия респираторных и терминальных бронхиол → инфильтрация перибронхиального пространства лимфоцитами, нейтрофилами (отек подслизистой) + гиперсекреция слизи + образование плотных пробок из слущенного эпителия, слизи и фибрина внутри бронхиол → частичная или полная закупорка бронхиол. При частичной закупорке – «воздушная ловушка» (гиперинфляция участков легких). При полной обтурации – мелкие ателектазы. Нарушение вентиляционно-перфузионных отношений → гипоксемия и гиперкапния → легочная гипертензия.
Диаметр бронхиол на вдохе больше, чем на выдохе → экспираторная одышка.
Поражение обычно двустороннее, диффузное → ДН (особенно у недоношенных, детей с врожденными пороками сердца, бронхолегочной дисплазией и тд).
При неосложненном течении регенерация эпителия – с 3-4 дня с начала заболевания, полное восстановление – к 15-му дню.
При микоплазменной, аденовирусной этиологии мб некротизирующий бронхиолит.
При облитерирующем (постинфекционном) бронхиолите (аденовирус 21 тип) – облитерация просвета бронхиол, сужение ветвей легочной артерии (легочная гипертензия), участки склероза легочной ткани при сохранении воздушности (гипоперфузия).
Клиническая картина:
Выраженная ДН (тахипноэ 50-70/мин)

У недоношенных может дебютировать с апноэ
Экспираторная одышка
Мб катаральный синдром
Мб эксикоз (снижение потребляемой жидкости + повышение ЧДД и потеря воды), метаболический ацидоз
Субфебрилитет
Кашель, нарастает в течение 3-4 дней
Осмотр: вздутие грудной клетки, втяжение уступчивых мест
Перкуссия – коробочный звук
Аускультация – диффузные мелкопузырчатые хрипы, крепитация, сухие свистящие хрипы
Максимум обструктивного синдрома – в течение 1-2 дня болезни, затем постепенно снижается, исчезает обычно на 7-14 день.
Диагностика:
Осмотр (диагноз клинический)
ОАК – лимфоцитарный лейкоцитоз
Экспресс-тест на РС-вирус
Пульсоксиметрия, КЩС
Рентгенография (при подозрении на пневмонию). На рентгенограмме – «ватное легкое» - мелкие ателектазы (участки снижения прозрачности легочной ткани) при вздутии легких, усиление бронхососудистого рисунка. Участки ателектазов могут ошибочно принять за пневмонию!
Лечение:
Госпитализация в 100% случаях
Деконгестанты + аспирация носоглоточной слизи для очистки ВДП
Адекватная гидратация, коррекция электролитного баланса (при невозможности оральной – через назогастральный зонд или парентерально). Введение ограничивать (риск развития отека легких) – не более 20 мл/кг/сут
Оксигенотерапия при SpO2 <92%
Бронходилататоры – субъективное улучшение состояния больного (расширение верхних отделов бронхиального древа – не влияют на бронхиолы из-за отсутствия мышечного компонента в стенке). При отсутствии эффекта от ингаляции бронходилататора через 20 минут (рост SpO2, уменьшение ЧДД на 10-15/мин, снижение интенсивности свистящих хрипов, уменьшение втяжений межреберий) дальнейшее ингалирование не имеет смысла. При наличии эффекта – продолжить (не более 3-4 раз в день): - фенотерол + ипратропия бромид детям в возрасте до 6 лет на прием 2 капли/кг, не более 10 капель (0,5 мл), 6-12 лет – 10-20 капель - сальбутамол на прием 0,15 мг/кг, максимально 1,25 мл до 1 года, старше – до 2,5 мл
Глюкокортикоиды применять НЕЦЕЛЕСООБРАЗНО – ни ингаляционные, ни системные (кроме преднизолона, дексаметазона – при облитерирующем (постинфекционном) бронхиолите).
14. Острая ревматическая лихорадка. Определение. Этиология, патогенез, патоморфология. Классификация. Основные и дополнительные диагностические критерии. Определение степеней активности. Клинические и лабораторные критерии диагностики. Хорея: клиника, диагностика, лечение. Ревматический полиартрит: клиника, дифференциальная диагностика, лечение. Первичный ревмокардит: клиника, дифференциальная диагностика, лечение. Этапность лечения детей с ОРЛ. Диспансерное наблюдение.
ОРЛ (Острая ревматическая лихорадка = б-нь Сокольско) – это первая острая атака ревматизма, имеющая свои особенности в детском и подростковом возрасте.
В РФ и РБ частота заболеваемости < 1:1000
Ревматическая лихорадка – это иммунологически детерминированное системное заболевание соединительной ткани с преимущественным поражением ССС, развивающееся после инфицирования β-гемолитическим стрептококком группы А (спустя 2-3 недели после первичного инфицирования) у лиц, имеющих наследственную предрасположенность.
Этиология – инфекционно-иммунологическая. Сочетание 3-ёх факторов:
β-гемолитический стрептококк группы А (пусковой фактор);
Генетически наследуемый иммунный статус;
Предрасполагающие факторы
Теперь раскроем каждый из этих факторов:
β-гемолитический стрептококк группы А (пусковой фактор):
- 7 штаммов (М1,М3,М5,М6,М24 и т.д.)
- клеточные антигены (М-протеин – подавляет фагоцитоз)
- экзотоксины: стрептолизины S и О, стрептокиназа, гиалуронидаза, ДНК-аза, протеиназа
Генетически наследуемый иммунный статус:
- доказана семейная отягощенность
- наличие специфических АГ у В-лимфоцитов, являющихся генетическим маркером восприимчивости к ОРЛ
- преобладание определенных локусов гистосовместимости
Этапы патогенеза:
Иммунный (аутоиммунный):
- формирование ЦИК (циркулирующих иммунных комплексов АГ + АТ + Комплемент)
- прямое цитотоксическое действие гемолизинов → «обнажение» антигенной структуры миокарда → выработка аутоантител (за счёт перекрестно-реагирующих антигенов между стрептококком и миокардом) ~ что подразумевается под «обнажением» антигенной структуры? В норме в миокарде есть комплекс КОЛЛАГЕН + ГАГ и всё нормально до тех пор, пока Стрептококк не станет отщеплять молекулу ГАГ и, буквально, «обнаженный» КОЛЛАГЕН теперь воспринимается нашим организмом как АНТИГЕН.
Сосудистый:
- возникновение микротромбозов и микронекрозов вследствие нарушения процессов микроциркуляции и свертывания крови
Вторичная реакция воспаления:
- преобладание экссудативных или пролиферативных процессов.
Патоморфология:
Мукоидное набухание – обратимое повреждение основного вещества соед.тк., характеризующееся отеком соед.тк. и ↑ её проницаемости.
Фибриноидное набухание – появление на поверхности сердца нитий фибрина – так называемое «волосатое сердце»
Фибриноидный некроз – разрушение коллагена
Появление гранулём (Ашофа-Талалаева) – узелковые скопления лимфоцитов и макрофагов вокруг очага некроза.
Склероз – вместо плотной оформленной соед.тк. на месте её разрушения появляется новая, в бо́льшем количестве плотная неоформленная соед.тк.
Классификация:
► По клиническим вариантам:
- ОРЛ - Повторная РЛ
► По клиническим проявлениям (они же диагностические критерии):
- Основные (большие): Кардит, Артрит, Хорея, Кольцевидная эритема, Ревматические узелки
- Дополнительные (малые): Клинические: Артралгии, Лихорадка, Абдоминальный синдром, Серозиты Лабораторные: Позитивная А-стрептококковая культура, выделенная из ротоглотки, или положительный тест быстрого определения А-str. Антигена, Повышенные или повышающиеся титры противострептококковых антител, ↑Лц, ↑СОЭ, ↑ЦРБ, ЭКГ (удлинение интервала PQ).
!!!DS ставится на основании наличия 2 больших или 1 большого и 2 малых критериев
► По исходу:
- Выздоровление - Хроническая ревматическая болезнь (с или без порока сердца)
► По недостаточности кровообращения (Василенко-Стражеско) (у детей чаще преобладает латентное течение и формирование порока сердца)
- Стадия I – скрытая недостаточность кровообращения, проявляется только при физической нагрузке (одышка, сердцебиение, чрезмерн.утомл.). В покое явления исчезают. Гемодинамика не нарушена.
- Стадия II – выраженная длительная недостаточность кровообращения, есть в покое, есть гемодинамические нарушения в БКК и/или МКК.
*период А – только в одному кругу (БКК или МКК) *период Б – в обоих кругах (БКК и МКК)
- Стадия III – конечная дистрофическая с тяжелыми нарушениями гемодинамики, стойкими изменениями обмена веществ, необратимые изменения в структуре органов и тканей.
Определение степеней активности:

Хорея (у 15% больных ОРЛ, чаще у девочек 6-15 лет):
Клиническая картина:
Начало постепенное, с появления неустойчивого настроения, астенизации, плаксивости, раздражительности (одним словом – эмоциональная лабильность). Позднее присоединяется основной симптомокомплекс:
Пентада Хореи:
Эмоциональная лабильность
Хореические гиперкинезы
Мышечная гипотония
Расстройства статики и динамики
Вегетососудистые расстройства
Гиперкинезы в проксимальных отделах конечностей, дискоординация движений, ↓мышечного тонуса, дизартрия, нарушения почерка (дизграфия), невозможность удержать предметы сервировки за столом. Усиливаются симптомы при волнении, исчезают во время сна.
Симптомы: при поднятии больного за подмышки голова глубоко уходит в плечи «дряблые плечи». «Глаза и язык Филатова» – невозможность одновременно закрыть глаза и высунуть язык. «Хореические руки + приплясывание».
Диагностика:
- пальце-носовая проба (-); - колено-пяточная проба (-); - способ Филатова – при рукопожатии чувствуется дрожание и неравномерность мышечной работы руки ребенка
+ диагностические мероприятия как при ОРЛ
Лечение:
- Эрадикация стрептококка – 10-дневный курс пенициллина , пенициллина V или амоксициллина;
- Превентивная терапия после выздоровления бензатина бензилпенициллином;
- НПВС при сочетании хореи и ОРЛ;
- ГКС: преднизолон 1 мг/кг/сут;
- ЛС, усиливающие ГАМКергическую передачу (~клоназепам)
- ЛС, блокирующие дофаминергическую передачу (~галоперидол, метоклопрамид)
- м.б. нейролептики
Ревматический полиартрит:
Клиническая картина:
Имеет доброкачественное течение, но нередко протекает с выраженным болевым синдромом и с нарушением функций сустава. Поражаются преимущественно крупные и средние суставы (коленные, локтевые, плечевые). При своевременной терапии благоприятно и быстро регрессируется.
Диф. диагностика:
Проводится с реактивным артритом, для которого характерно:
- Стойкое симметричное поражение крупных суставов; - Медленный ответ на лечение НПВС; - Отсутствие кардита и хореи; - Полное обратное развитие через 2-4 месяца.
Лечение:
- Эрадикация стрептококка – 10-дневный курс пенициллина , пенициллина V или амоксициллина;
- НПВС для облегчения суставных болей и предотвращения вовлечения в процесс новых суставов;
- ГКС: преднизолон 1 мг/кг/сут;
Первичный ревмокардит:
Поражение сердца наблюдается у всех больных с ОРЛ.
► Миокардит – самое частое проявление патологии при острой атаке ревматизма. Состояние кровообращения зависит от степени его выраженности. При диффузном миокардите значительно страдает общее состояние больного, появляется бледность кожных покровов, расширение границ сердца, глухость сердечных тонов, может развиваться СН.
На УЗИ – умеренные признаки ↓ сократительной способности сердца.
На ЭКГ – удлинение интервала PQ, депрессия ST, ↓амплитуды зубца Т.
Аускультация – ↑ЧСС, приглушение II тона.
► Эндокардит (пристеночный, клапанный, тотальный):
- Клапанный эндокардит характеризуется аускультативным систолическим шумом «дующего характера» это признак вульвулита.
Чаще поражается митральный клапан, шум на верхушке сердца в V-ом межреберье, усиливается после нагрузки. При поражении аортального клапана – шум во II-ом м/р справа. У 1/3 пациентов поражение митрального и аортального клапанов обнаруживается только при УЗИ сердца.
- Тотальный эндокардит сопровождается выраженной интоксикацией, высокой СОЭ (выше 30 мм/ч), выраженными воспалительными сдвигами в общем и биохимическом анализах крови.
► Перикардит при первой атаке ревматизма возникает крайне редко (~1%). Характеризуется увеличенным размерами сердца (при перкуссии и рентгене), появлением шума трения перикарда. На ЭКГ снижение вольтажа зубцов желудочкового (QRS) комплекса, ↑сегмента ST, деформация зубца Т. При перикардите обычно нарастает тяжесть состояния и может возникнуть Сердечная Недостаточность (СН).
Диф. диагностика: с неравметическим кардитом.
Лечение:
- Эрадикация стрептококка – 10-дневный курс пенициллина , пенициллина V или амоксициллина; - НПВС; - ГКС: преднизолон 1 мг/кг/сут;
Этапность лечения детей с ОРЛ:


Диспансерное наблюдение: предусматривает продолжение противорецидивной терапии, улучшение функциональных возможностей ССС, повышение иммунологической защиты ребенка и санацию органов хронической инфекции.
15. Открытый артериальный проток: его стадии, гемодинамические нарушения. Клиника, диагностика, показания к хирургическому лечению.
Открытый артериальный (боталлов) проток (ОАП) = Сброс крови через проток из аорты в легочную артерию.
Во внутриутробной жизни обеспечивает кровоснабжение плода. Закрывается в первые дни или месяцы после рождения ребенка. Функционирование протока более 2 нед. внеутробной жизни расценивается как ВПС. Частота ОАП составляет 5-10% среди всех ВПС. У недоношенных:
mр< 1750г - 45% mp <1200г - 80%. Нарушение гемодинамики:
Относится к порокам с обогащением МКК
Порок бледного типа
Сброс лево-правый Но! При выраженной легочной гипертонии и гипертрофии правых отделов, когда давление в ЛА станет выше, чем в аорте, возникнет право-левый сброс + в клинике появится цианоз (читайте ниже объяснение)
Величина сброса зависит:
размера протока;
угла его отхождения от аорты;
разницы сопротивления в малом и большом круге кровообращения.

 Объяснение:
Давление в аорте (всегда!) больше,
чем в ЛА (и в систолу, и в диастолу).
Соответственно, кровь переходит из
аорты в ЛА, что приводит к перегрузке
МКК ОБЪЕМОМ, т.е. левые отделы сердца
переполняются и, как результат, возникает
их гипертрофия (ЛП+ЛЖ).
Плюс со временем
возникает спазм (а в дальнейшем склероз)
легочных сосудов=> повышение давления
=> перегрузка давлением правых отделов
сердца (т.к. правому желудочку тяжело
выталкивать кровь в ЛА, где высоченное
давление) => гипертрофия ПРАВЫХ ОТДЕЛОВ
за счет перегрузки ДАВЛЕНИЕМ.
Объяснение:
Давление в аорте (всегда!) больше,
чем в ЛА (и в систолу, и в диастолу).
Соответственно, кровь переходит из
аорты в ЛА, что приводит к перегрузке
МКК ОБЪЕМОМ, т.е. левые отделы сердца
переполняются и, как результат, возникает
их гипертрофия (ЛП+ЛЖ).
Плюс со временем
возникает спазм (а в дальнейшем склероз)
легочных сосудов=> повышение давления
=> перегрузка давлением правых отделов
сердца (т.к. правому желудочку тяжело
выталкивать кровь в ЛА, где высоченное
давление) => гипертрофия ПРАВЫХ ОТДЕЛОВ
за счет перегрузки ДАВЛЕНИЕМ.
Далее давление в МКК ( в ЛА) будет выравниваться в диастолу, а сброс происходить только в систолу.
А в запущенных случаях давление в ЛА станет выше, чем в аорте, что приведет к право-левому сбросу=> цианоз (венозная кровь попадёт в БКК) - комплекс Эйзенменгера.
Клиническая картина:
При отсутствии выраженных нарушений гемодинамики течение ОАП чаще бессимптомное. При значительном сбросе крови рано развивается легочная гипертензия, в связи с чем у них отмечаются признаки сердечной недостаточности:
плохая прибавка в весе,
одышка и тахикардия,
частые респираторные инфекции, пневмонии.
Границы сердца расширены влево, при высокой легочной гипертензии — и вправо.
Аускультация. Во II м/р слева (точка выслушивания ЛА)- непрерывный («машинный») систолодиастолический шум, обусловленный сбросом крови в период и систолы, и диастолы в одном направлении.
В первые месяцы жизни ребенка и при значительной легочной гипертензии • сброс крови через проток происходит только во время систолы, поэтому выявляется лишь систолический шум; • II тон над легочной артерией усилен и расщеплен - всегда показатель легочной гипертензии!!
Диагностика:
ЭКГ - признаки гипертрофии левого желудочка, при легочной гипертензии - обоих желудочков. ЭхоКГ - визуализация ОАП.
Допплеровское исследование позволяет определить направление шунта и градиенты давлений. Косвенные признаки (увеличение полости левого предсердия, левого желудочка и восходящей аорты ) также важны для диагностики. Рентгенография органов грудной клетки - усиление сосудистого рисунка, талия сердца сглажена, увеличение левых отделов сердца и правого желудочка, выбухание дуги легочной артерии (за счет увеличения объёма МКК) Катетеризация камер сердца - не проводят
Прогноз:
Спонтанное закрытие ОАП может быть отсроченным (у доношенного новорожденного чаще до 1 месяца жизни)
Сердечная недостаточность, повторные пневмонии могут привести к смерти в раннем возрасте.
Обструктивное заболевание легочных сосудов может развиваться уже к концу первого года жизни.
Бактериальный эндокардит.
Редко - образование аневризмы ОАП с потенциальным её разрывом.
Наличие ОАП у недоношенного новорожденного в сочетании с незрелостью легочной паренхимы часто ведет к сердечной недостаточности, бронхо-легочной дисплазии, зависимости от искусственной вентиляции легких (высокая летальность).
Лечение:
Можно лечить консервативно!! (у недоношенных): • Ибупрофен (Педея) применяется для закрытия ОАП у недоношенных новорожденных (внутривенно курсом из 3-х введений, в дозе 10 мг/кг 1-е введение, 5 мг/кг 2-е и 3-е введение). Происходит снижение уровня простагландина Е, что приводит к спазму и облитерации протока. ! Введение ибупрофена неэффективно у доношенных новорожденных. • При ЗСН используют сердечные гликозиды и диуретики, проводят кислородотерапию. • Профилактика бактериального эндокардита показана у пациентов, которым закрытие ОАП не выполнено по каким-либо причинам.
Хирургическая коррекция:
Показания: Наличие ОАП, независимо от размеров. У недоношенных новорожденных отсутствие эффекта от 3 курсов ибупрофена (около 10% леченных больных) Хирургическое лечение в течение первого месяца жизни выполняется по строгим показаниям (выраженная сердечная недостаточность, не контролируемая консервативно, в связи с возможностью спонтанного закрытия протока).
Противопоказания. • Наличие обструктивного заболевания легочных сосудов. Сроки оперативного лечения • В любом возрасте, когда было впервые выявлено наличие ОАП. Методы • Перевязка протока из левой боковой торакотомии. • Пересечение протока (профилактика «реканализации» протока). • У недоношенных новорожденных можно закрывать проток металлической клипсой. • Для доступа к протоку может применяться торакоскопическая техника, что уменьшает травму для пациента. • Эндоваскулярная окклюзия.
16. Дефект межпредсердной перегородки: анатомические варианты, гемодинамические нарушения. Клиника, диагностика, лечение.
Встречается у 8-16 % детей, родившихся с ВПС.
Варианты ДМПП:
первичные дефекты - расположены низко над атриовентрикулярный клапанами,
вторичные — в области овального окна (намного чаще)
дефект венозного синуса (в области устья верхней полой вены, либо, в месте впадения нижней полой вены в правое предсердие).
Нарушение гемодинамики:
Относится к порокам с обогащением МКК.
Сброс крови из левого предсердия в правое, величина сброса зависит от размера дефекта и разницы давления в предсердиях.
При малых дефектах Нарушения кровообращения не возникает и порок выявляется поздно.
При больших дефектах:
Давление в ЛП выше, чем в правом → сброс крови слева-направо → перегрузка правых отделов (за счет и ОБЪЕМА, и ДАВЛЕНИЯ) → увеличение кровотока в легких → развитие легочной гипертензии (но при ДМПП легочная гипертензия развивается относительно редко, особенно «склеротическая» ее форма)
Клиническая картина:
Жалобы - чаще нет.
Физическое развитие соответствует возрасту.
В анамнезе - повторные ОРЗ.
Застойная сердечная недостаточность возникает редко.
Перкуссия: Границы сердца увеличены вправо
Аускультация:
во II м/р слева систолический шум, чаще неинтенсивный, с ограниченной зоной распространения;
II тон над легочной артерией расщеплен, усилен за счет легочного компонента.
Диагностика :
ЭКГ - признаки гипертрофии правого желудочка (или блока/ ножки пучка Гиса, чаще неполная), реже и правого предсердия.
ЭхоКГ - визуализация ДМПП (вторичный ДМПП - дефект в средней части перегородки, при первичном - в нижней части, прилегающей к атриовентрикулярным клапанам, дефект венозного синуса - в верхней части перегородки, граничащей с устьем ВПВ); - косвенные признаки лево-правого шунта - увеличение правого предсердия и правого желудочка, расширение легочной артерии; - допплеровское исследование позволяет обнаружить кровоток через дефект. Рентгенография органов грудной клетки - усиление сосудистого рисунка, увеличение правых отделов сердца, выбухание дуги легочной артерии.
Прогноз:
Спонтанное закрытие ДМПП возможно в раннем возрасте при небольших размерах дефекта. ДМПП размером более 8-9 мм редко закрывается самостоятельно. ДМПП, как правило, не вызывает развития сердечной недостаточности и легочной гипертензии до 20-30 летнего возраста.
Первыми проявлениями дефекта часто становятся нарушения ритма (наджелудочковые тахиаритмии), которые наблюдаются в подростковом и взрослом возрасте.
Инфекционный эндокардит не встречается при изолированном ДМПП.
Наличие ДМПП может быть совместимо с нормальной продолжительностью жизни, однако ведет к ухудшению качества жизни. риску системных тромбоэмболий при развитии хронической фибрилляции предсердий.
Лечение:
Хирургическая коррекция:
Показания:
лево-правый шунт с Qp/Qs > 1.5:1
косвенные признаки объемной перегрузки правых отделов сердц, обнаруживаемые при УЗИ (достаточны для операции)
Противопоказание:
высокое сосудистое сопротивление легких (>10 ед/м2, >7 ед/м2 с вазодилятацией).
Сроки оперативного лечения 2-5 лет (вероятность спонтанного закрытия дефекта)
Методы:
Радикальная операция - закрытие ДМПП (в условиях искусственного кровообращения, проводится ушивание дефекта или пластика). Эндоваскулярное закрытие дефекта с помощью окклюдеров (пункция периферических сосудов и доставка специального «зонтика» к месту дефекта. Анатомические ограничения. Вторичный ДМПП, расположенный вдалеке от коронарного синуса, атриовентрикулярных клапанов, устьев легочных и полых вен.
17. Дефект межжелудочковой перегородки: анатомические варианты, ге-модинамические нарушения, стадии. Клиническая симптоматика у детей различных возрастных групп. диагностика, консервативное лечение. Показания к хирургическому лечению.
ДМЖП - По частоте занимает первое место, составляя 10—25 % от всех ВПС.
Варианты ДМЖП:
Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, не закрываются самопроизвольно.
Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы. !Бывают множественными, фенестрированными и часто закрываются самопроизвольно во время систолы (соответственно сброса не будет) - болезнь Толочинова-Роже
Нарушение гемодинамики:
Относится к порокам с обогащением МКК.
В периоде новорожденности лево-правый сброс небольшой, может быть «перекрестный сброс».
Объяснение:
 Рбкк
> Рмкк →артериальная кровь из ЛЖ
поступает в ПЖ → в ЛА (и из ЛЖ, и из
ПЖ)→перегрузка ОБЪЕМОМ МКК → весь объем
переходит в легочные вены → перегрузка
ОБЪЕМОМ левых отделов → их гипертрофия
→ повышение давления в мкк → легочная
гипертензия → гипертрофия правых
отделов
Рбкк
> Рмкк →артериальная кровь из ЛЖ
поступает в ПЖ → в ЛА (и из ЛЖ, и из
ПЖ)→перегрузка ОБЪЕМОМ МКК → весь объем
переходит в легочные вены → перегрузка
ОБЪЕМОМ левых отделов → их гипертрофия
→ повышение давления в мкк → легочная
гипертензия → гипертрофия правых
отделов
И в какой-то момент давление в ПЖ будет больше, чем в ЛЖ → право-левый сброс → цианоз - комплекс Эйзенменгера.
Стадии формирования легочной гипертензии:
гиперволемическая,
переходная,
склеротическая.
Клиническая картина:
В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова-Роже – «много шума из ничего») и большие (более 1 см или половина диаметра устья аорты) дефекты. Дефекты небольших размеров (болезнь Толочинова-Роже) сопровождаются незначительным сбросом, не вызывающим выраженных нарушений гемодинамики. -Общее состояние больных удовлетворительное, -Физическое развитие соответствует возрасту. -Размеры сердца не увеличены или выявляется небольшое увеличение левого желудочка. - НО!! Грубый, скребущий систолический шум в третьем-четвертом межреберье слева – место выслушивания межжелудочковой перегородки – за счет турбулентного движения крови в области дефектов (может быть единственным проявлением порока).
При больших дефектах со значительным сбросом крови → гиперволемия малого круга кровообращения → легочная гипертензия (определяет тяжесть клинических проявлений, течение и прогноз).
Клинические признаки порока выявляются в первые месяцы жизни.
Одышка, тахикардия, застойные хрипы в легких, Частые ОРЗ (пневмония) из-за застоя в МКК
увеличение печени, селезенки (в случаях правожелудочковой недостаточности)
Гипотрофия.
Сердечный горб за счет гипертрофии левого желудочка
Усилен верхушечный толчок за счет гипертрофии левого желудочка
Систолическое дрожание в III-IV м/р слева за счет сброса во время систолы
Границы сердца увеличены влево.
Аускультация сердца:
Интенсивный систолический шум в III-V м/р слева, который хорошо проводится вправо от грудины.
На верхушке может быть мезодиастолический шум как проявление относительного стеноза митрального клапана;
II тон над легочной артерией усилен и расщеплен
При очень высокой легочной гипертензии выравнивается давление в желудочках и возникает перекрестный сброс крови. При этом основной шум ослабевает или может исчезать. Для склеротической фазы легочной гипертензии характерна высокая необратимая легочная гипертензия, расширение легочной артерии, гипертрофия с систолической перегрузкой правых отделов сердца, стойкий цианоз, проявление правожелудочковой недостаточности кровообращения (синдром Эйзенменгера)
Диагностика:
ЭКГ – признаки гипертрофии левого желудочка, правого или обоих желудочков. ЭхоКГ – гипертрофия и дилатация левых и/или правых отделов, визуализация ДМЖП. Определяют систолическое давление в правом желудочке, степень сброса крови. Рентгенография органов грудной клетки: При небольших ДМЖП — нормальная рентгенологическая картина. Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка. При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
Лечение:
Медикаментозное лечение – только как симптоматическое лечение СН Лечение сердечной недостаточности включает применение сердечных гликозидов, при застое в малом круге кровообращения — периферических вазодилататоров (блокаторы кальциевых каналов (нифедипин), ингибиторы АПФ (каптоприл), аналоги простагландинов (эпопростенол), антагонисты эндотелиновых рецепторов (бозентан)). При правожелудочковой недостаточности — диуретики.
Детям с маленькими ДМЖП, которым не показано хирургическое лечение необходима пожизненая профилактика бактериального эндокардита.
Показания к хирургической коррекции:
У детей первых лет жизни - раннее развитие легочной гипертензии, рефрактерная к терапии сердечная недостаточность, включая гипотрофию II-III степени и повторные респираторные инфекции;
Большой ДМЖП без сердечной недостаточности, но с повышением легочного артериального давления по данным доплерографии, обычно операция проводится в возрасте до одного года;
У детей старше 3-х лет - рефрактерная к терапии сердечная недостаточность, частые ОРВИ, осложненные пневмонией, задержка роста.
ДМЖП у детей после 1 года, у которых легочный кровоток соотносится к системному как 2:1, требует хирургического закрытия ДМЖП, независимо от давления в легочной артерии;
Дети с большим ДМЖП, высоким (системным) давлением в легочной артерии и небольшим лево-правым шунтом должны подвергаться катетеризации сердца.
Хирургическое лечение противопоказано когда
соотношение между легочным и системным сосудистым сопротивлением более 0,7 и сброс составляет менее 40% от минутного объема малого круга кровообращения,
если легочное сосудистое русло не обнаруживает признаков релаксации при пробе с вазодилятаторами (в первую очередь, при кислородной пробе),
при наличии преимущественно право-левого шунта.
ДМЖП в этих случаях играет роль тоннеля для разгрузки правого желудочка и закрытие его приводит к развитию острой сердечной недостаточности.
Радикальная операция: - Закрытие ДМЖП (в условиях искусственного кровообращения, проводится пластика дефекта заплатой из аутоперикарда или синтетических материалов).
Эндоваскулярное закрытие окклюдером Amplatzer. Показание - множественные мышечные дефекты.
Паллиативное сужение легочной артерии в настоящее время используется редко в качестве экстренной операции.
Показанием для этой процедуры могут быть масса тела менее 3 кг, тяжелые сопутствующие заболевания (сепсис, глубокая недоношенность, эрозивно-язвенный энтероколит, геморрагические осложнения), множественные ДМЖП и малый опыт клиники по радикальной коррекции порока в раннем возрасте. Радикальная операция должна выполняться, как только устранены препятствующие факторы.
18. Тетрада Фалло: анатомические признаки, гемодинамические нарушения, фазы течения, клиническая симптоматика в различные возрастные периоды, лабораторная диагностика. Лечение детей с одышечно-цианотическими приступами. Показания к хирургическому.лечению.
Тетрада Фалло – 10% всех детей с ВПС: Сложный порок, состоит из 4 аномалий:
Стеноз выходного отдела правого желудочка;
Высокий ДМЖП;
Декстрапозиции аорты;
Гипертрофии правого желудочка.
Тетрада Фалло в 40% случаев сочетается с другими ВПС: правосторонняя дуга аорты (20-25%), сосудистое кольцо, вторичный ДМПП, ОАП, открытый общий атриовентрикулярный канал (АВК), добавочная левосторонняя верхняя полая вена, частичный аномальный дренаж легочных вен.
Нарушение гемодинамики:
Относится к порокам с обеднением МКК.
Порок синего типа
Нарушения гемодинамики определяются главным образом степенью стеноза легочной артерии и ДМЖП.

Объяснение:
 Первый
компонент (и самый важный) - стеноз
выходного отдела правого желудочка (от
степени сужения будут зависеть дальнейшие
нарушения), который приводит к тому, что
кровь из ПЖ с трудом поступает в МКК →
перегрузка ПЖ (и ОБЪЕМОМ, и ДАВЛЕНИЕМ).
Соответственно, кровь из ПЖ и ЛЖ будет
поступать в аорту (второй и третий
компоненты порока – дефект в мембране
+ декстрапозиция аорты) → венозная кровь
из ПЖ попадет в БКК → порок синего типа.
Первый
компонент (и самый важный) - стеноз
выходного отдела правого желудочка (от
степени сужения будут зависеть дальнейшие
нарушения), который приводит к тому, что
кровь из ПЖ с трудом поступает в МКК →
перегрузка ПЖ (и ОБЪЕМОМ, и ДАВЛЕНИЕМ).
Соответственно, кровь из ПЖ и ЛЖ будет
поступать в аорту (второй и третий
компоненты порока – дефект в мембране
+ декстрапозиция аорты) → венозная кровь
из ПЖ попадет в БКК → порок синего типа.
Клинико-анатомические варианты порока:
крайняя форма - в связи с атрезией легочной артерии кровь в легкие поступает через ОАП или коллатерали, право-левый сброс через ДМЖП;
классическая форма - кровь из правого желудочка поступает в легочную артерию и аорту, наблюдается право-левый сброс через ДМЖП; -пример в объяснении выше
бледная форма - (незначительный стеноз ЛА) происходит сброс крови слева направо, чем и объясняется отсутствие цианоза.
Расположение аорты «верхом» на межжелудочковой перегородке приводит к тому, что кровь из правого желудочка беспрепятственно поступает в аорту, вследствие чего сердечная недостаточность обычно не развивается.
Клиническая картина:
В первые месяцы жизни ребенка (до 6 месяцев):
малосимптомное течение,
диагностируется на основании грубого систолического шума в II-III м/р слева от грудины – из-за турбулентного движения крови в систолу через суженное отверстие выходного отдела ПЖ
С 4-6 мес начинается «критический период», который длится до 1,5-2 лет (одышечно-цианотических приступов):
одышка,
цианоз (у некоторых пациентов цианоз может выявляться уже с рождения),
отставание в физическом развитии,
симптом «барабанных палочек» и «часовых стекол».
в периферической крови увеличиваются уровень гемоглобина и число эритроцитов – компенсаторно на фоне выраженной гипоксии
При бледной форме одышка развивается позднее — к 5 годам.
Гипоксемические (одышечно-цианотические) приступы:
Причина - спазм инфундибулярного отдела ПЖ сердца (чаще отмечаются у больных с анемией и перенесших родовую травму).
Провоцирующие факторы - физическое и эмоциональное напряжение.
Клиническая картина:
возникают внезапно;
ребенок становится беспокойным,
резко усиливаются одышка и цианоз, но! одышка неэффективна, т.к. кровь все равно не поступает в мкк из-за спазма выходного отдела ПЖ
аускультативно - уменьшение интенсивности шума. ( из-за спазма кровь практически не поступает = шум уменьшается)
возможна потеря сознания, развитие гемипареза,
вынужденное положение на корточках.
Длятся около 30 минут. Затянувшийся приступ может привести к инсульту и смерти.
Диагностика: Физикальные данные
САД умеренно снижено.
Систолическое дрожание во II-III м/р слева от грудины
Границы сердца обычно не изменены.
Ослаблен ІІ тон над ЛА.
Во II-III м/р слева грубый систолический шум (стеноз ЛА) (при одышечно-цианотическом приступе он может ослабевать, вплоть до исчезновения).
Шум ДМЖП (в III-IV м/р слева) умеренный или может не прослушиваться.
ЭКГ - признаки гипертрофии правого желудочка, отклонение ЭОС вправо.
Рентгенография органов грудной клетки - сердце имеет форму деревянного башмачка (из-за гипертрофии ПЖ и западении дуги ЛА), небольших размеров, сосудистый рисунок легких обеднен. При бледной форме порока размеры сердца обычно больше, увеличены за счет обоих желудочков, сосудистый рисунок легких усилен.
Эхокардиография. Выявляется большой перимембранозный ДМЖП и смещение аорты вправо, исследуется анатомия выходного тракта правого желудочка, легочного клапана, легочной артерии и её ветвей вплоть до корней легких. Допплеровское исследование позволяет определить направление потока крови.
Прогноз:
Дети с ТФ постепенно становятся более цианотичными;
Гипоксические приступы могут приводить к неврологическим повреждениям и смерти;
Задержка развития наблюдается в случаях выраженного цианоза;
Тромбоэмболические осложнения и абсцессы головного мозга;
Септический эндокардит;
Полицитемия развивается вторично по отношению к цианозу;
Относительная железодефицитная анемия;
Коагулопатия – позднее осложнение долго существующего цианоза.
Лечение одышечно-цианотических приступов.
Цель - прервать порочный круг неэффективной одышки и гипоксии.
Ребенка следует привести в положение с согнутыми конечностями
Промедол 1% в дозе 0,1 мл/год жизни подкожно или внутримышечно для подавления возбуждения дыхательного центра.
Кислород обычно назначается, хотя не оказывает значительных изменений в насыщении крови кислородом
Ацидоз коррегируется введением 4% соды бикарбоната (NaHCO3) в дозе 4-5 мл/кг внутривенно. Сода снижает стимулирующее влияние ацидоза на дыхательный центр.
Если все эти меры не помогают, то вводят пропранолол (обзидан), 0,1 мг/кг в 10мл 20% раствора глюкозы назначается внутривенно медленно (0,05 мг/мин), снижает частоту ритма, может прервать приступ.
Интубация и перевод на искусственную вентиляцию легких с полной седатацией и миорелаксацией применяется в тяжелых случаях. После этого, обычно, следует хирургическое лечение.
При одышечно-цианотичном приступе противопоказано применение сердечных гликозидов, повышая инотропную функцию миокарда, они увеличивают склонность инфундибулярного стеноза к спазму.
Профилактика приступов - пероральное введение пропанолола (обзидана) в дозе 2-6 мг/кг/день в трех или четырех дозах.
N.В! По некоторым данным, длительный прием обзидана может повышать риск хирургического лечения из-за снижения сократительной способности миокарда.
19. Коарктация аорты: морфологические варианты, гемодинамические нарушения. Клиника, диагностика, лечение.
Коарктация аорты (КА) – сужение аорты или ее облитерация на ограниченном участке в области дуги, грудного или брюшного отдела.
 Чаще
локализуется в области перехода
аорты в нисходящую часть (в «типичном»
месте).
Чаще
локализуется в области перехода
аорты в нисходящую часть (в «типичном»
месте).
«Детский» тип - наличие открытого аортального протока и сужение аорты на большом участке ее дуги. Неблагоприятное течение (раннее формирование высокой легочной гипертензии).
«Взрослый» тип - изолированная КА.
Ассоциация коарктации аорты с другими кардиальными аномалиями наблюдается в 50% случаев (двустворчатый аортальный клапан (85%), обструктивные или гипопластические левосторонние дефекты развития и дефекты межжелудочковой перегородки).
Нарушения гемодинамики зависят от:
уровня сужения,
степени сужения аорты
развития коллатералей,
типа коарктации.
Объяснение классического типа (взрослого):
Т.к. артериальный проток закрыт, а выше сужения давление высокое, соответственно все сосуды, которые отходят от дуги аорты (левая подключичная, левая общая сонная, плечеголовной ствол + коронарные сосуды) также с высоким давлением, а все, что ниже – с низким давлением → хорошее развитие верхних конечностей, но гипотрофия мышц нижних (жалобы на сложность и боль при ходьбе + риск развития инфарктов и инсультов, жалобы на головные боли, мелькание мушек из-за АГ выше места сужения)
При выраженном сужении аорты ниже перешейка.
Артериальный проток продолжает кровоснабжать нисходящую аорту после рождения (фетальный тип кровообращения персистирует).
При снижении давления в легочной артерии -резко ухудшается кровоснабжение органов и тканей ниже диафрагмы → вплоть до развития анурии, ацидоза и смерти.
Ранняя хирургическая коррекция позволяет восстановить проходимость аорты. В качестве неотложной реанимационной меры применяется внутривенное введение простагландина Е1, что позволяет сохранять проходимость артериального протока сколько угодно долго.
При умеренном сужении аорты.
Ребенок переживает естественное закрытие артериального протока.
Развивается сеть коллатеральных сосудов, соединяющих дугу аорты с нисходящей аортой ниже коарктации.
Давление в аорте до коарктации становится выше нормального, а ниже места коарктации - ниже нормы.
Артериальная гипертензия → расстройства мозгового кровообращения, коронарного кровотока.
Клиническая картина:
У новорожденных первым клиническим проявлением может быть анурия, ацидоз и циркуляторный коллапс с сохранением удовлетворительного или пониженного давления на руках и отсутствием пульса и артериального давления на ногах.
В более старшем возрасте, также сохраняется характерная разница в артериальном давлении и наполнении пульса в верхней и нижней половине туловища, что является ценным диагностическим признаком.
Наиболее характерны жалобы на одышку, головные боли, головокружения, носовые кровотечения, боли в икроножных мышцах при ходьбе.
Физическое развитие больных часто не нарушено, но обращает внимание диспропорция тела: при хорошо развитом плечевом поясе нижняя половина тела относительно недоразвита.
Диагностика:
Физикальные данные
Границы сердца умеренно расширены влево.
Верхушечный толчок усилен и смещен влево
При аускультации отмечается систолический шум во втором-третьем межреберье слева. Шум более выражен в межлопаточном пространстве слева от позвоночника.
При развитом коллатеральном кровообращении шум может выслушиваться над всей грудной клеткой.
Пульс на бедренной артерии ослаблен или не пальпируется.
АД на ногах значительно снижено или не определяется.
ЭКГ - гипертрофия левого желудочка, отклонение ЭОС влево. Рентгенологически - увеличение левого желудочка, престенотическое расширение аорты, у детей старшего возраста — узурация нижних краев ребер. Эхокардиография - визуализация дефекта
Прогноз:
При инфантильном типе КА - течение тяжелое, смертность составляет 60%, средняя продолжительность жизни не превышает 2 лет. При «взрослом» типе - 35 лет. Без лечения развивается стойкая гипертония, приводящая к разрыву мешковидных аневризм артерий веллизиева круга, сердечная недостаточность, инфекционный эндокардит, гипертоническая энцефалопатия, у взрослых может происходить разрыв аорты.
Коарктация аорты является «пожизненным» заболеванием, пациенты до и после хирургической коррекции нуждаются в постоянном контроле за артериальным давлением, возникновением рекоарктации и сопутствующих аномалий. Пациенты нуждаются в постоянной профилактике инфекционного эндокардита.
Лечение:
Хирургическая коррекция:
Показания - в любом возрасте при установлений диагноза, как правило, в первые месяцы жизни. Операция заключается в резекции суженного участка, с восстановлением просвета аорты анастомозом "конец в конец" из левосторонней боковой торакотомии. Для расширения просвета аорты в месте коарктации может использоваться заплата или лоскут, выкроенный из собственной подключичной артерии. Летальность при этих операциях низкая, однако повышается при сопутствующих пороках. У 5%-10% больных отмечается рецидив коарктации после хирургического лечения. Процедурой выбора для этих больных является баллонная дилятация суженного сегмента.
20. Бронхиальная астма: определение, этиология, патогенез, классификация. Клиническая симптоматика у детей различных возрастных групп. Критерии степени тяжести течения болезни и тяжести приступа. Неотложная помощь при приступе в зависимости от степени тяжести. Клиническая и лабораторная диагностика бронхиальной астмы, функциональные методы исследования.
Бронхиальная астма (БА) – хроническое аллергическое заболевание дыхательных путей, которое характеризуется полной или частичной обратимой обструкцией дыхательных путей, возникающей вследствие:
Спазма гладкой мускулатуры бронхов;
Отека слизистой оболочки;
Гиперсекреции бронхиальных желез;
Гиперреактивности бронхов.
Проявляется: эпизодами свистящих хрипов, кашля, чувством стеснения в груди.
Этиология:
Сочетание внутренних и внешних факторов:
Внутренние факторы:
- Генетическая предрасположенность;
- Атопия – склонность к чрезмерному иммунному ответу иммуноглобулина Е (IgE) на в целом безвредные вещества из окружающей среды;
- Гиперреактивность бронхов;
- Пол (чаще у ♂);
- Расовая/этническая принадлежность.
Внешние факторы – факторы, способствующие развитию БА у предрасположенных к этому заболеванию люждей:
- Домашние аллергены: домашняя пыль, аллергены животных, тараканов, грибки;
- Внешние аллергены: пыльца, грибки;
- Профессиональные;
- Курение: пассивное, активное;
- Воздушные поллютанты;
- Респираторные, паразитарные инфекции;
- Социально-экономический статус;
- Диета, ожирение, прием ЛС.
Патогенез:
Аллергическое воспаление + бронхиальная геперреактивность + ремоделирование дыхательных путей.
При БА воспаление охватывает всю респираторную систему и является главной отличительной чертой.
Морфологически: гиперплазия бокаловидных клеток, инфильтрация слизистого и подслизистого слоя эозинофилами и лимфоцитами, повышение сосудистой проницаемости, отек и гипертрофия слизистой оболочки, гиперплазия ГМК.
Наличие и интенсивность воспалительного процесса бронхов устанавливается косвенно по «маркерам воспаления»:
- уровень IgE;
- количество эозинофилов и нейтрофилов, IL-5 в БАЛЖе (бронхоальвеолярный лаваж);
- уровень оксида азота и оксида углерода в выдыхаемом воздухе;
- LT C4.
Нейрогенная регуляция дыхательных путей осуществляется посредством нейропептидов: субстанция Р, вазоактивных интест.пептид (VIP), нейрокинины, кальцитонин.
Особенности клиники и диагностики у детей различных возрастных групп:
Дети первых двух лет жизни:
- Наследственная отягощенность аллергическими заболеваниями (особенно по матери);
- Высокая частота алл.реакций на пищевые продукты, ЛС, кожные проявления;
- Бурное течение бронхообструктивного синдрома с ранним началом во время ОРВИ;
- Отчётливый эффект бронхолитической терапии.
Дети 2-5 лет жизни:
- Ключевой критерий диагностики БА – персистирование на протяжении последнего года;
- Наиболее частые триггеры – вирусы;
!- БА, провоцируемая физической нагрузкой – уникальный фенотип в этом возрастной группе.
Дети 6-12 лет жизни:
- Провоцируемая вирусами астма остается обычный формой заболевания;
- Обострения, вызванные аллергенами, и сезонность можно выделить без особых затруднений.
Подростки старше 12 лет:
- Риск неконтролируемого течения БА при манифестации в подростковом периоде;
- Бронхоспазм в ответ на нагрузку (какую?);
- Доп.проблемы при выборе тактики ведения пациента: отказ от регулярного приема ЛС, потенциальный возраст начала курения = негативный фактор;
- Психоэмоциональный компонент = страх удушья формирует тревожность (модно очень) = отличие от сверстников и т.п.
Критерии степени тяжести приступа болезни:
- Частота дыхания (ЧДД);
- Участие вспомогательной мускулатуры в акте дыхания;
- Интенсивность свистящего дыхания;
- Вздутие грудной клетки;
- Характер дыхания (аускультативно);
- Вынужденное положение;
- Степень наличия сознания;
- Степень ограничения физической активности;
- Объём неотложной терапии для купирования приступа.
Легкое обострение (легикй приступ):
- Одышка при ходьбе;
- Незначительное повышение ЧДД;
- Участия вспомогательной мускулатуры в акте дыхания – нет;
- Умеренные сухие хрипы;
- ЧСС <100 уд/мин (старший возраст);
- ПСВ (пиковая скорость выдоха при пикфлоуметрии) – более 80% от нормы;
- Сатурация (SpO2) > 95%.
Среднетяжелое обострение (средне-тяжелый приступ):
- Одышка при ходьбе, разговоре, трудности при кормлении;
- Значительное повышение ЧДД;
- Нарушение речи – отдельные фразы;
- Активное участие вспомогательной мускулатуры в акте дыхания;
- Громкие сухие свистящие хрипы с обеих сторон;
- ЧСС >120/мин;
- ПСВ 60-80% от нормы;
- Сатурация (SpO2) 91-95%.
Тяжелое обострение (тяжелый приступ):
- Одышка в покое, ребенок прекращает принимать пищу;
- ЧСС 100-200/мин;
- Активное участие вспомогательной мускулатуры в акте дыхания;
- Громкие сухие свистящие хрипы с обеих сторон;
- ЧСС >120-200/мин;
- ПСВ <60% от нормы;
- Сатурация (SpO2) <90%.
Критерии степени тяжести течения болезни:


Неотложная помощь при приступе в зависимости от степени тяжести:
Приступ, не купирующийся в течение 6 часов и более – астматический статус – стадия немого легкого (спутанность сознания, заторможенность, парадоксальное дыхание, хрипы отсутствуют, брадикардия). При отсутствии должных мероприятий неотложной помощи может наступить летальный исход вследствие гипоксической комы.
При легком и среднетяжелом обострении БА всем пациентам рекомендуется многократное применение ингаляционных КДБА или комбинаций КДБА и ипратропия бромида. После первого часа необходимая доза КДБА будет зависеть от степени тяжести обострения. Легкие обострения купируются 2–4 дозами КДБА с помощью ДАИ каждые 3–4 ч; обострения средней тяжести требуют назначения 6–10 доз КДБА каждые 1–2 ч. Использование комбинации КБДА и ипратропия бромида** сопровождается снижением частоты госпитализаций и более выраженным улучшением ПСВ и ОФВ. У детей и взрослых с легким и умеренным обострением БА рекомендуется в качестве устройства доставки для короткодействующих бронхолитиков (препаратов для лечения обструктивных заболеваний дыхательных путей) ДАИ + спейсер или небулайзер. В случае отсутствия ответа или наличия сомнений в ответе на лечение рекомендуется направить пациента в учреждение, где может быть проведена интенсивная терапия. ГКС рекомендуется использовать для лечения всех обострений БА, кроме самых легких. Лечение тяжелых обострений БА рекомендуется проводить в стационарах с наличием ОРИТ. Пациентам с обострением БА и SрО2. Всем пациентам с тяжелым обострением БА в качестве препаратов первой линии рекомендуется использовать ингаляционных КДБА или комбинацию КДБА и ипратропия бромида. Пациентам с тяжелым обострением БА рекомендуется назначение преднизолона.
Клиническая и лабораторная диагностика бронхиальной астмы:
Диагноз БА у детей является клиническим: основан на наблюдении за больным и оценке симптомов (свистящие хрипы, кашель, одышка, а также развитие симптомов в ночное время или при пробуждении) при исключении других причин бронхиальной обструкции, наличии факторов риска развития БА, положительном ответе на терапию БА.
Клинические диагностические критерии:
- Анамнестические сведения; - Сбор аллергологического анамнеза; - Оценка клинического статуса;
Лабораторно-инструментальные диагностические критерии:
- Исследование аллергологического статуса (~кожные пробы); - Общий анализ крови; - Исследование мокроты; - Рентгенологическая картина органов грудной клетки; - Исследование ФВД: импульсная осциллометрия, пикфлоуметрия, вентилометрия, спирометрия, спирография, пневмотахометрия, бодиплятизмография, бронхография; - Исследование газов крови (парциальное давление О2, СО2); - Пульсоксиметрия; - Бронхоскопия (строго по показаниям).
Функциональные методы исследования: см. чуть выше.
21. Бронхоэктатическая болезнь: этиология, патогенез, клинические проявления, диагностика, осложнения, принципы лечения, Показания к хирургическому лечению.
Бронхоэктатическая болезнь – хроническое приобретенное, а в ряде случаев врожденное заболевание, характеризующееся необратимыми изменениями (расширением, деформацией) бронхов, сопровождающимися их функциональной неполноценностью, нарушением дренажной функции и хроническим гнойно-воспалительным процессом в бронхиальном дереве, перибронхиальном пространстве с развитием ателектазов, эмфиземы и цирроза в паренхиме легкого
Этиология:
1. Врожденные структурные аномалии строения бронхолегочной системы (синдром Вильямса-Кэмпбелла, баллонирующие БЭ, синдром Мунье-Куна, трахеобронхомегалия, трахеомаляция, бронхомаляция, стенозы трахеи и/или бронхов, бронхогенные кисты, трахеальный бронх, легочная секвестрация, кистозно-аденоматозная мальформация)
2. Обструкция бронха:
вызванная внешними причинами (лимфаденопатия, аномальный сосуд, опухоль);
внутрибронхиальная обструкция инородным телом вследствие аспирации;
внутрибронхиальная обструкция объемным образованием (опухоль, гранулема и т.д.);
3. Дефицит α -антитрипсина;
4. Нарушения мукоцилиарного клиренса:
первичная цилиарной дискинезия (ПЦД);
муковисцидоз (в том числе, при атипичных формах);
5. Вследствие неблагоприятного исхода различных тяжело протекавших инфекций: коклюша, кори, аденовирусной инфекции, пневмонии, туберкулеза.
6. При первичных иммунодефицитных состояниях (агаммаглобулинемия, общий вариабельный иммунодефицит, селективная недостаточность иммуноглобулина А, селективная недостаточность субклассов иммуноглобулина G, тяжелый комбинированный иммунодефицит, атаксия-телеангиоэктазия (синдром Луи-Барр), синдром Джоба (гипер-IgE-синдром), хроническая гранулематозная болезнь, дефицит транспортеров, связанных с презентацией антигенов, дефекты комплемента)
7. Вторичная иммуносупрессия (онкогематологические заболевания, аллогенная трансплантация, в т.ч., костного мозга, применение иммуносупрессивных лекарственных препаратов)
8. Аллергический бронхолегочный аспергиллез (АБЛА)
9. При аутоиммуных системных заболеваниях соединительной ткани (ревматоидный артрит, системная склеродермия, рецидивирующий полихондрит (синдромМейенбурга-Альтхерра-Юлингера))
10. Воспалительные заболевания кишечника:
язвенный колит,
болезнь Крона;
Воспалительный процесс при бронхоэктазиях может быть вызван следующими микробами
Haemophilus influenzae;
Streptococcus pneumoniae;
Moraxella catarralis.
Staphylococcus aureus;
Pseudomonas aeruginosa.
Патогенез:
Предрасполагающие факторы:
наследственная предрасположенность (генетически обусловленная неполноценность бронхиальной стенки: признаки дисплазии соединительной ткани в виде недостаточного развития мышечного, эластического, и хрящевого каркаса);
вредные привычки и инфекция матери во время беременности;
наличие гастроэзофагеального рефлюкса;
локализации процесса в базальных и язычковых сегментах, средней доле;
сниженная реактивность макроорганизма;
нерациональное лечение;
ателектазы различного происхождения;
промышленное и бытовое загрязнение атмосферы, пассивное курение, вызывающие гиперреактивность бронхов с нарушением мукоцилиарного клиренса.
В патогенезе первичных бронхоэктазов ведущее значение придается двум факторам — воспалению и нарушению бронхиальной проходимости (обтурационный ателектаз бронхов).
Воспалительный процесс в бронхах, вызывая метаплазию эпителия, полипоз, изъязвления, разрушение эластических и мышечных структур, деструкцию хрящевых колец, ведет к развитию склероза в стенках бронхов, снижению их сопротивляемости «кашлевому толчку», тем самым обуславливая их деформацию. В результате этого бронхи теряют способность в достаточной мере опорожняться от секрета. В этих условиях транзиторное повышение внутрибронхиального давления при кашлевом рефлексе и отрицательное внутриплевральное давление, усиливающееся вследствие уменьшения объема ателектазированной части легкого, способствуют формированию бронхоэктазов. Таков генез цилиндрических БЭ, что же касается мешотчатых БЭ, то ведущую роль в этом случае играет переход воспалительного процесса (например, при затяжной пневмонии) на стенку бронха и ее одностороннее выпячивание (“тракция”) при фиброзном перерождении волокон соединительной ткани (“фиброателектаз”).
Нарушение бронхиальной проходимости вследствие аспирации и других причин также способствует развитию бронхоэктазов. Важную роль при этом играет не только сужение крупного бронха, но и инфицирование бронхиального секрета дистальнее места обтурации, что приводит к воспалительному процессу в легких.
Развивающиеся расстройства крово- и лимфообращения, иннервации структур легкого, гипоксия, интоксикация вызывают метаболические нарушения, создают условия для развития фиброзной ткани и пневмосклероза. Склерозирование охватывает дистальные отделы бронхов и перибронхиальной ткани в одном или нескольких сегментах, что приводит к рубцовому сморщиванию пораженного участка легочной паренхимы.
Классификация:
По происхождению:
первичные (врожденные) бронхоэктазы, связанные с наследственно обусловленными изменениями структуры и функции воздухоносных путей;
вторичные (приобретенные) бронхоэктазы, возникающие на фоне воспалительных процессов в легких и бронхах.
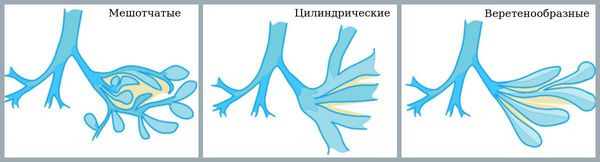
По форме расширения бронхов:
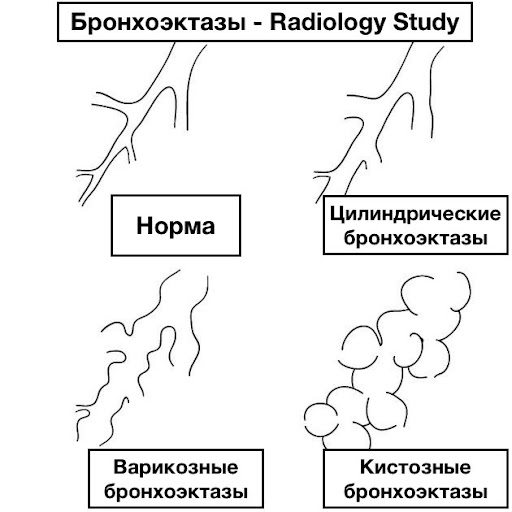 Цилиндрические
возникают в
основном при склерозе бронхиальных
стенок. При этом просвет бронха
расширяется равномерно на достаточно
большом протяжении. Чаще всего это
происходит на фоне других болезней
легких (вторичные бронхоэктазы).
Цилиндрическая форма не способствует
скоплению большого объема гноя, поэтому
общее состояние больных, как правило,
не слишком тяжелое.
Цилиндрические
возникают в
основном при склерозе бронхиальных
стенок. При этом просвет бронха
расширяется равномерно на достаточно
большом протяжении. Чаще всего это
происходит на фоне других болезней
легких (вторичные бронхоэктазы).
Цилиндрическая форма не способствует
скоплению большого объема гноя, поэтому
общее состояние больных, как правило,
не слишком тяжелое.
Мешотчатые - одиночные шарообразные или овальные расширения с одной стороны бронха. Нередко данная форма встречается при врожденных дефектах развития легочной ткани. Мешки представляют собой слепые выпячивания стенки, которые могут достигать больших размеров. Здесь скапливается значительный объем мокроты и гноя. Течение болезни у таких пациентов обычно тяжелое.
Описываются также кистовидные, веретенообразные и варикозные
п
 о
степени тяжести: легкую, среднетяжелую
и тяжелую формы;
о
степени тяжести: легкую, среднетяжелую
и тяжелую формы;
по фазе заболевания:
Фаза обострения – активный воспалительный процесс с накоплением гноя. В этот период симптомы заболевания наиболее яркие.
Фаза ремиссии характеризуется отсутствием острых симптомов. БЭ при этом сохраняются.
Диагностика:
Жалобы
У большинства детей отмечаются часто рецидивирующие респираторные инфекции с явлениями бронхита. Достаточно рано появляется кашель с выделением гнойной мокроты. Помимо этого, может отмечаться свистящее дыхание, слышимое на расстоянии и/или «оральная крепитация». При распространенном процессе с варикозными и/или мешотчатыми БЭ может отмечаться одышка.
+ синдром хронической интоксикации: общая слабость, повышенная психическая и физическая утомляемость, снижение аппетита, бледность, тени под глазами, потливость.
+ синдром дыхательной недостаточности: нерезкий цианоз вокруг рта, носа, акроцианоз и одышка, появляющиеся при физической нагрузке и в покое;
Физикальное обследование
Могут наблюдаться различные деформации грудной клетки. При распространенном поражении легочной ткани нередко можно обнаружить косвенные признаки хронической гипоксии: деформации концевых фаланг пальцев по типу «барабанных пальцев» и/или ногтей по типу «часовых стекол».
Перкуторно над легкими может выслушиваться коробочный оттенок звука и/или участки притупления, при аскультации – ослабление дыхания, сухие и разнокалиберные (преимущественно среднепузырчатые) влажные хрипы локальные или распространенные, в зависимости от объема поражения.
Лабораторная диагностика
уровень иммуноглобулинов в сыворотке крови
микробиологическое исследование мокроты (индуцированной мокроты, трахеального аспирата) для идентификации патогенна (патогенов) и определения чувствительности выделенной микрофлоры.
Инструментальная диагностика
Компьютерная томография – основной метод диагностик БЭ.
Принято выделять прямые и косвенные признаки БЭ. К прямым относят расширение просвета бронхов, отсутствие нормального уменьшения диаметра бронхов по направлению к периферии, видимость просветов бронхов в кортикальных отделах лёгких (в норме мелкие бронхи не видны на расстоянии менее 1-2 см от плевры). Бронх считается расширенным, если его внутренний просвет значительно превышает диаметр сопутствующей ему парной ветви лёгочной артерии (симптом «перстня» или «кольца с камнем»). Косвенные признаки включают: утолщение или неровность стенок бронхов, наличие мукоцеле, неравномерную воздушность лёгочной ткани в зоне расположения изменённых бронхов.
Рентгенографии органов грудной клетки- может выявить косвенные признаки обструктивного синдрома, усиление и деформация легочного рисунка, однако данный метод недостаточно информативен при бронхоэктаза.
Оценка функции легких. Исследование функции внешнего дыхания (спирометрия) возможно у детей, достигших школьного возраста. У детей грудного возраста и далее – со школьного возраста возможно проведение бодиплетизмографии. Наиболее часто у пациентов с бронхоэктазами выявляются обструктивные или комбинированные нарушения вентиляции (в зависимости от объема и характера поражения бронхиального дерева). При спирометрическом исследовании следует проводить пробу с бронхолитическим препаратом, т.к. у ряда детей с бронхоэктазами одним из компонентов в генезе бронхиальной обструкции может быть бронхоспазм.
Лечение:
При лечении БЭБ в настоящее время предпочтение отдается консервативным методам терапии, направленным на подавление инфекции, улучшение бронхиальной проходимости, восстановление нарушенной реактивности организма и легочной резистентности.
Антибактериальная терапия проводится согласно следующим принципам:
Антибиотики назначаются при бактериальной природе активного воспалительного процесса, сопровождающегося:
усилением одышки, появлением (усиление) гнойного характера мокроты;
лихорадкой (температура тела выше 38 °С) в течение более 3 дней;
обострением на фоне гипотрофии.
Антибактериальная терапия назначается индивидуально в зависимости от возраста пациента, степени тяжести основного заболевания, наличия сопутствующей патологии и включает:
пенициллины расширенного спектра действия
цефалоспорины
макролиды
аминогликозиды
Длительность курса антибактериальной терапии определяется индивидуально, но лучше назначать пролонгированные курсы лечения (3 нед.).
С целью улучшения отхождения мокроты применяются муколитические препараты: ацетилцистеин, амброксол.
Бронхоспазмолитическая терапия: сальбутамол, ипратропия бромид или ипратропия бромид+фенотерол.
Кинезитерапия - один из важных компонентов комплексного лечения при БЭ.
Главная цель проведения кинезитерапии — очищение бронхиального дерева от скоплений мокроты, предрасполагающих к развитию инфекционных заболеваний бронхолёгочной системы.
Наиболее часто используют следующие методики кинезитерапии: - постуральный дренаж; - перкуссионный массаж грудной клетки; - активный цикл дыхания; - контролируемое откашливание.
Показания к хирургическому лечению:
Рекомендовано проведение хирургического лечения бронхоэктазов (резекция части легкого) при:
локализованных БЭ (распространенность не более, чем на одну долю - ограниченный процесс), являющиеся источником частых обострений инфекций нижних дыхательных путей, существенно ухудшающих качество жизни пациента;
опасных (более 200 мл/сут) кровотечениях или кровохарканье (не контролируемое консервативной терапией) из локальной зоны поражения. Альтернативой резекции в последнем случае является эмболизация бронхиальной артерии.
22. Дисфункция билиарного тракта: этиология, патогенез, классификация. Клиническая картина различных ее видов. Основные клинические синдромы. Клинико-инструментальные методы диагностики. Дифференциальная диагностика, лечение, диспансерное наблюдение.
Функциональные расстройства билиарного тракта – это комплекс клинических симптомов, развивающихся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров. Главный симптом – боль.
Римские критерии III (2006 г.)
Е1 – Функциональные нарушения Желчного Пузыря
Е2 – Функциональное билиарное нарушение Сфинктера Одди
Е3 – Функциональное панкреатическое нарушение Сфинктера Одди
+*смешанные
Значение желчи: нейтрализация HCl/пепсина, активация ферментов, эмульгирование жиров, ↑всасывания витаминов A, D, E, K. ↑перистальтики и тонуса кишечника, ↓размножения гнилостных бактерий, ↑стимуляции холереза (обр-я желчи), экскреция лекарств, токсинов, ядов.
Состав желчи: Вода – основа желчи. 70% из желчных кислот, 22% из фосфолипидов (лецитин), 4% из ХСа, 3% из белков, 0,3% из билирубина, 0,7% прочее.
Этапы синтеза желчи: Желчь синтезируется в печени: печеночно-клеточный этап → каналикулярный → дуктулярный → пузырный → интестинальный этапы.
Классификация:
По локализации (вспоминаем Римские критерии 2006 выше):
● Функциональные расстройства Желчного Пузыря (ЖП) – это расстройство его моторики в сочетании с нормальными показателями активности печеночных ферментов, конъюгированного билирубина и амилазы/липазы.
● Функциональные расстройства Сфинктера Одди:

По этиологии:
● Первичные
● Вторичные
Этиология:
- Психоэмоциональные состояния, окружающая обстановка = стрессовый фактор; - Нейрогуморальные нарушения регуляции биллиарный системы (vagus, ХЦК = сокращение ЖП и расслабление сфинктеров, секретин = ↑Н2О и карбонатов в секрете ЖП); - Гиперсенситивные состояния; - Нарушения и воспалительные повреждения ДПК, желудка, ПЖ, спазм и раздражение сосочков, сфинктеров; - Внутрипротоковая и внутриполостная гипертензия; - Режим питания, качество и количество пищи; - Особенности конституции; - Пищевая аллергия, паразитозы ЖКТ, отравления, вирусные гепатиты; - Эндокринные заболевания, родовые травмы, очаги хрон.инфекции, аномалии строения.
Патогенез:
1. Нарушение функции гепатоцита = дисхолия 2. Нарушения неврогенной регуляции мышечной стенки ЖП центрального генеза (неврозы) и периферического типа (при патологии ЖКТ) 3. Нарушение секреции энтеральных гормонов 1 + 2 + 3 = ↑давления в ЖП + гипертонус сфинктеров = БОЛЕВОЙ СИНДРОМ
Клиническая картина различных ее видов:
При патологии ЖП – тошнота, рвота, вздутие, нарушение стула, боли.
При патологии СФО – спазм, боль, особенно после еды.
Основные клинические синдромы:
● Абдоминальные боли билиарного типа – варьирует боль от постоянной до приступообразной в области правого подреберья.
*дистензионные боли – распирающие боли, ощущение тяжести, жгучие;
*спастические боли – режущие, тянущие, схватывающие.
● Диспептические расстройства: поносы, запоры, метеоризм, урчание, отрыжка, рвота, изжога;
● Вегетативные расстройства: головные боли, головокружение, нарушение сна, ↑утомляемость, ↓умственной и физической работоспособности, ↓психо-эмоциональной устойчивости.
Клинико-инструментальные методы диагностики:
Диагностические критерии:
Болевые эпизоды длительностью 30 мин и более;
Симптомы рецидивируют с разными интервалами;
Боли достигают постоянного уровня;
Боли умеренные или сильные, нарушают привычный образ жизни и могут «привести» в больницу;
Боли не уменьшаются после стула (для исключения синдрома раздр.киш. СРК);
Боли не уменьшаются при смене положения тела;
Боли не уменьшаются после приема антацидов и антисекретинов;
Исключены другие структурные заболевания с такой симптоматикой
Боли в правом подреберье (м.б. эпигастрий) + 8 критериев = правомерный диагноз.

Лабораторно-инструментальные методы диагностики:
● Идеальный порядок обследования: -ОАК -ОАМ -Обзорное УЗИ брюшной полости -Биохимия крови (АСТ, АЛТ, ЩФ, Билирубин) -Копрологический тест на панкреатическую эластазу I -Копроовоскопия -ФГДС (у детей раннего возраста по особым показаниям)
● Уточняющие методы: -Многомоментное фракционное УЗИ -Дуоденальное зондирование -УЗИ ЖП
● Усложнение процесса диагностики: -Эндоскопическая ретроградная холангиопанкреатография -Холецистография -Динамическая гепатосцинтиграфия
● Чаще всего в реальных условиях применяют: -УЗИ брюшной полости и ЖП -ФГДС -Микроскопические исследование кала -Тест на фекальную эластазу
Диф. диагностика: с другими заболеваниями ЖКТ, имеющими схожую симптоматику, в том числе и с острым аппендицитом = как и с любой другой патологией из рязряда «Острого Живота»
Лечение:
Стол №5 по Певзнеру, но не при дисфункции ЖП (короче говоря – ЩД)
Лекарственная терапия: а) препараты для коррекции невротических и вегетативных расстройств; б) желчегонная терапия.
Фитотерапия
Ферментные препараты (400-500 МЕ на 1г жира в пище)
При функ.р-вах СФО – УРСОСАН (имеет антихолестатический и гепатопротективный эффекты 10-15 мг/кг/сутки)
Бальнеотерапия
Тюбажи по Демьянову (Ессентуки 7)
Физиотерапия
Санаторно-курортное лечение
Желчегонная терапия:
1-я группа: препараты, стимулирующие желчеобразование – ХОЛЕРЕТИКИ, за счёт ↑функциональной активности гепатоцитов: а) препараты, содержащие желчные к-ты, ферменты, растительные экстракты – Аллохол, Дигестан, Хофетол б) синтетические препараты: Никодин в) препараты растительного происхождения: Холосас, Хологон г) препараты ↑секрецию желчи за счёт Н2О = гидрохолеретики: минеральные воды, препараты валерианы.
2-я группа: препараты, стимулирующие желчевыведение: а) ХОЛЕКИНЕТИКИ: ↑тонус ЖП и ↓тонус желчных путей (MgSO4, Берберин, Сорбит) б) ХОЛЕСПАЗМОЛИТИКИ: ↓тонус СФО (Атропин, Нош-па, Платифиллин)
23. Хронические гастродуодениты: классификация, этиология (экзо- и эндогенные факторы). Патогенез, клиническая симптоматика, диагностика, лечение, профилактика, диспансерное наблюдение.
Хронический гастрит и хронический гастродуоденит – это полиэтиологическое, неуклонно прогрессирующее хроническое воспалительно-дистрофическое заболевание желудка и/или ДПК.
Эпидемиология: ≈ 100 на 1000 детей. 20-80% населения инфицированы Helicobacter pylori (HP).
Этиология:
● Экзогенные факторы:
-HELICOBACTER PYLORI (HP);
- алиментарные: пища всухоматку, острая(возможно), жаренная пища, ↓белка в пище, ↓витаминов, нарушение режима питания;
- психоэмоциональные: стрессы, депрессии;
- экологические: ↓кач-ва воды, нитраты в еде;
- прием ЛС: а/б, ГКС, НПВС;
- паразитарные заболевания: лямблиоз;
- пищевая аллергия;
- вредные привычки, несоблюдение гигиены
- гормональные дисфункции.
● Эндогенные факторы:
- рефлюкс желчи в желудок (моторно-эвакуаторные нарушения);
- нейрогуморальные расстройства;
- генетическая предрасположенность (теория).
Классификация («Сиднейская система»):
1) По форме: острые, хронические, особые формы (гранулематозный, эозинофильный);
2) По этиологии:
- тип А: Аутоиммунный (ассоциированный с вирусом Эпштейна-Барр);
- тип В: Ассоциированный с Helicobacter pylori (HP);
- тип С: Ассоциированный с дуоденогастральными рефлюксами (реактивный);
- идиопатический.
3) По локализации: антральный, фундальный, пангастрит;
4) По характеру эндоскопии: эритематозный, эрозивный, атрофический, геморрагический, гиперпластический;
5) По гистологии: с легкой/умеренной/тяжелой степенью воспаления, атрофии, кишечной метаплазии.
Патогенез:

Факторы защиты:
- Секреция желудочной слизи;
- Продукция бикарбонатов;
- Регенерация эпителия;
- Кровоток в СО желудка;
- Синте простагландинов (Pg), антитрипсина.
Факторы агрессии:
- Гиперсекреция HCl;
- Гиперпродукция пепсина;
- Нарушение моторики;
- Helicobacter pylori (HP);
- Прямое травматическое действие пищи.
Факторы патогенности Helicobacter pylori:
сам Хеликобактер – микроаэрофил, Гр(-), спиралевидный;
- жгутики;
- экзотоксин (VacA) – образование вакуоли в эпителиоцитах;
- эффектор (CagA) – ингибирование роста клеток и апоптоза + повреждение СО желудка;
- ферменты: протеаза, липаза, муциназа → повреждение СО желудка;
- уреаза = нейтрализация HCl → повр. СО желудка аммиаком «аммиачное облачко»;
- ЛПС;
- белки-поверхности;
- защелачивает рН в антральном отделе желудка = ↑секреции гастрина = ↑HCl.
«Каскад Correa»

Клиническая симптоматика:
● Болевой синдром:
- локализуется в эпигастральной, околопупочной областях, иногда разлитая;
- постоянная, интенсивная, имеет ночной «голодный» характер, уменьшается при приеме пищи и антацидов;
*ранние боли – фундальный гастрит;
*поздние боли – антральный гастрит;
*боли в ночное время – дуоденит;
● Диспепсический синдром:
- кислая отрыжка; - отрыжка воздухом; - изжога; - склонность к запору
● Астенический синдром:
- вегетативная нестабильность;
- быстрая утомляемость;
- раздражительность.
Методы диагностики Helicobacter pylori:
- гистология при биопсии: результат зависит от места взятия и качества биоптата;
 -
быстрый уреазный тест – биоптат погружают
в специальный раствор. При положительной
(+) реакции раствор окрашивается в
малиновый цвет. Время выполнения 15-30
минут;
-
быстрый уреазный тест – биоптат погружают
в специальный раствор. При положительной
(+) реакции раствор окрашивается в
малиновый цвет. Время выполнения 15-30
минут;
- серологический метод – сомнительно, но окей;
- анализ кала на антиген HP – супергуд;
- 13С-уреазный дыхательный тест – супергуд →
Эрадикация Helicobacter pylori:
- используют 10-14 дневные курсы мощной 3-ёх, 4-ёх комбинированной терапии. Сразу просчитываются 2 линии терапии и при неудаче в 1-ой – сразу используют 2-ую:
1-я линия:
◦ ИПП + кларитромицин + метронидазол
(ингибиторы протонной помпы) (макролид) (противопротозойный препарат с антибактериальной активностью)
◦ ИПП + кларитромицин + Де-НОЛ
(Противоязвенное средство с бактерицидной активностью в отношении Helicobacter pylori)
◦ ИПП + амоксициллин + Де-НОЛ
(а/б широкого спектра, пенициллинового ряда)
2-я линия:
◦ ИПП + кларитромицин + Де-НОЛ + нифурател
(противомикробное средство из группы нитрофуранов; оказывает противопротозойное, противогрибковое и антибактериальное действие)
!Оценка эффективности линии терапии через 4-6 недель!
Лечение ХГ, ХГД:
● Задачи лечения:
- эрадикация инфекции (HP);
- восстановление СО желудка;
- нормализация функций клеток СО желудка;
- ликвидация нарушений моторики и пищеварения;
- предупреждение прогрессирования заболевания;
- лечение сопутствующих осложнений со стороны ЖКТ;
● При секреторной недостаточности:
- диетотерапия – ЩД, а затем сокогонный стол;
- заместительная терапия натуральный желудочным соком;
- для трофики и регенерации – липоевую кислоту, витамин U;
- фитотерапия – мята, тясячелистник, ромашка;
● При повышенной кислотообразовательной функции:
- антациды, адсорбенты (фосфалюгель);
- антисекреторные с-ва (атропин, платифиллин);
- блокаторы Н2-гистаминовых Re (ранитидин, фамотидин);
- ИПП (омепразол, лансопразол);
- прокинетики при ↓моторики (метоклопрамид, мотилиум);
- спазмолитики при болях (Нош-па);
- физиотерапия, Ессентуки 4, 17;
- эрадикация HP по показаниям
- при ваготонии (беллатаминал, белласпон);
- при симпатикотонии (валериана, диазепам).
Профилактика: убирай этиологический фактор. Диспансеризация: 2 раза в год.
24. Язвенная болезнь желудка и 12-перстной кишки: этиология, патогенез, предрасполагающие факторы, классификация, клиника, диагностика, лечение, дис-пансерное наблюдение, показания к хирургическому лечению, клинические признаки осложнений. Неотложная терапия.
Язвенная болезнь (ЯБ) – хроническое рецидивирующее заболеваие, протекающее с чередованием периодов обострения и ремиссии, ведущим проявлением которого служит образование дефекта (язвы) в стенке желудка и ДПК. Данный диагноз является эндоскопически-морфологическим.
Этиология: ЯБ полиэтиологическое, генетическое и патогенетически неоднородное заболевание.

Патогенез:
В основе патогенеза лежит нарушение равновесия между факторами кислотно-пептической агрессии желудочного содержимого и элементами защиты СО желудка и ДПК. Факторы агрессии и защиты + роль Helicobacter pylori см. раньше.
Классификация:

Клиническая картина:
● Болевой синдром:
- боли в эпигастрии, околопупочной области, имеют ночной и «голодный» характер, ↓при приеме пищи и антацидов; (Голод→Боль→Еда→Уменьшение боли) Еда – естественный мощный антацидный фактор.
● Диспепсический синдром:
- изжога, отрыжка, рвота, тошнота, запоры, неустойчивый стул;
● Астенический синдром:
- вегетативная нестабильность, быстрая утомляемость, раздражительность.
Диагностика:
- анамнез;
- физикальное обследование;
- исключение осложнений;
Лабораторные методы:
- определение инфицирования H. pylori:
а) фекальный антиген;
б) С13-дыхательный тест;
в) АТ в сыворотке крови.
Инструментальные методы:
- ФГДС;
- УЗИ;
- рН-метрия;
- КТ.
Лечение:
- Консервативное лечение как при ХГ, ХГД (см.раньше) (эрадикация H. pylori);
- Хирургическое лечение при осложнении (перфорация, пенетрация, стеноз привратника, кровотечение, малигнизация);
- ЛФК;
- Физиотерапия;
- Диета.
Диф. диагностика:
- Функциональные нарушения;
- ХГ, ХГД;
- Хронические заболевания печени, ЖВП, ПЖ;
Проводится на основе проведения сбора анамнеза, лабораторных и инструменальных методов диагностики.
Ниже представлена таблица по дифференциальной диагностике заболеваний ЖКТ:
|
ЯБЖ, ЯБДПК |
ЯБ, осложненная кровотечением |
ЯБ, осложненная стенозом |
ЯБ, осложненная пенетрацией |
ЯБ, осложненная перфорацией |
Этиология, патогенез |
● Наследственная отягощенность: Генетически детерминированная высокая плотность париетальных клеток; Повышенная чувствительность к гастрину; Дефицит ингибиторов трипсина; Врожденный дефицит антитрипсина и др. ● Неблагоприятные факторы: Инфицирование Helicobacter pylori; Длительная погрешность в питании; Психоэмоциональный стресс; Вредные привычки.
● Нарушение равновесия между факторами кислотнопептической агрессии желудочного содержимого и элементами защиты СО желудка и ДПК; ● Дисбаланс факторов защиты и факторов агрессии. |
То же |
То же |
То же |
То же |
Морфология |
Язвенный дефект слизистой оболочки и сопряженный с ним активный гастродуоденит, нередко и рефлюкс-эзофагит, а в фазе ремиссии - постъязвенные рубцовые изменения и гастродуоденит без признаков активности воспалительного процесса. |
Имеет неправильную форму, неровные края, воронкообразную форму с верхушкой к серозной оболочке, изнутри слой некроза. |
Стеноз бывает органическим, как следствие рубцового процесса, и функциональным, связанным со спазмом и отёком пилорического канала. Функциональный стеноз бывает практически у всех пациентов в фазе обострения язвенной болезни. |
Имеет неправильную форму, неровные края, воронкообразную форму со сквозным отверстием. |
Имеет неправильную форму, неровные края, воронкообразную форму со сквозным отверстием. |
Жалобы |
● Абдоминальные боли: Локализуется в эпигастральной, околопупочной областях, иногда разлитая; Постоянная, интенсивная, имеет ночной «голодный» характер, уменьшается при приеме пищи. ● Диспепсический синдром: кислая отрыжка, отрыжка воздухом, изжога, склонность к запору. ● Астенический синдром: вегетативная нестабильность, быстрая утомляемость, раздражительность. |
Рвота «кофейной гущей» и дёгтеобразный стул. |
Боль, усиливающаяся после еды и сопровождающаяся рвотой. |
Постоянная боль, иррадиирующая в спину и подреберье и не исчезающая после еды или приёма антацидных препаратов. |
Внезапно возникшая интенсивная разлитая боль в животе. |
Объективный осмотр |
Наличие выраженных болей в эпигастральной или околопупочной области при пальпации, «доскообразный живот». |
То же |
То же |
То же |
То же + бледность СО и кожных покровов. |
Диагностика |
1) ЭФГДС; 2) Контрастное рентгенологическое исследование; 3) Аспирационно-титрационный метод исследования секреции соляной кислоты; 4) Метод 24-х часовой внутрижелудочной рН-метрии; 5) Идентификация H.pylori. |
То же + визуальная оценка язвенного дефекта с возможным коагулированием сосудов или наложением зажимных клипс |
То же |
То же |
То же |
Принципы терапии |
1) Эрадикационная терапия H. pylori; 2) ИПП 3) Антацидные препараты 4) Прокинетики, спазмолитики 5) Контроль лечения ЭФГДС |
То же + хирургическое лечение |
То же + хирургическое лечение |
То же + хирургическое лечение |
То же + хирургическое лечение |
|
Холепатии |
ФД |
ГЭРБ |
ХГД |
Этиология, патогенез |
● Психоэмоциональные состояния, окружающая обстановка; ● Нейрогуморальные нарушения регуляции билиарной системы; ● Гиперсенситивные состояния; ● Нарушения и воспалительные повреждения ДПК, желудка, ПЖ, спазм сфинктеров, раздражение сосочков; ● Внутрипротоковая и внутриполостная гипертензия; ● Режим питания, качество и количество пищи; ● Особенности конституции; ● Пищевая аллергия; ● Паразитозы ЖКТ; ● Отравления, vir. Hep; ● Эндокринные заболевания; ● Родовые травмы (в нео. периоде); ● Очаги хронической инфекции; ● Наследственность; ● Аномалии развития. ---------------------------- ● Нарушение функции гепатоцита = дисхолия; ● Нарушение неврогенной регуляции мышечной стенки ЖП центрального (неврозы) и периферического (патология ЖКТ) генеза; ● Нарушение секреции энтеральных гормонов. = ↑ давления в ЖП; = гипертонус сфинктеров; = болевой синдром. |
● Факторы, вызывающие висцеральную гиперчувствительность; ● Факторы нарушения мукозального гомеостаза (НПВС, а/б, пищевая аллергия, инф. H. pylori); ● Наследственная предрасположенность; ● Социальная дезадаптация; ● Психологическое напряжение; ● Стресс, утомление; ● Нарушение режима сна, учебы и отдыха; ● ОКИ, пищевые токсикоинфекции; ● ГЭР, ДГР; ● Замедление эвакуации еды из желудка, ДПК; ● Нарушение секреции грелина, гастрина, ХЦК. |
● Непроизвольное забрасывание желудочного либо желудочно-кишечного содержимого в пищевод ----------------------------- ● Факторы защиты: Антирефлюксная функция кардии; Резистентность СО пищевода; Эффективный клиренс; Своевременная эвакуация желудочного содержимого.
● Факторы агрессии: Гиперсекреция соляной кислоты; Агрессивное воздействие лизолецитина, желчных кислот, панкреатического сока при дуодено-гастральном рефлюксе; Некоторые лекарственные препараты; Некоторые продукты питания |
● Экзогенные факторы: Алиментарный: пища всухомятку, острая, жаренная пища, ↓Б, ↓vit., нарушение режима питания; Психоэмоциональный: стрессы, дипрессия, неуспехи в учебе, семье; Экологический: ↓кач-ва воды, нитраты в воде; Прием ЛС: НПВС, а/б, ГКС; Паразитарные заб-я: лямблиоз; Пищевая аллергия; Вредные привычки; Несоблюдение гигиены; Гормональные дисфункции; H. Pylori. ● Эндогенные факторы: Моторно-эвакуаторные нарушения (рефлюкс желчи в желудок); Эндокринные расстройства; Расстройства нервной системы. -------------------------------------- ● Факторы защиты: Секреция желудочной слизи Продукция бикарбонатов Регенерация эпителия Кровоток в СО желудка Синтез Pg Антитрипсин ● Факторы агрессии: Гиперсекреция HCl Гиперсекреция пепсина Нарушение моторики Helicobacter Pylori Прямое травмирующее действие |
Морфология |
|
|
Воспаление, активность, метаплазия |
Воспаление, активность, метаплазия |
Жалобы |
● Абдоминальные боли билиарного типа – варьирует боль от постоянной до приступообразной в области правого подреберья: - дистензионные боли – распирающие боли, ощущение тяжести, жгучие; - спастические боли – режущие, тянущие, схватывающие. ● Диспептические расстройства – поносы, запоры, метеоризм, урчащие, отрыжка, рвота, изжога; ● Вегетативные расстройства – головные боли, головокружение, нарушение сна, ↑ утомляемости, ↓ ум./физ. работоспособности, ↓ психо-эмоциональной устойчивости, могут быть кардиалгии. |
● Постпрандиальный дистресс-синдром – чувство переполнения после еды или раннее насыщение, вздутие, тошнота, чрезмерная отрыжка; ● Синдром эпигастральной боли – боль (достаточно сильная, меняет образ жизни). Боль в эпигастрии или околопупочной области, не распространяясь в другие отделы. Боль не утихает после дефекации или отхождения газов; ● Смешанный вариант. |
● Эзофагеальные симптомы: Изжога, регургитация, отрыжка воздухом, кислоым, горьким, периодическая боль за грудиной, одинофагия, дисфагия. ● Экстраэзофагеальные симптомы: Приступы кашля, постоянное покашливание, апноэ, чувство першения, боли в ухе, аритмии, эрозии эмали зубов. |
● Абдоминальные боли: Локализуется в эпигастральной, околопупочной областях, иногда разлитая; Постоянная, интенсивная, имеет ночной «голодный» характер, уменьшается при приеме пищи. ● Диспепсический синдром: кислая отрыжка, отрыжка воздухом, изжога, склонность к запору. ● Астенический синдром: вегетативная нестабильность, быстрая утомляемость, раздражительность. |
Объективный осмотр |
Наличие болей в правом подреберье или в эпигастральной области при пальпации, положительные желчепузырные симптомы (с-м Кера, с-м Мерфи, с-м Ортнера-Грекова, с-м Георгиевского-Мюсси). |
Наличие болей в эпигастральной или околопупочной области при пальпации. |
Осмотр полости рта, наблюдение за пациентом после приема пищи. |
Наличие болей в эпигастральной или околопупочной области при пальпации. |
Диагностика |
Диагноз ставится при наличии болей в правом подреберье или в эпигастральной области + 8 диагностических критериев: 1) Эпизоды длительностью 30 мин. и более; 2) Различные интервалы рецедивов; 3) Боли постоянного уровня; 4) Боли меняют образ жизни и «приводят» в больницу; 5) Боли не ↓ после дефекации; 6) Боли не ↓ после приема антацидов; 7) Боли не ↓ после изменения положения тела; 8) Исключена другая нозология с такой симптоматикой. |
Диагноз клинический: Первая линия: ОАК, ОАМ, УЗИ брюшной полости; Вторая линия: БАК (СРБ, Fe), анализ кала на скрытую кровь, на цисты лямблий, УЗИ орагнов малого таза у девочек, лактулозный дыхательный тест, ФЭГДС у мальчиков подростков при наличии в анамнезе ЯБ, ночных болях и неэффективности терапии в течении 2 недель, при наличии симптомов тревоги. |
УЗИ верхнего отдела ЖКТ, ФЭГДС, рентгенография, pH-метрия, манометрия пищевода. |
Диагноз морфологический: ОАК, ОАМ, УЗИ брюшной полости, ФЭГДС, определение секреторной активности, pH-метрия. Диагностика H. Pylori: Гистология при биопсии; Быстрый уреазный тест; Серологический метод; Анализ кала на антиген Hp; 13С-уреазный дыхательный тест. |
Принципы терапии |
1) Диетотерапия; 2) Медикаментозная терапия: а) препараты для коррекции невротических и вегетативных расстройств, б) желчегонная терапия; 3) Фитотерапия; 4) Бальнеотерапия; 5) Тюбажи по Демьянову; 6) Физиотерапия; 7) Санаторно-курортное лечение. |
1) Нормализация образа жизни, характера питания; 2) Применение ЛС, мб психотерапия; 3) Диетотерапия; 4) Эрадикация H. Pylori при + пробе; 5) Применение прокинетиков, спазмолитиков, ИПП, антацидов; 6) Питье минеральных вод; 7) Госпитализация при симптомах тревоги. |
1) Диетотерапия; 2) Постуральная терапия; 3) Медикаментозная терапия; 4) Хирургическая коррекция. |
1) Эрадикационная терапия; 2) Восстановление СО желудка; 3) Нормализация функций клеток СО желудка; 4) Ликвидация нарушений моторики и пищеварения; 5) Предупреждение прогрессирования заб-я; 6) Лечение сопутствующих осложнения. |
25. Острый гломерулонефрит: классификация. Клинические признаки нефритического и нефротического синдрома.
Острый гломерулонефрит (ОГН) — воспалительное заболевание почек с преимущественным поражением клубочков (гломерул). Основные патогенетические механизмы связаны с иммунокомплексным или аутоиммунным повреждением клубочков.
Клиническое течение острого гломерулонефрита:
- Заболевание часто начинается через 1-3 недели после инфекции, особенно стрептококковой (ангина, фарингит);
- Основные жалобы: отёки, снижение количества мочи, "мясные помои" в моче;
- При нефротическом синдроме пациенты могут также жаловаться на слабость, одышку, боли в животе и грудной клетке из-за отёков.
Классификация острого гломерулонефрита:
1. По этиологии:
- Инфекционный (винится острая инфекция, например, стрептококковая);
- Аутоиммунный (например, системная красная волчанка);
- Постинфекционный (например, после стрептококковой инфекции);
- Паранеопластический (ассоциируется с новообразованиями).
2. По морфологическим изменениям:
- Пролиферативный (увеличение числа клеток в клубочках);
- Мезангиопролиферативный;
- Эндокапиллярный;
- Полулунный (экссудативный или некротический, с формированием полулуний).
3. По патогенезу:
- Иммунокомплексный (чаще постстрептококковый);
- Антителозависимый (например, при болезни Гудпасчера);
- Антиген-независимый (например, при васкулитах).
4. По клиническому течению:
- Латентный (малосимптомный);
- Циклический (с ярко выраженными симптомами). Клинические признаки нефритического синдрома:
1. Нефритический синдром (характерен для большинства острых ГН):
- Отёки (чаще лица, появляются утром).
- Артериальная гипертензия (за счёт задержки жидкости и натрия).
- Гематурия (макро- или микрогематурия, моча цвета "мясных помоев").
- Олигурия (уменьшение объёма выделяемой мочи).
- Протеинурия (умеренная, до 3,5 г/сут).
- Задержка натрия и воды в организме.
Клинические признаки нефротического синдрома:
2. Нефротический синдром (чаще наблюдается при подостром или хрон. ГН):
- Протеинурия (выраженная, более 3,5 г/сут).
- Гипоальбуминемия (снижение уровня белков в плазме).
- Гиперлипидемия (повышение уровня липидов в крови).
- Отёки (генерализованные, выраженные, могут быть асцит и гидроторакс).
- Моча пенистая из-за высокого содержания белка.
Основные отличия нефритического и нефротического синдромов:
Признак |
Нефритический синдром |
Нефротический синдром |
Гематурия |
Ярко выраженная (макро-/микрогематурия) |
Не характерна |
Протеинурия |
Умеренная (до 3,5 г/сут) |
Выраженная (>3,5 г/сут) |
Отеки |
Небольшие, локальные (лицо, веки) |
Генерализованные, массивные |
Гиперлипидемия |
Отсутствует |
Присутствует |
Гипоальбуминемия |
Отсутствует или слабая |
Выраженная |
Гипертензия |
Выраженная |
Отсутствует или слабая |
26. Хронический гломерулонефрит: его критерии и причины. Классификация, дифференциальная диагностика гематурической и смешанной формы, особенности клинической картины в зависимости от формы, дифференциальная диагностика, принципы лечения различных его форм, профилактика, диспансерное наблюдение.
Хронический гломерулонефрит (ХГН) — это прогрессирующее воспалительное заболевание почек с первичным поражением клубочков и постепенным развитием склероза почечной ткани, которое приводит к хронической почечной недостаточности (ХПН).
Критерии диагностики:
1. Длительность заболевания — более 12 месяцев;
2. Постоянная протеинурия (свыше 0,5 г/сут), возможно с гематурией;
3. Признаки хронической почечной недостаточности (ХПН):
- Снижение скорости клубочковой фильтрации (СКФ);
- Гиперазотемия (повышение уровня мочевины и креатинина);
4. Персистирующая артериальная гипертензия;
5. Отсутствие симптомов активного острого воспалительного процесса.
Причины:
Как у ОГН, но хроническое течение обуславливается постоянной выработкой аутоантител к антигенам базальной мембраны капилляров. Длительный воспалительный процесс, протекающий волнообразно (с периодами ремиссий и обострений), приводит, в конце концов, к склерозу, гиалинозу, «запустеванию» клубочков и развитию ХПН.
1. Иммунологические механизмы:
- Перенесённый острый гломерулонефрит;
- Аутоиммунные заболевания (системная красная волчанка, васкулиты).
2. Инфекционные причины:
- Хроническая стрептококковая инфекция;
- Гепатиты B и C;
- Инфекционный эндокардит.
3. Токсические воздействия:
- Отравления тяжёлыми металлами, лекарствами (НПВС, антибиотики).
4. Наследственные и метаболические нарушения:
- Болезнь Альпорта;
- Диабетический гломерулосклероз.
Классификация хронического гломерулонефрита
1. По клинико-морфологическим формам:
- Нефротическая форма: выраженная протеинурия, отёки, гипоальбуминемия;
- Гематурическая форма: преимущественно гематурия;
- Гипертоническая форма: артериальная гипертензия, умеренная протеинурия;
- Смешанная форма: сочетание нефротического синдрома, гематурии и гипертензии;
- Латентная форма: малосимптомное течение.
2. По стадиям хронической почечной недостаточности:
- I стадия: начальная (СКФ >60 мл/мин);
- II стадия: компенсированная (СКФ 30–59 мл/мин);
- III стадия: декомпенсированная (СКФ <30 мл/мин).
Дифференциальная диагностика гематурической и смешанной формы:
- Гематурический ХГН – проявляется постоянной гематурией, иногда с эпизодами макрогематурии, течение благоприятное;
- Смешанный ХГН – нефротический синдром в сочетании с АГ и/или гематурией и/или азотемией (отеков меньше, но они упорнее).
Особенности клинической картины в зависимости от формы:
1. Гематурическая форма:
- Основной симптом — стойкая гематурия;
- Протеинурия минимальная;
- Диагноз подтверждается при исключении других причин гематурии.
2. Нефротическая форма:
- Протеинурия >3,5 г/сут;
- Гипоальбуминемия (<30 г/л), отёки, гиперлипидемия.
3. Гипертоническая форма:
- Стойкая артериальная гипертензия;
- Умеренная протеинурия (<1 г/сут).
4. Смешанная форма:
- Протеинурия, гематурия и гипертензия, азотемия одновременно.
5. Латентная форма:
- Умеренная протеинурия, минимальные симптомы.
Принципы лечения различных форм ХГН:
1. Общие подходы:
- Ограничение соли и жидкости;
- Белковая диета (0,8 г/кг массы тела/сут);
- Контроль артериального давления (<130/80 мм рт. ст.).
2. Лечение в зависимости от формы:
- Нефротическая форма: глюкокортикостероиды, цитостатики, антикоагулянты;
- Гипертоническая форма: ингибиторы АПФ, блокаторы кальциевых каналов;
- Гематурическая форма: симптоматическое лечение;
- Смешанная форма: комплексная терапия;
- Латентная форма: динамическое наблюдение.
3. Лечение ХПН:
- Диализ при снижении СКФ <15 мл/мин;
- Трансплантация почки при терминальной стадии.
Профилактика и диспансерное наблюдение
1. Профилактика:
- Ранняя диагностика и лечение острых гломерулонефритов;
- Предупреждение инфекционных заболеваний;
- Исключение токсических воздействий.
2. Диспансерное наблюдение:
- Ежеквартальное обследование (анализы мочи, крови, креатинин, мочевина);
- Мониторинг артериального давления;
- Контроль УЗИ почек раз в год.
27. Острый пиелонефрит: этиология, патогенез, особенности клинической картины у детей различного возраста. Диагностика.
!Отличие пиелонефрита от гломерулонефрита: при пиелонефрите наблюдается чередование интактных зон и участков, изменённых воспалительным процессом с различной степенью поражения почек. При гломерулонефрите же наблюдается диффузное пролиферативное, эндокапиллярное поражение паренхимы обеих почек.
Острый пиелонефрит (ОП) — это инфекционно-воспалительное заболевание, поражающее почечную паренхиму и чашечно-лоханочную систему. Основными возбудителями являются бактерии, реже вирусы и грибы.
Этиология:
Основные бактериальные возбудители:
1. Escherichia coli (до 80% случаев).
2. Klebsiella spp.
3. Proteus spp.
4. Enterococcus spp.
5. Pseudomonas aeruginosa.
6. Staphylococcus spp.
Факторы, способствующие развитию: 1. Возрастные особенности:
- У новорождённых и младенцев часто встречаются врождённые аномалии мочевыводящих путей.
2. Функциональные нарушения:
- Везикоуретеральный рефлюкс (ВУР);
- Нарушение пассажа мочи (обструкция).
3. Сопутствующие заболевания:
- Сахарный диабет;
- Иммунодефицитные состояния.
4. Нарушения гигиены:
- Более частый риск у девочек из-за короткой уретры.
Патогенез
1. Пути инфицирования:
- Восходящий путь: проникновение бактерий из уретры и мочевого пузыря (чаще у девочек).
- Гематогенный путь: распространение инфекции через кровь (чаще у новорождённых).
- Лимфогенный путь: переход инфекции из близлежащих органов.
2. Механизмы развития:
- Бактерии прикрепляются к эпителию мочевыводящих путей, размножаются и вызывают воспаление.
- Воспалительный процесс может затрагивать:
а) паренхиму почки (интерстициальное воспаление);
б) чашечно-лоханочную систему (пиелит).
- Нарушение оттока мочи усиливает воспаление, способствует склерозу почечной ткани.
Особенности клинической картины у детей различного возраста:
1. Новорождённые и дети раннего возраста (до 2 лет):
Симптомы неспецифичны:
- Повышение температуры тела (лихорадка);
- Тревожность, плач;
- Снижение аппетита;
- Рвота, диарея;
- Гипотрофия, задержка прибавки массы тела.
- Зачастую отсутствуют локальные симптомы со стороны почек.
2. Дошкольники (2–7 лет):
Симптомы более выражены:
- Лихорадка (до 39–40°C);
- Боли в животе или пояснице (с одной или обеих сторон);
- Дизурические расстройства (частое, болезненное мочеиспускание);
- Мутная моча с неприятным запахом.
3. Школьники и подростки (7–18 лет):
Клиническая картина схожа со взрослыми:
- Высокая температура тела;
- Боли в пояснице (чаще односторонние);
- Симптомы интоксикации: слабость, головная боль.
- Возможна макрогематурия (моча с примесью крови).
Диагностика:
1. Анамнез и физикальное обследование:
- Жалобы на лихорадку, боли в пояснице или животе, дизурию.
- У детей раннего возраста — симптомы интоксикации без явной причины.
- Симптом поколачивания в поясничной области (симптом Пастернацкого).
2. Лабораторные методы:
- Общий анализ мочи:
- Лейкоцитурия (>10 лейкоцитов в поле зрения);
- Бактериурия;
- Микрогематурия.
- Посев мочи на микрофлору:
- Выявление возбудителя;
- Определение чувствительности к антибиотикам.
- Общий анализ крови:
- Лейкоцитоз, нейтрофильный сдвиг влево;
- Увеличение СОЭ.
3. Инструментальные исследования:
- УЗИ почек и мочевыводящих путей:
- Оценка размеров почек, наличия структурных аномалий (гидронефроз, камни, обструкция).
- Микционная цистоуретрография (при подозрении на ВУР).
- Радиоизотопное исследование почек:
- Для оценки функции почек при повторных эпизодах.
4. Дополнительные методы:
- КТ или МРТ:
- При осложнённых формах (абсцессы, некротический пиелонефрит).
- Иммунологические исследования:
- Оценка состояния иммунной системы у часто болеющих детей.
!Острый пиелонефрит у детей требует своевременной диагностики и лечения. У младенцев клинические проявления неспецифичны, что затрудняет раннюю диагностику. У детей старшего возраста симптомы более характерны, включая лихорадку, боли в пояснице и дизурические нарушения. Лабораторные и инструментальные исследования (анализ мочи, УЗИ, посев мочи) являются ключевыми для подтверждения диагноза.
28. Хронический пиелонефрит: критерии, предрасполагающие факторы, клинические формы и основные клинические синдромы, клинические, лабораторные и инструментальные методы диагностики, принципы лечения.
Хронический пиелонефрит (ХП) — повреждение почек, проявляющееся фиброзом и деформацией чашечно-лоханочной системы, в результате повторных атак инфекций моче-половых путей (МПП). Как правило, возникает на фоне анатомических аномалий мочевыводящего тракта или обструкции.
Критерии:
1. Длительное течение заболевания (более 6 месяцев);
2. Перемежающееся течение с эпизодами обострения (острый пиелонефрит) и ремиссий;
3. Наличие стойких изменений в моче (лейкоцитурия, бактериурия);
4. Постепенное снижение функции почек (вплоть до хронической почечной недостаточности — ХПН);
5. Асимметрия поражения почек по данным УЗИ, сцинтиграфии или КТ.
Предрасполагающие факторы:
1. Обструкции мочевыводящих путей:
- Мочекаменная болезнь;
- Везикоуретеральный рефлюкс;
- Стриктуры мочеточников, гидронефроз.
2. Инфекции мочевыводящих путей (частые циститы, уретриты);
3. Системные заболевания (сахарный диабет, иммунодефициты, гипертоническая болезнь);
4. Беременность (давление увеличенной матки на мочеточники);
5. Нарушение крово- и лимфообращения почек (артериальная гипотензия, атеросклероз);
6. Генетические и анатомические особенности (аномалии развития мочевой системы).
Клинические формы:
1. Латентная форма:
- Бессимптомное течение;
- Обнаруживается случайно по данным анализов мочи (лейкоцитурия, бактериурия).
2. Гипертоническая форма:
- Преобладание артериальной гипертензии (стойкой и плохо поддающейся коррекции);
- Возможна умеренная протеинурия.
3. Анемическая форма:
- Преобладает гипохромная анемия;
- Лейкоцитурия выражена минимально.
4. Рецидивирующая форма:
- Частые обострения, сопровождающиеся лихорадкой, болями в пояснице, дизурическими расстройствами.
5. Терминальная форма:
- Развитие хронической почечной недостаточности (ХПН).
Клинические синдромы:
1. Интоксикационный синдром (↑t◦, слабость, утомляемость, ночная потливость);
2. Синдром дизурии (частое, болезненное мочеиспускание);
3. Болевой синдром (боли в пояснице, чаще односторонние);
4. Гипертонический синдром (артериальная гипертензия);
5. Синдром ХПН (полиурия, никтурия, гипоизостенурия).
Диагностика
1. Клинические методы:
- Жалобы на боли в пояснице, дизурию, лихорадку;
- История частых инфекций мочевыводящих путей;
- Симптом поколачивания в поясничной области.
2. Лабораторные исследования:
- Общий анализ мочи (лейкоцитурия >10 в поле зрения, бактериурия, микрогематурия);
- Анализ мочи по Нечипоренко (лейкоциты >2000/мл, эритроциты >1000/мл);
- Биохимический анализ крови (повышение креатинина и мочевины при ХПН);
- Посев мочи (определение возбудителя и его чувствительности к антибиотикам).
3. Инструментальные методы:
- УЗИ почек (неровность контуров почек, деформация чашечно-лоханочной системы);
- Рентгеноконтрастные исследования (замедление выделения контраста, асимметрия размеров почек);
- Радиоизотопная сцинтиграфия (оценка функции и перфузии почек);
- КТ или МРТ (выявление абсцессов, аномалий строения);
- Микционная цистоуретрография (для диагностики везикоуретеральногорефлюкса).
Принципы лечения
1. Этиотропная терапия:
- Антибиотики (фторхинолоны, амоксициллин/клавуланат, цефалоспорины 3-го поколения);
- Курс: 10–14 дней при обострении, до 6 недель при тяжелом течении.
2. Патогенетическая терапия:
- Противовоспалительные препараты (НПВС для снятия воспаления);
- Антиоксиданты (витамин E, препараты селеном);
- Иммуномодуляторы (тималин, полиоксидоний).
3. Симптоматическая терапия:
- Лечение гипертензии: ингибиторы АПФ, блокаторы рецепторов ангиотензина II (БРА);
- Купирование анемии: препараты железа, эритропоэтины.
4. Лечение ХПН:
- Диализ на терминальной стадии, трансплантация почки.
5. Общие меры:
- Диета: ограничение соли, жидкости при гипертензии и отёках;
- Соблюдение питьевого режима (до 2 л жидкости при отсутствии противопоказаний);
- Исключение переохлаждений и инфекций.
Профилактика и диспансерное наблюдение
1. Профилактика:
- Лечение обструктивных процессов (мочекаменная болезнь, стриктуры);
- Предотвращение инфекций мочевых путей;
- Регулярное обследование у нефролога.
2. Диспансерное наблюдение:
- Контроль анализов мочи 1 раз в 3–6 месяцев;
- Ежегодное УЗИ почек;
- Постоянный мониторинг артериального давления.
29. Болезнь и синдром Иценко-Кушинга. Определение. Этиология. Клиническая картина. Осложнения. Диагностика. Дифференциальный диагноз. Лечение.
Болезнь Иценко-Кушинга (БИК) – это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией АКТГ опухолью гипофиза. Увеличение секреции АКТГ приводит, в свою очередь, к хронической повышенной выработке кортизола корой надпочечников и развитию симптомокомплекса эндогенного гиперкортицизма.
Синдром Иценко-Кушинга – в русскоязычной литературе термин используется для обозначения опухоли надпочечника, секретирующей кортизол; в англоязычной литературе объединяет весь симптомокомплекс гиперкортицизма.
Этиология и патогенез:
Болезнь Иценко-Кушинга является наиболее частой причиной (80-85%) органической гиперпродукции кортизола – эндогенного гиперкортицизма (ЭГ). В 10-20% случаев ЭГ развивается из-за первичной патологии надпочечников, а в 5-10% случаев – АКТГ продуцирует карциноидная опухоль любой внегипофизарной локализации.
Причиной БИК является АКТГ-секретирующая аденома гипофиза (кортикотропинома), почти всегда доброкачественного характера. Соотношение микро- и макроаденом составляет 4:1.
Патогенез развития БИК до конца не изучен. Имеется две теории развития болезни Иценко-Кушинга:
● «Гипофизарная» теория: мутация кортикотрофов, приводящая к образованию АКТГ-секретирующей аденомы гипофиза, что подтверждается моноклональным строением опухоли;
● «Гипоталамическая» теория: гиперсекреция КРГ (кортикотропин-рилизинггормона, кортиколиберина) с формированием вторичной опухоли или развитием гиперплазии гипофиза.
В обоих случаях происходит нарушение циркадного ритма секреции АКТГ, которое выражается в повышении амплитуды и длительности пиков секреции гормона. Гиперпродукция АКТГ не подавляется высокими значениями глюкокортикоидов в периферической крови, что в результате усиленной стимуляции надпочечников вызывает диффузную гиперплазию их коры и повышение содержания кортизола в крови и других биологических жидкостях. Именно гиперкортизолемия и определяет клиническую картину заболевания.
При естественном течении БИК (без лечения) 5-летняя выживаемость составляет 50%, но значительно улучшается даже при паллиативном лечении – двухсторонней адреналэктомии – до 86%. При своевременной диагностике и лечении в высокоспециализированном центре ремиссии удаётся добиться в 80% случаев, и смертность у пациентов в ремиссии не отличается от популяционной.
Клиническая картина:
Клиническая картина болезни Иценко-Кушинга определяется проявлениями гиперкортицизма, поэтому на первом этапе дифференцировать этиологию эндогенного гиперкортицизма затруднительно.
Клинические симптомы эндогенного гиперкортицизма достаточно разнообразны и неспецифичны.
Из наиболее типичных для болезни Иценко-Кушинга симптомов, которые могут позволить заподозрить наличие гиперкортицизма при первичном посещении эндокринолога, можно выделить центральное ожирение (с отложением жировой клетчатки на туловище – животе, груди, спине с формированием т.н. «надключичных подушечек» и «климактерического горбика» в проекции VII шейного позвонка, часто на лице – «лунообразное» лицо) с одновременным уменьшением верхних и нижних конечностей в обхвате из-за атрофии мышечной и жировой ткани, «матронизм» (яркий румянец цианотического оттенка в совокупности с округлившимися чертами лица), скошенные ягодицы (вследствие атрофии мышц), широкие (часто более 1 см) багровофиолетовые стрии на животе, внутренней поверхности бедер и плеч, у женщин – на молочных железах, множественные подкожные кровоизлияния, возникающие даже при незначительных травмах.
Осложнения и их коррекция:
► Нарушение липидного обмена (гиперхолестеринемия, гипертриглицеридемия) – статины, фибраты; ► Артериальная гипертензия – комбинированная гипотензивная терапия, возможно, применение α1-адреноблокаторов при резистентной гипертензии; ► Нарушение углеводного обмена – гипогликемические препараты, в том числе инсулинотерапия, согласно рекомендациям по лечению сахарного диабета; ► Гипокалиемия – коррекция проводится спиронолактоном, препаратами калия внутрь и внутривенно капельно; ► Низкотравматические переломы на фоне стероидного остеопороза – витамин Д.
Диагностика:
Жалобы и анамнез:
- Прибавка массы тела (важно не само значение массы тела, а динамика набора массы тела, отсутствие снижения массы тела на фоне соблюдения диеты, физических нагрузок, отложения жира в области лица, шеи, спины, живота); - Мышечная слабость (рано устает, плохо поднимается со стула, садится, играет); - Легкое возникновение кровоподтеков (даже от трения полотенцем после душа); - Отечность, появление стрий (распад белка в ПЖК и её расхождение, багровый цвет обусловлен просвечиванием сосудов); - Хронические воспалительные заболевания мягких тканей / органов (долго и часто болеющие дети: пиелонефриты, циститы, синуситы); - Оволосенение (раннее, на нехарактерных местах для ребенка и в большом количестве); - Эмоциональная лабильность (плаксивость, раздражительность и т.п.). ! Обязательно уточнение получаемой лекарственной терапии, наличие в перечне принимаемых препаратов глюкокортикоидов (для исключения возможности развития экзогенного гиперкортицизма).
Физикальное обследование:Выявление клинической картины – см.выше.
Лабораторная диагностика: ! Перед проведением любых лабораторных исследований необходимо исключить введение экзогенных глюкокортикоидов. В некоторых случаях пациенты не связывают изменение внешности с приемом ГК, и факт применения препаратов выявляется только при активном расспросе. Просим принести все ЛС, крема, мази, всё-всё чем пользуется ребенок, родители (ребенок может втихую что-то использовать родительское).

Основные методы визуализации надпочечников – КТ, МРТ и УЗИ. В первую очередь КТ или МРТ надпочечников показаны при лабораторно подтвержденной гиперпродукции кортикостероидов кортикостероидов или катехоламинов. Преимущество КТ – возможность определения злокачественного потенциала выявленного объемного образования при оценке нативной КТ-плотности. Если последняя превышает 20 ед. Хаунсфилда, вероятность злокачественного характера объемного образования высока. Значительную ценность в топической диагностике феохромоцитомы представляет сцинтиграфия.
Дифференциальный диагноз:
- Дифференциальная диагностика болезни Иценко-Кушинга и АКТГ-эктопированного синдрома (эндогенный гиперкортицизм при АКТГ-эктопированном синдроме может быть при медуллярном рак щитовидной железы, раке клеток островков Лангерганса, хромаффиноме, раке яичников, яичек, предстательной железы; карциноиде легких, бронхов, тимуса, аппендикса, опухоли желудочно-кишечного тракта, мочевого пузыря, околоушных и слюнных желез и т.д);
- Болезнь Иценко-Кушинга (опухоль гипофиза) необходимо дифференцировать с синдромом Иценко-Кушинга (опухоль надпочечников).
- Эндогенный гиперкортицизм следует отличать от экзогенного, который обусловлен приемом глюкокортикоидов в супрафизиологических дозах (уже упоминалось выше).
Лечение:
Цели лечения:
1) Контроль гиперсекреции глюкокортикоидов;
2) Удаление / разрушение опухолевой ткани с сохранением функций гипофиза (как осложнение может быть ожирение по гипоталамическому типу (читай выше));
3) Восстановление нормальной функции гипоталамус-гипофиз-надпочечниковой оси;
4) Исчезновение клинических проявлений хронического избытка глюкокортикоидов.
Виды лечечния:
Болезни Иценко-Кушинга:
1) Хирургический способ (транссфеноидальный доступ);
2) Радиотерапия (стереотаксическая радиохирургия);
3) Медикаментозная терапия (каберголин, пасиреотид).
Синдрома Иценко-Кушинга:
1) Хирургический способ (двусторонняя адреналэктомия);
2) Медикаментозная терапия – ингибиторы стероидогенеза (метирапон, кетоконазол), адренолитики (лизодрен), антагонисты рецепторов глюкокортикоидов (мифепристон).
30. Врождённая дисфункция коры надпочечников (адреногенитальный синдром). Классификация. Клиника вирильной и сольтеряющей форм. Дифференциальный диагноз. Неонатальный скрининг. Лечение и профилактика.
Врожденная дисфункция коры надпочечников (ВДКН) (адреногенитальный синдром, врожденная надпочечниковая гиперплазия) — группа заболеваний с аутосомно-рецессивным типом наследования, в основе которых лежит дефект одного из ферментов или транспортных белков, принимающих участие в биосинтезе кортизола в коре надпочечников. На сегодняшний день известно 7 форм врожденной дисфункции коры надпочечников (ВДКН): 7 форм по названию дефекта конкретного фермента.
Самой частой формой ВДКН, на которую приходится более 90% больных, является дефицит 21-гидроксилазы. Распространенность дефицита 21-гидроксилазы в мире, рассчитанная по данным неонатального скрининга, составляет 1 случай на 14 000 живых новорожденных. В России, по данным скрининга, распространенность составляет 1:9500. Поскольку заболевание наследуется по аутосомно-рецессивному типу, существуют популяции, где оно встречается чаще, например некоторые этнические группы на Северном Кавказе, где распространены близкородственные браки.
Классификация (НПС):
► Неклассическая форма.
- Классические формы:
► Простая вирильная форма (Вирильный синдром – появление мужских вторичных половых признаков у женщин);
► Сольтеряющая форма.
Патогенез:
При всех формах ВДКН отмечается дефицит кортизола, что по механизму отрицательной обратной связи приводит к повышению уровня АКТГ и гиперплазии надпочечников. В результате стимуляции надпочечников происходит избыточное накопление стероидов, предшествующих ферментативному блоку. Клиническая картина каждой формы ВДКН обусловлена дефицитом гормонов, синтез которых невозможен при данном ферментативном блоке, и избытком предшественников.
Характерный для всех форм ВДКН дефицит кортизола проявляется склонностью к гипогликемическому синдрому, особенно в стрессовых ситуациях и у грудных детей. Специфическим симптомом дефицита кортизола является гиперпигментация кожи вследствие высокого уровня проопиомеланокортина и его производных. В крови определяется повышенный уровень АКТГ.
Клиника вирильной и сольтеряющей форм:
При сольтеряющей форме ВДКН отмечается дефицит минералокортикоидов. Недостаток альдостерона вызывает снижение реабсорбции натрия в почках, вследствие чего снижаются ОЦК и АД. У детей отмечаются неукротимая рвота, жидкий стул, боли в животе, резкое падение АД. Наблюдаются гиперкалиемия, гипонатриемия и повышение активности ренина плазмы.
При вирильной форме ВДКН отмечается только дефицит кортизола, что при отсутствии лечения проявляется мышечной слабостью, утомляемостью, потемнением кожных покровов на фоне симптомов гиперандрогении (гирсутизм — усиленный рост волос по мужскому типу, сбои менструального цикла, проявляющиеся в виде олигоменории либо аменореи, маскулинизация (сужение бедер, снижение тембра голоса), угревая сыпь, себорея, очень жирная кожа, увеличение клитора, уменьшение молочных желез, черный акантоз, появление мягких фибром).
Дифференциальный диагноз:
Диагностика неклассической формы ВДКН является более частой задачей и рутинно встречается в практике эндокринологов и акушеров-гинекологов, так как по клиническим проявлениям это заболевание схоже с синдромом поликистозных яичников. Именно с этим заболеванием и проводится чаще всего дифференциальная диагностика нВДКН.
Неонатальный скрининг:
В России неонатальный скрининг существует с середины 2006 г., в результате чего частота встречаемости данного заболевания выросла более чем в 2 раза. Кроме того, сократились срок постановки диагноза и степень гипонатриемии, что, по данным литературы, улучшает в дальнейшем способности детей к обучению. Процедура скрининга включает в себя забор крови у доношенных новорожденных на 2-3-ие сутки жизни, у недоношенных на 7—10-е сутки с дальнейшим определением 17-ОН-прогестерона (17ОНР) – это стероид, продуцируемый в надпочечниках, половых железах и плаценте. При положительном результате скрининга сведения передаются в поликлинику по месту жительства ребенка, после чего проводится повторный забор крови для ретестирования.
! При существующем в России порядке скрининга его положительная предсказательная ценность составляет от 1 до 5%, т. е. среди всех положительных результатов только от 1 до 5 детей из 100 положительных образцов действительно имеют ВДКН, в остальных случаях это ложноположительные результаты.
Лечение:
Препаратом выбора для лечения детей с ВДКН является таблетированный гидрокортизон.
Применение сиропа гидрокортизона и пролонгированных форм глюкокортикоидов у детей в период активного роста не показано.
Всем детям с сольтеряющей формой ВДКН показано назначение флудрокортизона, детям грудного возраста показано дополнительное введение в пищевой рацион поваренной соли.
Основой терапии при всех формах ВДКН является назначение глюкокортикоидов, которые позволяют заместить дефицит кортизола и тем самым подавить избыточную секрецию АКТГ.
Профилактика:
Пренатальная диагностика не является обязательной, проводится только по желанию родителей в семьях, имеющих больного ребенка, и только при условии, что родители будут прерывать беременность больным плодом. Диагностика проводится на 9—10-й неделях гестации путем получения ДНК из ворсин хориона и определения наличия мутаций гена, ответственного за развитие данной формы ВДКН.
Возможно проведение пренатальной терапии – экспериментальная разработка.
31. Хроническая недостаточность коры надпочечников. Этиология. Патогенез, клиническая картина, дифференциальный диагноз. Неотложная помощь. Лечение. Прогноз.
Хроническая надпочечниковая недостаточность (ХНН) — синдром, обусловленный хроническим дефицитом синтеза и секреции кортизола в коре надпочечников.
В зависимости от уровня поражения в системе гипоталамус-гипофиз-надпочечники, НН бывает первичной, которая обусловлена патологией самих надпочечников, и центральной — вторичной (связанной со сниженной секрецией адренокортикотропного гомона гипофиза — АКТГ) или третичной (связанной с нарушением секреции кортикотропин-рилизинг-гормона в гипоталамусе (КРГ).
Будем говорить дальше о первичной (ПХНН) – патологии в самих надпочечниках.
Этиология и патогенез:
В большинстве случаев (но не во всех) дефицит глюкокортикоидов (кортизола) сочетается с дефицитом минералокортикоидов (альдостерона). При отсутствии заместительной терапии надпочечниковая недостаточность является смертельно опасным заболеванием. Пациент, страдающий хронической первичной надпочечниковой недостаточностью (ПНН), нуждается в постоянной заместительной терапии глюкокортикоидами (и, в большинстве случаев, минералокорикоидами).
ПХНН — этиологически гетерогенное заболевание. Поражение надпочечников может развиваться в результате воздействия внешних факторов — кровоизлияние (чаще у детей до 1 года), инфекционное (туберкулез), опухолевое (лимфома, метастазы), адреналэктомия (при опухолях надпочечников, болезни Кушинга).
У детей чаще причиной ПХНН является одно из наследственных заболеваний, сопровождающихся нарушением эмбриогенеза, деструкцией надпочечников или дефектами стероидогенеза.
Клиническая картина:
Недостаточность глюкокортикоидов (кортизола) проявляется слабостью, быстрой утомляемостью, снижением аппетита и потерей веса, обмороками, судорогами с потерей сознания. Судорожный синдром обусловлен низким уровнем глюкозы в крови (гипогликекмией), чаще развивается после длительного ночного перерыва в приемах пищи.
Недостаточность минералокортикоидов (альдостерона) проявляется тошнотой, повышенной потребности в соли, рвотой, повторной и не приносящей облегчения, приводящей к обезвоживанию, что принято называть «сольтеряющими кризами». Симптомы обычно резко усиливаются на фоне других заболеваний, высокой температуры, стрессовых ситуаций.
Почти все симптомы дефицита кортизола и альдостерона являются неспецифичными, то есть могут быть признаком заболеваний других органов и систем (желудочно-кишечного тракта, центральной нервной системы и д.р.).
Наиболее специфическими проявлениями первичной надпочечниковой недостаточности являются гиперпигментации кожи и /или слизистых и повышенная потребность в соли. Часто окружающие впервые замечают гиперпигментацию на открытых участках тела (лицо, кисти рук). Максимальные проявления гиперпигментации отмечаются на коже наружных половых органов, подмышечных областей, коленей, локтей, а также пигментируются соски, пупок, перианальная область и рубцы на месте повреждения кожи. Участки гиперпигментации могут быть на слизистых оболочках полости рта.
Дифференциальная диагностика:
Для того, что определить нозологическую форму ХНН, необходимо оценить:
1. Возраст манифестации надпочечниковой недостаточности;
2. Наличие глюкокортикоидного и минералокортикоидного компонентов;
3. Семейный анамнез;
4. Наличие других клинических компонентов.
При отсутствии дополнительных клинических компонентов, которые позволяют предположить этиологию ХНН, необходимо:
1. Всем мальчикам с дебютом ХНН в возрасте после трех лет провести исследование ОДЦЖК (очень длинноцепочечных жирных кислот) для исключения Х-сцепленной адренолейкодистрофии;
2. Пациентам обоего пола с дебютом заболевания в возрасте после трех лет провести исследование антител к 21-гидроксилазе;
3. Провести генетические исследования для выявления мутаций в известных генах, ответственных за развитие надпочечниковой недостаточности.
Неотложная помощь:
— увеличивать дозу кортефа (ГКС для перорального применения) в 2—3 раза в стрессовой ситуации, при инфекционных заболеваниях с температурой выше 38 °С;
— иметь в домашней и походной аптечке набор экстреной помощи гидрокортизон для внутримышечно (или внутривенно) введения. Уметь пациенту или сопровождающему лицу в случае необходимости (резкое ухудшение состояния, рвота, потеря сознания, судороги) самостоятельно сделать внутримышечноинъекцию до приезда медицинской помощи.
Всем пациентам с НН рекомендуется ношение браслета с указанием имени, необходимости постоянной терапии глюко- и минералокортикоидов и рекомендаций по оказанию экстренной медицинской помощи, телефона доверенного лица.
Лечение:
Цели лечения:
1. Подобрать режим и дозы препаратов глюкокортикоидов так, чтобы они максимально соответствовали физиологическому и циркадному ритму кортизола;
2. Избежать развития адреналового криза;
3. Избежать хронической передозировки и ее отдаленных нежелательных эффектов (остеопороз, повышение кардиоваскулярных рисков, метаболический синдром);
4. Улучшить качество жизни пациента, обеспечив его психосоциальную адаптацию.
Прогноз:
При своевременной диагностике и достижении целей лечения – благоприятный.
32. Тиреоидные гормоны: их физиологическая роль в различные периоды онтогенеза. Симптомы гипо – и гипертиреоза у детей.
В период внутриутробного развития тиреоидные гормоны способствуют дифференцировке тканей нервной, сердечно-сосудистой, опорно-двигательной и других систем, в период детства — становлению психики. Гормоны, повышая чувствительность адренорецепторов к адреналину и норадреналину, увеличивают частоту сердечных сокращений, артериальное давление; повышают потребление кислорода и уровень основного обмена; активируют синтез белков, в том числе ферментов, процессы гликогенолиза, липолиза; увеличивают захват ионов кальция из крови; способствуют транспорту глюкозы и аминокислот в клетку; увеличивают теплопродукцию. Тиреоидные гормоны синергично действуют с соматотропным гормоном.
Можно выделить 3 периода влияния ЩЖ:
- 10-12 недели ВУР – влияние материнских гормонов ЩЖ на плод; - С 10-12 недели до рождения – материнские и собственные гормоны ЩЖ плода; - Постнатальный период – максимальное влияние ЩЖ на нервную систему; - До 2 лет является одним из главных гормонов роста вплоть до 21-22 лет.


Симптомы гипо – и гипертиреоза у детей:



NB! Нарушения умственного и физического развития, вызванные нехваткой йода во внутриутробном периоде и в раннем детском возрасте, являются необратимыми.
Гипертиреоз:
Родители обращают внимание на повышенную раздражительность ребенка, плаксивость, нарушение сна, быструю утомляемость, потливость, похудание, несмотря на хороший аппетит. Дети нередко жалуются на жару, сердцебиение, одышку, боли в области сердца.
33. Йоддефицитные заболевания у детей— медицинское и социальное значение. Методы профилактики.
Йоддефицитные заболевания (ЙДЗ) – термин, объединяющий состояния и нарушения, вызванные йодным дефицитом (ВОЗ, 2007г.). Ростовская область йододефицитный район из-за аварии на ЧАЭС 1986 года.
Йоддефицитные заболевания объединяют не только патологию щитовидной железы, резвившуюся вследствие дефицита йода, но и патологические состояния, обусловленные дефицитом тиреоидных гормонов. Спектр йоддефицитных заболеваний представлен в таблице ниже:

Основными природными источниками йода для человека являются продукты растительного и животного происхождения, питьевая вода, воздух.
Суточная потребность в данном элементе составляет:
• 90 мкг — для детей до 5 лет;
• 120 мкг — для детей с 5 до 12 лет;
• 150 мкг — для детей с 12 лет и взрослых;
• 250 мкг — для беременных и кормящих женщин.
Недостаток йода в почве приводит к снижению содержания этого микроэлемента в продуктах питания, производимых в этой местности, а потребляющие их люди страдают от йоддефицита.
Дефицит йода обладает многочисленными негативными последствиями в отношении развития и формирования организма человека. Известно, что наибольшую опасность представляет недостаточное поступление йода в организм на этапе внутриутробного развития и в раннем детском возрасте. Изменения, вызванные ЙД в эти периоды жизни, проявляются необратимыми дефектами в интеллектуальном и физическом развитии детей. Однако весь спектр йоддефицитной патологии широк и простирается от репродуктивных нарушений до специфических заболеваний ЩЖ, включая функциональную автономию и йодиндуцированный тиреотоксикоз как одно из самых тяжелых проявлений ЙДЗ в регионах с различным уровнем дефицита йода в питании.
По данным ВОЗ, в условиях дефицита йода живут более 2 млрд человек, среди них почти у 700 млн человек выявлен эндемический зоб. В Российской Федерации не существует территорий, на которых население не подвергалось бы риску развития йододефицитных заболеваний. Считается, что район свободен от йодного дефицита, если средняя концентрация йода в моче у населения превышает 100 мкг/л у населения. Среднее потребление йода населением РФ намного ниже рекомендуемого, и составляет 40-80 мкг в сутки. В эндемичных районах частота зоба у детей допубертатного возраста превышает 5%. Распространенность диффузного эндемического зоба в различных регионах России варьирует от 5,2 до 70% и в среднем по стране составляет 31%.
Диффузный эутиреоидный зоб преимущественно встречается у детей, подростков и лиц молодого возраста. Более чем в 50% случаев он развивается до 20-летнего возраста, причем у женщин зоб развивается в 2–3 раза чаще, чем у мужчин. Как правило, риск развития диффузного эутиреоидного зоба многократно возрастает в те периоды, когда повышенная потребность в йоде (детский возраст, пубертатный период, беременность, кормление грудью) не восполняется адекватно.
Методы профилактики:
Массовая – йодирование продуктов питания, в первую очередь, поваренной соли, хлеба;
Групповая – прием йодсодержащих препаратов «группами риска» по развитию ЙДЗ;
Индивидуальная – профилактический прием дозированных препаратов, обеспечивающих физиологическую ежедневную потребность в йоде.
Кому рекомендовано принимать препараты йода?
Профилактика у детей и подростков, беременных, кормящих и женщин репродуктивного возраста – назначение врача необязательно;
Лечение у больных с эндемическим и узловым зобом – назначение врача обязательно.
34. Эндемический зоб у детей и подростков. Определение, распространенность в различных регионах РФ. Этиопатогенез, клиника, дифференциальный диагноз, лечение.
Эндемический зоб — диффузное увеличение щитовидной железы, встречающееся в популяции более чем у 5% детей младшего и среднего школьного возраста. Обусловлен дефицитом поступления в организм йода, у части населения, проживающего в определенном регионе. В России имеют зоб 2% детей до 1 года, 20-30% детей 7-10 лет, 30-50% подростков.
Дефицит йода у матери — самая частая причина гипотиреоза у новорожденных в районах, где встречается эндемический зоб, обусловленный недостатком йода в воде и пище. В областях с выраженным йодным дефицитом врожденный гипотиреоз может быть проявлением эндемического кретинизма. Развитие данной формы заболевания можно предотвратить, если профилактика йодом начата до наступления беременности, и невозможно — при начале профилактики после 2—3 месяцев гестации.
Распространенность диффузного эндемического зоба в различных регионах России варьирует от 5,2 до 70% и в среднем по стране составляет 31%. ДНЗ (диффузный нетоксический (эутиреоидный) зоб) преимущественно встречается у детей, подростков и лиц молодого возраста.

Этиология:
При эндемическом зобе генетическая предрасположенность может реализоваться только при наличии соответствующего внешнего фактора — дефицита йода в окружающей среде.
Основные причины развития диффузного нетоксического зоба:
- Зобогенные вещества в пище и питьевой воде (лекарственные средства, блокирующие функцию щитовидной железы (тиреостатики); «естественные» зобогены, находящиеся в продуктах питания и воде (наиболее изученными являются флавоноиды и тиоцианаты); зобогены преимущественно промышленного происхождения);
- Наследственные нарушения синтеза гормонов;
- Начальные проявления аутоиммунной патологии.
Патогенез:
Зоб – это следствие гипертрофии и гиперплазии клеток щитовидной железы из-за йододефицита и, как следствие, дефицита Т3/Т4 в организме.
Клиническая картина:
Местные симптомы:
Для заболевания характерно длительное скрытое течение. Клинические проявления развиваются на фоне значительного увеличения объема железы, которая начинает сдавливать окружающие органы. Человек испытывает чувство давления и распирания в области шеи, замечает деформацию ее контуров. При компрессии трахеи появляется одышка, затруднения при попытке сделать глубокий вдох. При эндемическом зобе возникает сухой кашель, осиплость голоса.
Оценка размеров щитовидной железы:
- Степень 0 — зоба нет.
- Степень I — зоб не виден, но пальпируется, при этом размеры его долей больше дистальной фаланги большого пальца руки обследуемого.
- Степень II — зоб пальпируется и виден на глаз.
Общие симптомы:
Жалобы на увеличение веса, отеки тела, мышечную слабость. Кожа становится сухой, волосы ломкими и тусклыми. Пациенты жалуются на повышенную утомляемость, дневную сонливость. Нарушение координации, может выявляться снижение интеллектуального коэффицианта (IQ) на 10-15 пунктов, задержка умственного и физического развития, трудности в усвоении школьной программы.
Дифференциальный диагноз:
Эндемический зоб необходимо отличать от других заболеваний, которые сопровождаются увеличением размеров и измененной гормональной активностью органа.
Дифференциальная диагностика проводится со спорадическим зобом, аутоиммунным тиреоидитом Хашимото, неопластическими процессами (аденомой или раком ЩЖ). Изредка болезнь дифференцируют с врожденными или генетическими дефектами образования и секреции тиреоидных гормонов.
Лечение:
При наличии диффузного увеличения щитовидной железы по данным пальпации в соответствии с классификацией ВОЗ (1994 г.) и (или) увеличения ее объема по отношению к площади поверхности тела, после исключения аутоимунного тиреоидита устанавливается диагноз «эндемический зоб I или II степени».
Назначается прием препаратов йода в суточной дозе 200 мкг (например, калия йодид 200 по 1 таблетке в день ~ йодомарин) курсом не менее 6 мес.
В случае, если через 6 мес отмечаются значительное уменьшение или нормализация размеров житовидной железы, рекомендуется продолжить прием препаратов йода в профилактической дозе (например, калия йодид 200 по 1/2—1 таблетке в день) с целью предотвращения рецидива зоба.
Если на фоне приема препаратов йода в течение 6 мес не произошло нормализации размеров щитовидной железы, показано применение тироксина (например L-тироксина).
Адекватная доза тироксина подбирается в соответствии с уровнем ТТГ. После нормализации размеров щитовидной железы поданным УЗИ, проводимого каждые 6 мес, рекомендуется переход на длительный прием профилактических доз йода.
35. Врожденный гипотиреоз. Группа риска. Клинические признаки в периоде новорожденности. Скрининг новорожденных. Критерии диагноза.
Врожденный гипотиреоз (ВГ) — одно из наиболее часто встречающихся врожденных заболеваний ЩЖ у детей, в основе которого лежит полная или частичная недостаточность тиреоидных гормонов, приводящая к задержке развития всех органов и систем. Частота ВГ колеблется от 1:3000-4000 новорожденных в Европе и Северной Америке до 1:6000-7000 новорожденных в Японии. У лиц негроидной расы заболевание встречается достаточно редко (примерно 1:30.000), а у латиноамериканцев, напротив, часто (1:2000). У девочек заболевание встречается в 2—2,5 раза чаще, чем у мальчиков.
 ВГ
представляет собой достаточно гетерогенную
по этиологии группу заболеваний,
обусловленных либо морфофункциональной
незрелостью гипоталамо-гипофизарной
системы или ЩЖ, либо их повреждением во
внутриутробном периоде.
ВГ
представляет собой достаточно гетерогенную
по этиологии группу заболеваний,
обусловленных либо морфофункциональной
незрелостью гипоталамо-гипофизарной
системы или ЩЖ, либо их повреждением во
внутриутробном периоде.
В подавляющем большинстве случаев (85-90%) имеет место первичный ВГ. Среди случаев первичного ВГ приблизительно 85% являются спорадическими, 15% — наследственными. Большинство спорадических случаев обусловлено дисгенезией (эмбриопатией) ЩЖ, причем случаи дистопии (эктопии) железы встречаются гораздо чаще, чем полное ее отсутствие (агенезия) или гипоплазия. Гораздо реже (5—10% случаев) встречаются вторичный или третичный ВГ, проявляющиеся изолированным дефицитом ТТГ или ГП.
В последние годы в связи с развитием методов молекулярно-генетического анализа взгляды на этиологию ВГ во многом изменились. На сегодняшний день идентифицирован ряд генов, мутации которых приводят к нарушениям закладки, миграции, дифференцировки ЩЖ; дефектам синтеза тиреоидных гормонов, нарушениям гипоталамогипофизарной оси
Особой формой ВГ является транзиторный гипотиреоз новорожденных. Эта форма заболевания чаще всего наблюдается в регионах, эндемичных по недостатку йода. Транзиторный гипотиреоз может возникнуть и в результате незрелости системы органификации йода, особенно у недоношенных, незрелых новорожденных. К развитию транзиторного гипотиреоза у новорожденного может приводить прием матерью во время беременности тиреостатических и других препаратов, нарушающих синтез тиреоидных гормонов ЩЖ плода. Описана трансплацентарная передача материнских антител, блокирующих антитела к рецептору ТТГ.
Транзиторный ВГ новорожденных — это состояние временной (преходящей) гипотироксинемии, сопровождающееся повышением уровня ТТГ в крови. Оно значительно увеличивает степень риска для новорожденных, что в дальнейшем (на поликлиническом этапе) требует пристального наблюдения для подтверждения или снятия диагноза. Транзиторное повышение уровня ТТГ в большинстве случаев связано с функциональной незрелостью гипоталамо-гипофизарной системы в постнатальном периоде. Данное состояние чаще всего встречается в следующих случаях:
Группы риска:
— дефицит или избыток йода у матери (риск развития транзиторного ВГ выше у недоношенных и маловесных новорожденных);
— дети, рожденные от матерей с аутоиммунными заболеваниями ЩЖ (возможная трансплацентарная передача антител, блокирующих рецептор к ТТГ);
— дети, матери которых получали во время беременности большие дозы антитиреоидных средств по поводу болезни Грейвса: у таких детей, как правило, при рождении имеется зоб, который имеет тенденцию к уменьшению по мере выведения лекарственных препаратов из крови ребенка;
— дети с внутриутробной (и постнатальной) гипотрофией, с внутриутробными вирусно-бактериальными инфекциями.
Клинические признаки в периоде новорожденности:
Давно замечено, что клинические проявления и течение ВГ существенно различаются у лиц разного возраста. Типичная клиническая картина ВГ у новорожденных и детей 1-го месяца жизни, когда крайне важно поставить диагноз, наблюдается всего в 10— 15% случаев.
ВГ у новорожденных проявляется следующими симптомами:
— Переношенная беременность (более 40 нед); — большая масса тела при рождении (более 3500 г);
— Отечное лицо, губы, веки, полуоткрытый рот с широким, «распластанным» языком;
— Локализованные отеки в виде плотных «подушечек» в надключичных ямках, тыльных поверхностях кистей, стоп;
— Признаки незрелости при доношенной по сроку беременности;
— Низкий, грубый голос при плаче, крике;
— Позднее отхождение мекония;
— Позднее отпадение пупочного канатика, плохая эпителизация пупочной ранки;
— Затянувшаяся желтуха.



Для диагностики ВГ у новорожденных педиатрами, неонатологами и эндокринологами используется шкала Апгар, помогающая выявить ВГ в ранние сроки:
При сумме баллов более 5 следует заподозрить ВГ.
Позднее, в возрасте 3—4 мес наблюдаются следующие симптомы:
 —
Сниженный аппетит, затруднения при
глотании;
—
Сниженный аппетит, затруднения при
глотании;
— Плохая прибавка в массе тела;
— Метеоризм, запоры;
— Сухость, бледность, шелушение кожных покровов;
— Гипотермия (холодные кисти, стопы);
— Ломкие, сухие, тусклые волосы;
— Мышечная гипотония.
Скрининг новорожденных:
В связи с достаточно высокой встречаемостью ВГ, незначительной выраженностью его проявлений в первые дни и недели жизни, а также серьезными последствиями поздней диагностики с середины 70-х годов XX века во многих развитых странах мира была постепенно внедрена государственная система неонатального скрининга на ВГ.
Скрининг позволяет поставить диагноз в первые дни жизни ребенка, до появления развернутой клинической картины заболевания, и избежать таким образом тяжелых последствий болезни, в первую очередь задержки умственного и физического развития ребенка.
Основная цель скрининга на ВГ — как можно раньше выявить всех новорожденных с повышенным уровнем ТТГ в крови.
Отобранные дети с аномально высоким уровнем ТТГ требуют в дальнейшем углубленного обследования с целью правильной диагностики заболевания. Обследование и дальнейшее наблюдение детей осуществляется в три этапа:
— I этап: родильный дом (у всех доношенных новорожденных на 4—5- й день жизни (у недоношенных детей на 7—14- й день жизни) берется кровь (чаще из пятки) и в виде капель (6—8) наносится на специальную пористую фильтровальную бумагу. Все образцы крови отсылаются в специализированную медико-генетическую лабораторию);
— II этап: медико-генетическая лаборатория (в лаборатории проводится определение уровня ТТГ в сухих пятнах крови. Все образцы с уровнем ТТГ более 9 мкЕд/мл должны быть проверены повторно, уровень ТТГ более 40 мкЕд/мл позволяет заподозрить ВГ, а уровень выше 100 мкЕд/мл с высокой степенью вероятности указывает на наличие заболевания);
— III этап: детская поликлиника (ведется динамическое наблюдение).
Критерии диагноза:
+ Гормональное исследование крови (↑ ТТГ, ↓ св.Т4, ↓ св.Т3) (при повышенных значениях ТТГ при первом исследовании – проводятся повторные, согласно плана лаборатории); + УЗИ ЩЖ;
+ Определение костного возраста: рентгенография кистей рук (рентгенография кистей рук выявляет задержку появления ядер окостенения, их асимметрию, нарушение последовательности появления. Типично резкое отставание костного возраста от паспортного, при этом костный возраст задерживается даже в большей степени, чем рост);
+ Липидограмма (возможны ранние сосудистые осложнения);
+ ЭКГ, ЭЭГ;
+ Анамнез, клиническая картина (может и не быть).
36. Гипотиреоз у детей и подростков. Классификация, патогенез первичного и вторичного гипотиреоза. Клинические синдромы. Диагностика различных форм. Лечение и профилактика гипотиреоза. Критерии эффективности лечения гипотиреоза.
Гипотиреоз – дефицит тиреоидных гормонов в организме.
Вторичный гипотиреоз – клинический синдром, развивающийся вследствие недостаточной продукции ТТГ при отсутствии первичной патологии самой ЩЖ, которая бы могла привести к снижению ее функции.
Аутоиммунный тиреоидит (синонимы: лимфоцитарный тиреоидит, хронический тиреоидит) – это органоспецифическое аутоиммунное заболевание, приводящее к развитию гипотиреоза вследствие деструкции ткани щитовидной железы через активацию Т- и Вклеточного иммунитета с образованием аутоантител к тиреоидной ткани.
Классификация, этиология:
Более 99% всех случаев гипотиреоза у взрослых приходится на первичный приобретенный гипотиреоз. Наиболее часто гипотиреоз развивается вследствие хронического аутоиммунного тиреоидита, а также ятрогенный (послеоперационный или в исходе терапии радиоактивным йодом).





Патогенез первичного и вторичного гипотиреоза:
Патогенез первичного гипотиреоза можно рассмотреть на примере хронического аутоиммунного тиреоидита (Хашимото) (или же просто дисгенезия ЩЖ, её эктопия):
Хронический аутоиммунный тиреоидит (тиреоидит Хашимото, лимфоцитарный тиреоидит) – хроническое воспалительное заболевание ЩЖ аутоиммунного генеза, при котором в результате прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция паренхимы ЩЖ с возможным исходом в первичный гипотиреоз.
В случае постепенного прогрессирования процесса и усиления лимфоцитарной инфильтрации ЩЖ и деструкции ее фолликулярного эпителия постепенно снижается синтез тиреоидных гормонов.
В результате повышается уровень ТТГ, приводящий к гиперстимуляции ЩЖ. За счет этой гиперстимуляции на протяжении неопределенного времени может сохраняться продукция Т4 на нормальном уровне – фаза субклинического гипотиреоза.
При дальнейшем разрушении ЩЖ число функционирующих тиреоцитов снижается ниже критического уровня, т концентрация Т4 в крови также снижается (фаза явного гипотиреоза).
Патогенез вторичного гипотиреоза: например: дефицит ТТГ вследствие, например, сосудистых нарушений или травмы гипофиза.
Клинические синдромы:
Наиболее часто встречающиеся симптомы гипотиреоза: выраженная утомляемость, сонливость, сухость кожных покровов, выпадение волос, замедленная речь, отечность лица, пальцев рук и ног, запоры, снижение памяти, зябкость, охриплость голоса, подавленное настроение.
Нередко у пациентов доминируют симптомы со стороны какой-то одной системы, поэтому у пациентов нередко диагностируются заболевания-«маски»:
● «Кардиологические»: диастолическая гипертензия, дислипидемия, гидроперикард;
● «Гастроэнтерологические»: хронические запоры, желчнокаменная болезнь, хронический гепатит («желтуха» в сочетании с повышением уровня трансаминаз);
● «Ревматологические»: полиартрит, полисиновит, прогрессирующий остеоартроз;
● «Дерматологические»: алопеция, онихолиз, гиперкератоз;
● «Психиатрические»: депрессия, деменция;
● «Гинекологические»: дизменорея, аменорея.
Диагностика различных форм:

Обязательные исследования:
- Оценка уровня ТТГ в цельной крови;
- Оценка уровней ТТГ, свободного T4 в сыворотке;
Дополнительные гормональные исследования:
- Общий и биохимический анализ крови (Fe-дефицитная анемию, гиперхолестеринемию, дислипидемию);
- ЭКГ;
- Определение костного возраста:
а) рентгенография коленных суставов и стоп;
б) рентгенография кистей рук.
- УЗИ ЩЖ;
- Радиоизотопное сканирование ЩЖ.
Лечение и профилактика гипотиреоза:
Сразу же после установления диагноза, а также в сомнительных случаях должна быть начата заместительная терапия препаратами тиреоидных гормонов.
Левотироксин натрия (коммерческие названия Л-Тироксин, Эутирокс, Баготирокс) совершенно идентичен природному гормону человека тироксину, что является главным его преимуществом перед другими синтетическими препаратами. Кроме того, после приема левотироксина в крови создается «депо» этого препарата, которое расходуется по мере необходимости путем дейодирования тироксина и превращения его в T3 . Таким образом удается избежать высоких, пиковых уровней T3 в крови.
Всю суточную дозу левотироксина необходимо давать утром за 30—40 мин до завтрака, с небольшим количеством жидкости. Маленьким детям препарат допустимо давать во время утреннего кормления в растолченном виде.
Профилактика: массовая, групповая, индивидуальная профилактика гипотиреоза (см.выше)
Критерии эффективности лечения гипотиреоза:
— Нормальный уровень свободного T4 (нормализуется через 1-2 нед после начала лечения);
— Нормальный уровень ТТГ (нормализуется через 3-4 нед после начала лечения);
— Показатели физического развития в пределах нормальных значений (SDS роста, скорости роста, массы тела);
— Психомоторное развитие ребенка соответствует возрасту;
— Нормальные показатели дифференцировки скелета (соответствие костного возраста паспортному).
37. Диффузный токсический зоб у детей и подростков. Этиология. Патогенез. Клинические синдромы диффузного токсического зоба. Диагностика. Лечение. Диспансерное наблюдение.
Диффузный токсический зоб (болезнь Грейвса) – это гипертиреоз, обусловленный выработкой антител к рТТГ (↑↑Т4, ↓↓ТТГ, ↑↑↑ AT рТТГ).
Гипертиреоз – состояние, обусловленное повышенным уровнем тиреоидных гормонов в крови. Наиболее частой причиной (в 95% случаев) гипертиреоза (тиреотоксикоза) как у детей, так и у взрослых является болезнь Грейвса (БГ).
Этиология, патогенез:
Болезнь Грейвса (болезнь Базедова, диффузный токсический зоб) – системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреотропного гормона (АТ-рТТГ), клинически проявляется поражением щитовидной железы с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (офтальмопатия, поражение сердечно-сосудистой системы, сопровождающееся тахикардией и др.). Болезнь Грейвса является мультифакториальным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с этнически ассоциированной генетической предрасположенностью в патогенезе БГ определенное значение придается психосоциальным и средовым факторам.
В России в качестве синонима термина «болезнь Грейвса» традиционно используется термин «диффузный токсический зоб», хотя это не всегда так: с одной стороны, увеличения железы может не быть, с другой – он может быть не диффузным. Одновременное сочетание всех компонентов системного аутоиммунного процесса встречается не всегда и не является обязательным для постановки диагноза. В большинстве случаев наибольшее клиническое значение при болезни Грейвса имеет поражение ЩЖ.
Клинические синдромы диффузного токсического зоба:
Классическая мерзебургская (Базедова) триада (зоб, тахикардия, экзофтальм), описанная Карлом Базедовым в 1740 г., в явном виде встречается примерно у 50% пациентов.
В ряде случаев при БГ на первое место могут выходить проявления эндокринной орбитопатии (выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение «песка в глазах», отечность век).
Здесь следует оговориться, что наличие у пациента выраженной эндокринной офтальмопатии (ЭОП) позволяет практически безошибочно установить пациенту этиологический диагноз уже по клинической картине, поскольку среди заболеваний, протекающих с тиреотоксикозом, ЭОП сочетается только с БГ (ЭОП - «визитная карточка» БГ).
Важно понимать, что ЭОП не является проявлением собственно тиреотоксикоза, а развивается вследствие аутоиммунного воспаления ретробульбарной клетчатки и глазодвигательных мышц.
То есть ЭОП, наряду с поражением ЩЖ с развитием тиреотоксикоза, является еще одним проявлением системного аутоиммунного процесса при БГ. Ликвидация собственно тиреотоксикоза тиреостатической терапией или другими методами зачастую никак не отражается на течении ЭОП.
Диагностика:
● Лабораторно: синдром тиреотоксикоза (↑↑Т4, ↓↓ТТГ);
● Положительные антитела к рецепторам ТТГ (↑↑↑ AT рТТГ);
● Клиническая картина (например, наличие ЭОП);
● Сцинтиграфия ЩЖ – повышенный захват препарата всей тканью железы).
Лечение:
Консервативное – тиреостатики, бета-блокаторы:
У детей препаратом выбора при медикаментозной терапии болезни Грейвса является Тиамазол (торговые названия Мерказолил, Тирозол):
Может быть как этапом перед тиреоидэктомией или же как базовый курс лечения у пациентов с низким уровнем АТ рТТГ и отсутствием осложнений тиреотоксикоза – длительностью 12-18 месяцев с последующей отменой.
У детей с выраженными симптомами тиреотоксикоза (тахикардия, мышечная слабость, тремор, нервно-психические изменения) рекомендуется назначение бета-адреноблокаторов (атенолол, пропранолол или метопролол) в соответствующих возрасту ребенка дозах
Без радикального лечения – будет персистирующий тиреотоксикоз.
Радикальное лечение – Радиойодтерапия (РЙТ) или тиреоидэктомия (тотальная или субтотальная)
Показания к оперативному лечению: - Неэффективность медикаментозной терапии (отсутствие стойкой ремиссии); - Наличие серьезных побочных эффектов тиамазола (пропилтиоурацила); - Зоб большого размера (масса щитовидной железы > 80 г), т.к. в этих случаях реакция на йодтерапию может быть недостаточно выраженной; - Выраженная эндокринная офтальмопатия, при которой терапия йодом противопоказана; - Отказ от терапии радиоактивным йодом при неэффективности медикаментозной терапии.
Диспансерное наблюдение:
После начала терапии тиамазолом 1 раз в месяц (не реже) следует проводить:
- Осмотр ребенка;
- определение уровней свободного T4 и свободного T3;
- ОАК (обязательно с определением лейкоцитарной формулы);
- БАК (обязательно с определением активности АсАТ и АлАТ, уровня билирубина).
38. Критерии оценки физического развития. Нарушение роста у детей. Гипофизарный нанизм. Гигантизм. Дифференциальный диагноз. Лечение. Прогноз. Низкорослость. Определение. Этиология. Патогенез. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Лечение. Профилактика.
Критерии оценки физического развития (ФР) – это объективные критерии индивидуальной и коллективной оценки роста и развития детей. Составляют основу контроля за здоровьем детской популяции.
Основными критериями ФР являются: - Масса тела; - Длина тела (рост); - Окружность головы; - Окружность грудной клетки; - Пропорциональность этих показателей.
Методы оценки физического развития: - Антропометрия; - Соматометрия; - Соматоскопия; - Физиометрические показатели (объемы дыхания, объем сердца, почек, печени и пр.); - Динамометрия; - Физическая работоспособность (стептест, велоэргометрия и пр).
Для оценки соответствия индивидуальных показателей ФР ребенка с референсными значениями используется SDS (Standart Deviation Score) – коэффициент стандартного отклонения – интегральный. Он показывает сколько стандартных (сигмальных) отклонений составляет разница между средним арифметическим (табличным) и измеренным значением (примеры см. в вопросе ниже про ожирение).
Расчет SDS производится по формуле:
SDSроста = (х – Х)/SD, где х – рост ребенка, Х – средний рост для данного хронологического возраста и пола, SD – стандартное отклонение роста для данного хронологического возраста и пола. SDS = -2 соответствует 3-ей перцентили, SDS = 0 соответствует 50-ой перцентили, SDS = +2 соответствует 97-ей перцентили
Нарушение роста у детей:
Классификация задержки роста у детей и подростков:
I. Эндокринно-зависимые варианты (↓СТГ, ↓ТТГ/↓Т3,Т4, ↓половых гормонов, ↑ГКС);
II. Эндокринно-независимые варианты (заб-я сопр. анемией, гипоксией, мальабсорбции, патологии печени, почек, патология костной системы, генетические и хромосомные патологии, примордиальный нанизм);
III. Конституциональные особенности физического развития (семейная низкорослость, синдром позднего пубертата).
Гипофизарный нанизм:
Как я понял: гипофизарный нанизм – это частный случай гипопитуитаризма, который чаще всего как раз и протекает с дефицитом СТГ, поэтому уместно говорить о гипопитуитаризме.
Гипопитуитаризм (ГП) — эндокринное заболевание, обусловленное полным или частичным подавлением секреции одного или более гормонов аденогипофиза. Наиболее часто встречается дефицит соматотропного гормона (СТГ), который может быть изолированным или сочетаться с дефицитом других тропных гормонов. Частота ГП у детей колеблется от 1:4000 до 1:10 000 новорожденных.
Гипопитуитаризм бывает 2 типов: врожденный и приобретенный:
Врожденный, в свою очередь, бывает:
1) Наследственный:
а) изолированный дефицит ~СТГ (мутация гена СТГ или рецепторов к СТГ);
б) множественный дефицит гормонов аденогипофиза
2) Идиопатический дефицит рецепторов к СТГ;
3) Дефекты развития гипоталамо-гипофизарной системы: пороки развития, эктопии, дисплазии, аплазии, анэнцефалии и т.п.
Приобретенный:
1) Опухоли гипоталамуса, гипофиза и других отделов ГМ; 2) Травмы, инфекции, токсические последствия химиотерапии, облучение головы и шеи; 3) Сосудистая патология, кисты, гидроцефалия, синдром «пустого турецкого седла».
Дебютирует Гипопитуитаризм в зависимости от этиологии:
- Дефекты гена СТГ и его рецепторов проявляются в первые месяцы жизни; - Интранатальные повреждения с 3-4 лет; - Приобретенные причины с 5-7 лет.
Показатели целевого роста (ЦР): Для мальчиков = (Рост отца+Рост матери + 13 см)/2 + 7 см; Для девочек = (Рост отца+Рост матери – 13 см)/2 + 7 см.
Клинические проявления гипопитуитаризма ~СТГ:
● Выраженная низкорослость (рост ниже (минус) –2SD, гормональная же диагностика проводится только после исключения других причин низкорослости);
● Постнатальное отставание в росте;
● Прогрессирующее замедление роста (скорость роста ниже (минус) –1SD за 12-месячный период);
● Пропорциональное телосложение (размах рук = росту, коэффициент верхнего и нижнего сегментов тела в норме, при значительном отставании костного возраста (по данным рентгенографии кистей с лучезапястными суставами (ядра окостенения), там же позднее прорезывание зубов, недоразвитие эмали, неправильный рост зубов, множественный кариес, высокий голос, тонкие и сухие волосы, их медленный рост, возможна алопеция при нормальном интеллектуальном развитии ~Тирион Ланистер, но у него хондродисплазия, не путаем);
● Мелкие черты лица (кукольное лицо, в сочетании с крупным нависающим лбом за счёт недоразвития костей лицевого отдела черепа при удовлетворительном росте костей мозгового отдела черепа, могут встречаться запавшая переносица, мелкие глазные орбиты, микрогнатия).
Диагностика:
● Соматометрия,
● Сбор анамнеза,
● КТ/МРТ головного мозга любому ребенку с диагнозом дефицит гормона роста,
● Исследование уровня ИФР-1 (инсулиноподобного фактора роста-1): используется в совокупности с результатами проб на стимуляцию СТГ. Нормальный уровень ИФР-1 в сыворотке не исключает диагноз дефицита СТГ. И низкий уровень ИФР-1 не всегда сопровождается низким СТГ (см. синдром Ларона ниже).
● Выполнение СТГ-стимулирующих проб:
При исключении других возможных патологий, ассоциированных с задержкой роста и при компенсации дефицита других тропных горомонов при гипопитуитаризме: используют для проведения проб: инсулин, левадопу, клофелин, глюкагон, аргинин. При выявлении на первой пробе пика выброса СТГ > 10 нг/мл (для глюкагона > 7 нг/мл) вторая проба не проводится и исключается диагноз СТГ-дефицит. Вторая же проба проводится не ранее, чем через 48 часов после первой. Для каждого из вышеперечисленных препаратов имеется своя схема введения и забора крови поминутно. В противных случаях – пик гормона роста < 10 нг/мл подтверждает диагноз СТГ-дефицита. Частичный дефицит СТГ при значениях от 10 до 7 нг/мл, при значениях же < 7 нг/мл – дефицит тотальный. Пробу можно не проводить, если причина низкорослости (дефицита СТГ) очевида – облучение головы и шеи, операции на гипофизе по поводу удаления опухолей, дефицит ИФР-1 в крови, наличии генетического подтвержденного исследования на дефект гена СТГ.
«Семейная низкорослость», как вариант идиопатической низкорослости, ставится при исключении всех иных причин, которые привели к задержке роста.
Лечение: заместительная терапия гормоном роста до закрепления положительной динамики. Диспансеризация по месту жительства врачом-эндокринологом 1 раз в 3 месяца (первые полгода жизни), затем 1 раз в 6 месяцев. Не назначается СТГ при закрытых зонах роста.
Гигантизм:
Гигантизм – это заболевание, возникающее у лиц с открытыми эпифизарными зонами роста (у детей и подростков) при избыточной секреции передней долей гипофиза гормона роста (СТГ).
Характеризуется превышающим физиологические границы размер костей как в длину, так и в ширину. Патологическим считается рост у мужчин выше 200 см, а у женщин выше 190 см. Развивается чаще у мужчин, проявляется обычно в 9-10 летнем возрасте или в период полового созревания и продолжается далее. После окостенения эпифизарных хрящей (закрытия зон роста) гигантизм переходит в акромегалию.
В отличие от заболевания, связанного с повышенной секрецией горомона роста, «семейная высокорослость» имеет чётко выраженную наследственность и рост прекращается после закрытия зон роста (акромегалия не развивается).
Клинические проявления гигантизма:
Увеличение дистальных отделов конечностей и/или грубые черты лица, потоотделение, нарушения менструального цикла, головная боль, артропатии, синдром запястного канала, диабет или нарушение толерантности к глюкозе, эректильная дисфункция и/или нарушение либидо, артериальная гипертензия, дефекты полей зрения, обструктивное апноэ во сне, лакторея, ишемическая болезнь сердца.
Дифференциальный диагноз: Гипопитуитаризм дифференцируем между наследственными и приобретенными формами, в том числе и с заболеваниями, которые могли привести к задержке роста. Стоит также дифференцировать и с «семейной низкорослостью», но это уже диагноз исключения. Гигантизм же стоит дифференцировать с гипотиреозом (возможны сходные с акромегалией изменения в виде утолщения кожи, отечности лица, макроглоссии, повышенной дневной сонливости, огрубения голоса), так же с «семейной высокорослостью», гормон продуцирующими опухолями гипофиза, гипоталамуса, нейроинфекциями, интоксикациями, ЧМТ и т.д.
Лечение: Гипопитуитаризм – заместительная терапия гормоном роста – СТГ и другими препаратами заместительной терапии при дефиците других тропных гормонов, может быть проведена операция по выявленной причине. Гигантизм же лечим аналогами соматостатина (Сандостатин), антагонистами рецепторов СТГ.
Прогноз: При своевременной диагностике и достижении целей лечения – благоприятный.
Низкорослость – обобщающее понятие, характеризующее отставание в росте ниже -2SDS. А низкорослость уже бывает по разным причинам (см. класссификацию выше).
Этого вопроса нет в экзаменационных, но могут задать доп.вопрос:
Синдром Ларона (карликовость Ларона, дефект рецепторов СТГ) – это наследственное генетическое заболевание, возникающее из-за нарушения чувствительности рецепторов клеток к гормону роста – СТГ. Тип наследования заболевания – аутосомно-рецессивный. Причиной могут быть близкородственные браки.
Характеризуется нормальной или уменьшенной длиной тела при рождении, при этом дефицита массы тела нет, поздним прорезыванием зубов, нарастающей с возрастом степенью задержки роста. Пропорциональным телосложением, избыточной массой тела (легкой степени ожирения), «кукольным лицом», седловидный нос, недоразвитие верхней и нижней челюстей, редкие волосы, высокий (писклявый) голос, нормальный интеллект, приступы гипогликемии в детстве.
Диагностика: клиническая картина, отставание «костного» возраста от паспортного, приступами гипогликемии, нормальным или высоким СТГ (повышается по принципу обратной связи отрицательной связи), низким уровнем соматомединов (ИФР-1 (инсулиноподобный фактор роста-1)), соматомедины не возрастают после инъекций гормона роста – СТГ.
Лечение пациентов гормонов роста – СТГ – неэффективно. В настоящее время для этих целей предлагается использовать ИФР-1 (соматомедин).
Можете почитать ещё про идиопатическую задержку роста:
Идиопатическая задержка роста – это низкорослость с ростом ниже 3-й перцентили для пола и возраста (SDS роста менее -2), при которой исключены известные причины. Критерии идиопатической низкорослости:
● Нормальные длина и вес при рождении; ● Отсутствие диспропорционального телосложения; ● Отсутствие хронических системных заболеваний (со стороны сердца, почек и др.); ● Отсутствие психоэмоциональных (стрессорных) факторов; ● Отсутствие алиментарных факторов; ● Отсутствие других эндокринопатий.
После 13-14 лет обе формы подразделяют на низкорослость с задержкой пубертата и без нее. Задержка пубертата ставится: у девочек в 13 лет - при отсутствии увеличения молочных желез; у мальчиков в 14 лет – при объеме яичек меньше 4 мл. Несемейную низкорослость с задержкой пубертата также называют конституциональной задержкой роста и пубертата. При наличии нормального выброса СТГ при проведении стимуляционных проб хотя бы на одном из тестов, ставится идиопатическая низкорослость.
Таким образом, идиопатическая низкорослость делится на:
а) Семейная низкорослость:
- с задержкой пубертата;
- без задержки пубертата.
б) Несемейная низкорослость:
- с задержкой пубертата (конституциональная задержка роста и пубертата);
- без задержки пубертата.
Идиопатическая низкорослость – диагноз исключения.
При сборе анамнеза необходимо уточнение наличия внутриутробной задержку роста, хронические системные заболевания и пороки развития органов дыхания, сердечно-сосудистой системы, крови, печени, почек, ЖКТ, которые могут быть причинами низкорослости. Проведение антропометрии по способу SDS, оценивается скорость роста, пропорциональность тела, половое развитие, рентгенография костей, стимуляционные пробы СТГ.
Лечение гормоном роста. Наилучшим критерием эффективности терапии является изменение SDS роста. Лечение продолжается до достижения роста, близкого к конечному (до закрытия зон роста), т.е. скорость роста менее 2 см/год, и/или костный возраст >16 лет у мальчиков и >14 лет у девочек.
39. Определение понятия «ожирение». Классификация. Конституционально-экзогенное ожирение. Этиология. Клинические проявления. Дифференциальный диагноз. Лечение. Прогноз. Гипоталамическое ожирение. Этиология. Патогенез. Клиника. Дифференциальный диагноз. Принципы терапии. Прогноз.
Ожирение – это гетерогенная группа состояний, заболеваний и синдромов, наследственных и приобретенных, обусловленных или осложнившихся нейрогормональными и метаболическими нарушениями, общим проявлением которых является избыточное накопление жировой ткани в организме.
Классификация:
По этиологии:
- Простое (конституционально-экзогенное, идиопатическое) – ожирение, связанное с избыточным поступлением калорий в условиях гиподинамии и наследственной предрасположенности (ожирение как следствие реализации эпигенотипа, наследственной предрасположенности, гиподинамии и избыточного питания);
- Гипоталамическое – ожирение, связанное с наличием и лечением опухолей гипоталамуса и ствола мозга, лучевой терапии опухолей головного мозга и гемобластозов, вызванное травмой ГМ или инсультом;
- Ожирение при нейроэндокринных заболеваниях (гиперкортицизм, гипотиреоз и д.р.);
- Ожирение ятрогенное (вызванное длительным приемом ГКС, антидепрессантов и д.р.);
- Моногенное ожирение – вследствие мутации в генах лептина (гормона насыщения), Re лептина, Re минералкортикоидов и д.р.;
- Синдромальное ожирение – при хромосомных и других генетических синдромах: Прадера-Вилли, Дауна, Барде-Бидля, хрупкой Х-хромосомы и д.р.
II. По этиологическому принципу:
- Первичное: конституционально-экзогенное (отягощенный семейный анамнез, раннее ИВ, образ жизни в семье, способствующий ожирению);
- Вторичное (как синдром):
а) вследствие генетических аномалий (синдромы, ассоциированные с ожирением, моногенное ожирение (мутация, например, в генах лептина, или в его Re));
б) вследствие основной болезни (гиперкортицизм, гипогонадизм, гипотиреоз, гипопитуитаризм, преждевременное половое развитие (ППР) у девочек) + сюда же нейроинфекции, травмы ГМ, опухоли ГМ, ятрогенные причины ожирения.
III. По наличию осложнений:
- Нарушения углеводного обмена (СД, нарушение толерантности к глюкозе, нарушение гликемии натощак и д.р.), неалкогольная жировая болезнь печени (НЖБП) или же метаболически ассоциированная жировая болезнь печени (МАЖБП), дислепидемия (атеросклероз), артериальная гипертензия (АГ), задержка или же ускорение полового развития, гинекомастия, синдром апноэ, синдром дыхательных нарушений, заболевания опорно-двигательного аппрата, желчно-каменная болезнь (ЖКБ).
IV. По степени ожирения (таблицы для ♀ и ♂ по соотношению ИМТ и возраста):
- Согласно диагностическому критерию – SDS ИМТ – стандартные отклонения ИМТ:
SDS ИМТ 1,0 – 1,9 – избыточная масса тела; SDS ИМТ 2,0 – 2,5 – 1 степень ожирения; SDS ИМТ 2,6 – 3,0 – 2 степень ожирения; SDS ИМТ 3,1 – 3,9 – 3 степень ожирения; SDS ИМТ ≥ 4,0 – морбидное ожирение.

V. По характеру гистологических изменений жировой ткани:
- Гипертрофическое ожирение – количество жировых клеток остается нормальным, а накопление жира идёт путем увеличения их размера (похудеть легче, т.к. клеток меньше);
- Гиперпластическое ожирение – ожирение за счёт увеличения количества жировых клеток (адипоцитов), а не их гипертрофии (сохранить эффект похудания – тяжелее).
Конституционально-экзогенное ожирение:
Этиология:
Приставка «экзогенно» означает, что поступает много калорий в условиях гиподинамии, которые откладываются в виде жировых тканей, а термин «конституциональное» – что ребенок обладает предрасположенностью к накоплению жиров (ожирению) + на фоне реализации факторов окружающей среды (эпигенотип).
Это самая многочисленная группа ожирений, на долю которой приходится до 98—99% всех случаев ожирения.
Клиническая картина:
Дебют заболевания чаще всего бывает в возрасте после 5 лет, или в начале периода полового созревания. Как правило, ожирение постепенно-прогрессирующего характера, на фоне хороших (зачасто ускоренные) темпов роста. Выраженная прибавка массы тела в период пубертата. Наличие стрий, фолликулярного кератоза, полифагии, акантоза, артериальной гипертензии и др. не всегда коррелирует со степенью ожирения. Характерно наличие избыточной массы тела и ожирения у родственников (родители, бабушки, дедушки), в связи с чем данная форма часто называется «конституциональной».
Диф. диагностика:
Исключение других форм ожирения, сопутствующих заболеваний, ассоциированных с ожирением и прочего с помощью подробного сбора анамнеза (наследственная предрасположенность, отягощенный семейный анамнез по СД, ССС патологии, большая масса при рождении ( ≥ 4,5 кг), задержка ВУР, продолжительность ГВ, возможный перевод на ИВ, родовые травмы, ЧМТ ребенка, важно уточнить возраст, в котором стал отмечаться избыточный набор веса).
По поводу информации об образе жизни пациента: особенности его питания и пищевы предпочтения (кратность, количество, объем, и характер принимаемой пищи), оценка адекватности физической активности (возможная гиподинамия) – время нахождения за компьютером, перед телевизером, гуляет, спорт.секции и т.д.)
Исключение патологии углеводного обмена, СД, кардиоваскулярных факторов риска. Вычисление индекса HOMA-IR: глюкоза натощак * инсулин натощак / 22,5. Значение ≥ 4,39 оценивается как инсулинорезистентность.
Проведение СМАД, ЭКГ, Эхо-КГ, исследования дых.системы, гормонального фона и т.п.
Лечение:
● Модификация образа жизни – основа терапии ожирения и его профилактики: диетотерапия, расширение физической активности и коррекция пищевого поведения как у детей, так и, желательно, у родителей.
● Фармакологическая терапия – только в случае неэффективности модификации образа жизни (орлистат) – продолжительность терапии не более 1 года!
● Бариатрическая хирургия – только как способ лечения морбидного ожирения у подростков (в РФ у детей данный метод лечения ожирения запрещен! Потому что, по факту, после баритрии ты становишься инвалидом, теперь думайте).
Прогноз:
Положительный, при условии соблюдения правил своевременной профилактики и лечения как ожирения, так и его осложнений + своевременное лечение заболеваний, ассоциированных с ожирением.
Гипоталамическое ожирение:
Гипоталамическое ожирение — ожирение, связанное с наличием и лечением опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа или инсультом.
Этиология:
Гипоталамическое ожирение является серьезным осложнением, которое наблюдается у 30—70% детей, перенесших оперативное или лучевое лечение по поводу опухолей гипоталамуса и ствола мозга, а также травму черепа.
Патогенез:
Считается, что в патогенезе данной формы ожирения, подтверждаемом исследованиями на моделях животных, принимает участие повреждение вентромедиального гипоталамуса.
Клиническая картина:
Как правило, в большинстве случаев ожирение быстропрогрессирующего характера развивается после оперативного вмешательства (лучевой терапии), реже — предшествует периоду постановки диагноза. В случае краниофарингиомы для большинства пациентов характерно замедление темпов роста; для глиом — симптомы преждевременного полового развития; неврологические жалобы (головная боль, нарушение зрения) зависят от локализации и прогрессии опухоли. !Могут наблюдаться и другие эндокринные патологии, ведь повреждение идёт самого гипоталамуса, который вырабатывает либерины и статины – а теперь думайте.
Говоря о метаболических особенностях, пациенты с гипоталамическим ожирением имеют сопоставимые значения инсулина, инсулинорезистентности и лептина с группой простого ожирения. Вместе с тем эти пациенты имеют выраженную дислипидемию, а также меньшие показатели роста и инсулиноподобного ростового фактора 1.
Диф. диагностика: см.выше.
Лечение:
К сожалению, на сегодняшний день какие-либо диетические или фармакологические воздействия при данной форме ожирения неэффективны. Наилучший способ лечения гипоталамического ожирения — это его профилактика, основанная на совершенствовании методов хирургического лечения, соблюдении режима и принципов рационального питания в послеоперационном периоде.
Прогноз: При своевременной оказании помощи – благоприятный.
40. Половое развитие. Варианты нарушения полового развития. Понятие о преждевременном половом развитии. Клиника, дифференциальный диагноз. Тактика врача в вопросах определения пола. Вопросы деонтологии.
Половое развитие (также пубертатный период или пубертат) — это естественный процесс изменений в организме подростка, вследствие которых он становится взрослым и способным к продолжению рода.
Половое созревание является составляющей биологического созревания. Оно связано с выработкой в организме половых гормонов. В половом созревании девочки решающую роль играют гормоны эстроген, прогестерон, ФСГ, ЛГ; мальчика – тестостерон.
Возраст, когда начинается половое созревание у всех сверстников разный — это нормально. В среднем половое созревание девочек начинается на 1 -2 года раньше, чем у мальчиков, поэтому девочки иногда выше и старше на вид, но это временно, через 1 -2 года мальчики догонят и перегонят их.
В норме первые признаки полового созревания появляются у девочек в период 8-13 лет, а у мальчиков 9-14 лет.
Варианты нарушения полового развития:
Тип полового развития |
Девочки (♀) |
Мальчики (♂) |
Преждевременное половое развитие |
<7 лет |
<8 лет |
Раннее (ускоренное) половое развитие |
7 лет |
8 лет |
Нормальные сроки начала полового созревания |
8-13 лет |
9-14 лет |
Задержка полового развития |
>13 лет |
>14 лет |
Понятие о преждевременном половом развитии:
Классификация преждевременного полового развития:
● Гонадотропин-зависимое преждевременное половое развитие: (например, при объемных образованиях ГМ, либо идиопатическое)
● Гонадотропин-независимое преждевременное половое развитие: (генетические синдромы (Мак-Кьюна—Олбрайта—Брайцева, фолликулярные кисты у ♀), тестотоксикоз, опухоли, секретирующие ХГЧ, у ♂)
● Ложное (изосексуальное = андрогены у мальчиков, эстрогены у девочек и гетеросексуальное = эстрогены у мальчиков, андрогены у девочек) преждевременное половое развитие:
(эстроген (♀)/андроген (♂) секретирующие опухоли яичников/тестикул и надпочечников, либо врожденная дисфункция коры надпочечников (ВДКН) (см.выше.)
● Изолированные формы преждевременного полового развития: (изолированное преждевременное телархе, адренархе)
Помимо этого выделяются так называемые парциальные (неполные) формы ППР, характеризующиеся изолированным развитием вторичного оволосения (преждевременное пубархе) и изолированным увеличением молочных желез у девочек (преждевременное телархе).
У девочек преждевременное половое развитие (ППР) встречается чаще, чем у мальчиков.
Клиническая картина:
Истинное гонадотропинзависимое ППР всегда бывает полным, т. е. у девочек после увеличения молочных желез и ускорения темпов роста появится половое оволосение и наступит менархе, а у мальчиков наряду с увеличением гениталий и ускорением роста будет происходить рост яичек.
При ложном половом развитии у мальчиков по тем или иным причинам происходит андрогенизация, однако нет стимулирующего воздействия ФСГ на гонады, вследствие чего не отмечается роста объема яичек.
У девочек при изосексуальном ложном половом развитии эстрогенизация не приводит к наступлению менархе.
Возможны менструальноподобные кровотечения при кистах яичников или при синдроме Мак-Кьюна—Олбрайта—Брайцева, обусловленные резкими колебаниями уровня эстрогенов, но они никогда не бывают циклическими.
В любом случае при различных формах ППР имеются свои особенности клинической картины:
Например, отличительной чертой синдрома Мак-Кьюна-Олбрайта-Брайцева являются пигментные пятна неправильной формы и асимметричной локализации цвета кофе с молоком и фиброзно-кистозная дисплазия костной ткани.
При тестотоксикозе отличительной чертой является высокий уровень тестостерона при низком уровне гонадотропинов и маленьком объеме яичек (не более 6—8 мл), поскольку основной объем яичек составляют структуры, рост которых стимулирован ФСГ.
Диагностика:
Изначально проводится клиническая диагностика ППР основанная на оценке стадии полового развития по шкале Таннера, в том числе оценка объема яичек у мальчиков и оценка менструальной функции у девочек:

Для подтверждения ППР проводится: антропометрия, подсчёт скорости роста за последние полгода-год, оценка костного возраста на основании рентгенографии кистей, можно выполнить УЗИ малого таза для девочек, определение уровня гормонов в крови.
Дифференциальный диагноз:
● Стимуляционная проба с ГнРГ:
Стимуляционная проба с ГнРГ позволяет дифференцировать гонадотропинзависимые формы ППР от гонадотропин-независимых и от изолированного телархе у девочек.
Методика проведения пробы: определяется базальный уровень ЛГ и ФСГ, вводится препарат ГнРГ, на фоне стимуляции определяется уровень ЛГ и ФСГ (повышение уровня ЛГ до более чем 10 ед/л свидетельствует в пользу гонадтропинзависимого ППР)
● Гормональный профиль:
У мальчиков с ППР обязательным является определение уровней 17-гидроксипрогестерона (17ОНР) для исключения ВДКН, β-ХГЧ и исключения андрогенпродуцирующих опухолей надпочечников.
● Визуализирующие методы: МРТ ГМ, УЗИ надпочечников, яичников, яичек, печени, КТ средостения;
● Проба с АКТГ;
● Молекулярно-генетические методы.
Тактика врача в вопросах определения пола: Для определения пола можно использовать кариотипирование, по итогам которого: - Дети с кариотипом 46, ХХ воспитываются в женском поле, - Дети с кариотипом 46, ХY воспитываются в мужском поле.
При отсутствии своевременного назначения лечения при преждевременном половом развитии отмечается ускоренное закрытие зон роста и негативный прогноз конечного роста, что может потребовать психологической поддержки для адаптации пациента.
Вопросы деонтологии:
Каждому встречному-поперечному не рассказывать о том, что увидели, что услышали, кого встретили. Каждый ребенок, в том числе и родители, нуждаются в медико-психологической и социальной поддержке.
41. Сахарный диабет I типа у детей и подростков. Этиологические концепции. Патогенез. Классификация. Клиника манифестного периода. Лабораторная диагностика. Клинические и лабораторные диагностические критерии. Принципы терапии. Инсулинотерапия – расчет и коррекция дозы, схемы лечения. Мониторинг эффективности инсулинотерапии. Профилактика и диспансерное наблюдение. Клиника, диагностика, профилактика ранних осложнений. Профилактика. Лечение. Клиника, диагностика сосудистых осложнений. Профилактика. Лечение.
Сахарный диабет (СД) — это большая группа сложных метаболических заболеваний, которая характеризуется хронической гипергликемией, обусловленной нарушением секреции или действия инсулина, или сочетанием этих нарушений. Нарушение секреции инсулина и/или снижение реакции тканей на инсулин в составе сложных гормональных процессов приводят к нарушению воздействия инсулина на ткани-мишени, что, в свою очередь, вызывает нарушения углеводного, жирового и белкового обмена. У одного и того же пациента могут одновременно наблюдаться нарушение секреции инсулина и нарушение его действия.
СД 1 типа (СД1) — заболевание, возникающее в результате аутоиммунной деструкции инсулинпродуцирующих β-клеток поджелудочной железы, с последующем развитием абсолютной инсулиновой недостаточности.
Этиологические концепции:
СД1 характеризуется хронической, иммуноопосредованной деструкцией β-клеток островков поджелудочной железы, которая приводит, в большинстве случаев, к абсолютному дефициту инсулина. Разрушение β-клеток происходит с различной скоростью и становится клинически значимым при разрушении примерно 90% β-клеток.
СД1 является многофакторным заболеванием, однако конкретные механизмы взаимодействия генетической предрасположенности, факторов окружающей среды, состояния иммунной системы, лежащие в основе СД1, остаются неясными.
Экологические триггеры (инфекционные, алиментарные или химические), инициирующие разрушение β-клеток, остаются неизвестными. Имеются сообщения, что энтеровирусная инфекция, перенесенная во время беременности либо на протяжении жизни, особенно когда заражение происходит в раннем детстве, ассоциирована с появлением островкового аутоиммунитета и СД1.
Патогенез:
СД1 – это аутоиммунное заболевание, развивающееся у генетически предрасположенных к нему лиц, при котором хронически протекающий лимфоцитарный инсулит приводит к опосредованной Т-лимфоцитами деструкции В-клеток ПЖ с последующим развитием абсолютной инсулиновой недостаточности со склонностью к развитию кетоацидоза.
Гены предрасположенности к развитию СД1 относятся к главному комплексу гистосовместимости (MHC).
Аутоантитела вырабатываются к следующим аутоантигенам:
- (ICA) – антиплазматические антитела к островкам ПЖ;
- (GAD) – антитела к глутамат-декарбоксилазе;
- (IAA) – антитела к инсулину;
- (IA-2) – антитела к тирозинфосфатазе;
- (ZnT8) – антитела к транспортеру цинка (не используется в клинической практике).

Классификация:

Клиника манифестного периода:
Полиурия, жажда, признаки дегидратации и гиповолемии (снижение АД, возможна олиго- и анурия), слабость, повышенние аппетита, тошнота, рвота, запах ацетона в выдыхаемом воздухе, головная боль, одышка, в терминальном состоянии дыхание Куссмауля, нарушения сознания – от сонливости, заторможенности до комы. Часто – абдоминальный синдром (ложный «острый живот», диабетический псевдоперитонит) – боли в животе, рвота, напряжение и болезненность брюшной стенки, парез перистальтики или диарея.
Лабораторные и клинические диагностические критерии:
До проведения ПГТТ (перорального глюкозотолерантного теста): *ГПН (глюкоза в плазме (венозной) натощак):
- ГПН < 6,1 ммоль/л – норма;
- ГПН 6,1-7,0 ммоль/л – нарушенная гликемия натощак (преддиабет);
- ГПН ≥ 7,0 ммоль/л – предполагаемый диагноз СД, который должен быть подтверждён в соответствии с критериями (лабораторные (эти и ниже) + гликированный Hb + клинические проявления) СД.
!При наличии клинической симптоматики: полиурия, полидипсия, полифагия, потеря массы тела диагноз СД может быть выставлен при наличии только одного лабораторного показателя, например, ГПН.
Далее можно провести ПГТТ (детям после 10 лет), до 10 лет или при ИМТ (ожирении) можно провести нагрузку глюкозой с помощью пищи с «быстрыми» углеводами.
*ГП2 (глюкоза в плазме через 2 часа после выпитой глюкозы во время ПГТТ):
- ГП2 < 7,8 ммоль/л – нормальная толерантность к глюкозе;
- ГП2 7,8-11,0 ммоль/л – нарушенная толерантность к глюкозе (НТГ);
- ГП2 ≥ 11,0 ммоль/л – предполагаемый диагноз СД, который должен быть подтверждён в соответствии с критериями (лабораторные (эти и выше) + гликированный Hb + клинические проявления) СД.
~ Правила проведения ПГТТ: 3 дня нормально кушает ребенок с нормальными физ.нагрузками (обычными для него), затем не ест еду 8-14 часов (спит как раз, пить воду можно). Приходит в больничку – берется кровь натощак и получаем ГПН, затем даём выпить ему за 5 минут 1,75 г/кг массы тела безводной глюкозки. Через 2 часа осуществляется повторный забор крови и мы получим уже ГП2.
!В качестве диагностического критерия СД выбран уровень гликированный гемоглобин (гемоглобин, который показывает уровень глюкозы в крови за 3 месяца примерно), уровень его при СД = HbA1c ≥6,5 %. Нормальный же уровень 4-6%.
!Ещё смотрим на наличие глюкозурии (в норме у здорового человека глюкоза в моче отсутствует), появляется же она при уровне глюкозы в крови 10+ ммоль/л. В «домашних» условиях это можно понять по тому, что моча липкая на кафеле, ободке, рундуке 😉 (не сладкая! не пробуйте).
!Ещё можем посмотреть С-пептид – вещество,которое образуется при расщеплении проинсулина пептидазами, является показателем секреции собственно инсулина. При СД1 он снижен или вовсе не определяется, потому что у ребенка абсолютная инсулин.недост.
!Ещё можем посмотреть те самые аутоантитела к аутоантигенам, которые были описаны выше.
Принципы терапии:
- Инсулинотерапия (базисно-болюсная + корригирующие дозы шприц ручкой / помпой); *иглы для шприц ручки лучше использовать 4 или 6 мм. Колоть в разные участки тела – профилактика липодистрофии.
- Правильное питание (понятие о ХЕ – хлебных единицах и т.п. 1 ХЕ = 10 г. углеводов);
- Физические нагрузки (мыщцы во время работы потребляют глюкозку = ↓ её уровень. Но важно их правильно дозировать, чтобы не «уйти» в гипогликемию при повышенных физических нагрузках – тренажерный зал и т.п.);
- Обучение самоконтролю и проведение его в домашних условиях + школы диабета;
- Психологическая помощь (ребенок получает категорию «ребенок-инвалид» – это может давить на него, ведь он уже не такой, как его сверстники).
Цели лечения детей и подростков с СД1:
- Достижение макс. близкого к референсу уровня углеводного обмена (глю, HbA1c);
- Нормальное физическое и соматическое развитие ребенка;
- Развитие самостоятельности и мотивации к самоконтролю (6-10 раз в день самоконтроль);
- Профилактика специфических осложнений СД (кетоацидоз, гипогликемия, комы).
Инсулинотерапия – расчет и коррекция дозы, схемы лечения:
Заместительная инсулинотерапия на сегодняшний день является основным и неотъемлемым компонентом и единственным медикаментозным методом лечения СД1 у детей. Во всех возрастных группах основной целью инсулинотерапии является достижение и поддержание близкого к физиологическому уровня инсулинемии и оптимальный гликемический контроль.
Выделяют: Инсулины короткого действия, Инсулины средней продолжительности действия, Инсулины длительного действия + их комбинации.
Дозы препаратов инсулина и схема введения подбирается индивидуально для каждого пациента исходя из возраста, профиля действия инсулина, индивидуальной переносимости и пр. на основании данных гликемического контроля (показателей гликемии и уровня НbА1с). Дозы препаратов инсулина и схема их введения может значительно варьировать между пациентами с СД1, в том числе в период ремиссии дозы препаратов инсулина могут быть минимальными, вплоть до полной отмены (полная ремиссия СД1) на определенное время, однако окончательное решение о схеме и дозах зависит строго от показателей гликемии и уровня НbА1с. В реальной клинической практике перевод с одного препарата инсулина и его аналогов на другой происходит достаточно часто. При переводе пациента с одного инсулина на другой необходимо соблюдать следующий алгоритм требований для наилучшего обеспечения безопасности пациента.
Помповая инсулинотерапия или НПИИ (непрерывная подкожная инфузия инсулина) – современный метод инсулинотерапии, позволяющий лучше всего имитировать физиологический профиль инсулинемии. В режиме НПИИ инсулин вводится подкожно, непрерывно путем предварительно запрограммированной базальной скорости и введением отдельных болюсов на приемы пищи и в случае гипергликемии.
Мониторинг эффективности инсулинотерапии:
Контроль ГК проводится с использованием глюкометров или систем НМГ (непрерывного мониторинга глюкозы, могут быть встроены в помпы (см.ниже)).
В домашних условиях используются индивидуальные глюкометры. В настоящее время существуют глюкометры с настройкой индивидуального целевого диапазона гликемии, а также глюкометры с функцией беспроводной передачи данных об уровне глюкозы медицинским специалистам, родственникам или в установленное на смартфон пациента специальное приложение для использования при дистанционном наблюдении.
В условиях медицинских организаций, помимо лабораторных анализаторов, необходимо использовать глюкометры для профессионального применения (многопользовательские, госпитальные), обладающими более высокой точностью измерения.
Но главное помнить, что НМГ и глюкометр полность не заменяет самоконтроль. Нужно побудить ребенка к самоконтролю за своим здоровьем и уровнем сахара.
Цель – достигнуть продолжительность «целевого» уровня глюкозы min. 70% от суток.
Профилактика и диспансерное наблюдение:
Рекомендуется консультация и осмотр врача-детского эндокринолога не реже одного раза в три месяца пациентов с СД1 для оценки состояния здоровья, гликемического контроля (гликемический профиль, HbA1c), инсулинотерапии, физического и полового развития, состояния мест инъекций инсулина/введений инфузионной системы/сенсоров НМГ.
Профилактика сосудистых осложнений:
Рекомендуется исследование уровня общего холестерина, холестерина липопротеинов низкой плотности (ЛПНП), холестерина липопротеинов высокой плотности (ЛПВП), триглицеридов у пациентов с СД1 при диагностике заболевания, начиная с возраста 10-11 лет и затем один раз в 5 лет с целью своевременного выявления дислипидемии. Высокий уровень холестерина ЛПНП определяется при его значениях выше 2,6 ммоль/л. В этих случаях пациентам с СД1 рекомендуется улучшение метаболического контроля, изменения в питании (гипохолестериновая диета) и увеличение физической активности. Если в семье есть отягощенная наследственность по гиперхолестеринемии, по ранним сердечно-сосудистым заболеваниям или семейная наследственность неизвестна, то рекомендуется проведения скрининга, начиная с 2-х лет.
42. Неотложные состояния при сахарном диабете I типа у детей. Диабетический кетоацидоз у детей и подростков. Причины. Клинические проявления в зависимости от степени тяжести кетоацидоза. Диагностика. Неотложная помощь на догоспитальном и госпитальном этапах. Дифференциальный диагноз коматозных состояний при сахарном диабете у детей. Гипогликемические состояния. Клинические и лабораторные критерии диагностики. Оказание неотложной помощи при гипогликемии. Гиперосмолярная и гиперлактацидемическая комы. Этиология. Клиника. Дифференциальная диагностика. Неотложная помощь на догоспитальном и госпитальном этапах.
Неотложные состояния при сахарном диабете I типа у детей:
- Диабетический кетоацидоз (ДКА);
- Гипогликемия и гипогликемическая кома;
- Гиперосмолярное гипергликемическое состояние (ГГС);
- Молочнойкислый ацидоз (лактатацидоз).
Диабетический кетоацидоз (ДКА) – требующая экстренной госпитализации острая декомпенсация СД, с гипергликемией (уровень глюкозы плазмы > 11 ммоль/л у детей), гиперкетонемией (> 5 ммоль/л), кетонурией (≥ ++), метаболическим ацидозом (рН < 7,3, уровень бикарбоната < 15 ммоль/л) и различной степенью нарушения сознания или без нее.
Причины:
- неправильное лечение (назначение недостаточных доз инсулина);
- нарушение режима инсулинотерапии (пропуск инъекций (некоторые девочки-подростки могут умышленно пропускать дозы инсулинотерапии, чтобы повысить уровень глюкозы в крови до 10+ ммоль/л и вызвать глюкозурию, ведь эта глюкоза, которая будет выходить с мочей будет браться из запасенных гликогена и жира = способ похудеть, по их мнению), использование просроченных инсулинов, пользование неисправными шприц-ручками, отсутствие самоконтроля);
- грубые нарушения в питании;
- резкое возрастание потребности в инсулине, которое может развиться по ряду иных причин (инфекции, травмы, стрессы, сопутствующая эндокринная патология, применение некоторых ЛС).
Патогенез:
Дефицит энергии в митохондриях из-за нарушения окислительного фосфорилирования → компенсаторная активация липолиза и кетогенеза → гипергликемия ( > 10 ммоль/л), гиперкетонемия → повышение осмодиуреза → потеря электролитов с мочой и рвотой (натрий, калий, фосфор, магний) → дегидратация, гипоперфузия в тканях → накопление лактата = лактоацидоз.
Клинические проявления в зависимости от степени тяжести кетоацидоза:
Клинические признаки ДКА включают в себя: обезвоживание, тахикардию, тахипноэ, глубокое вздыхание, запах ацетона в выдыхаемом воздухе, тошноту и/или рвоту, боль в животе, ухудшение зрения, спутанность сознания, сонливость, прогрессирующее снижение уровня сознания и, в конечном итоге, кому.
По тяжести выделяют легкую, умеренную и тяжелую степени ДКА. При легкой степени нарушения сознания – нет, pH <7,3. При умеренной – нет или сонливость, pH <7,2. При тяжелой – сопор или кома, pH <7,1.
Диагностика:
- ОАК: Лейкоцитоз: < 15*10^9 – стрессовый, > 25*10^9 – инфекция;
- ОАМ: Глюкозурия, кетонурия, протеинурия (непостоянно);
- БАК: Гипергликемия, гиперкетонемия. Повышение креатинина (непостоянно; чаще указывает на транзиторную «преренальную» почечную недостаточность, вызванную гиповолемией). Транзиторное повышение АЛТ, АСТ, КФК (протеолиз),Na+ чаще нормальный, реже снижен или повышен, К+ чаще нормальный, реже снижен.
- КЩС: Декомпенсированный метаболический ацидоз (рН ≤ 7,3).
В домашних условиях пациенты могут использовать тест полоски на определение уровня кетонов в моче при ухудшении самочувствия, что позволит оказать медицинскую помощь на более ранних этапах развития ДКА. Родителям и близким же стоит обращать внимание на запах ацетона изо рта и самочувствие (степень сознания) ребенка.
Неотложная помощь на догоспитальном и госпитальном этапах:
Лечение ДКА включает: регидратацию, введение инсулина и его аналогов, устранение электролитных нарушений, борьбу с ацидозом, общие мероприятия, лечение состояний, вызвавших ДКА.
Догоспитальный этап:
При минимальных признаках дегидратации (отсутствия выраженных изменений со стороны электролитов крови) назначают обильное питье и подкожное введение инсулина до нормализации гликемии.
Госпитальный этап:
При дегидратации более 5%, тошноте и рвоте, глубоком дыхании, но без потери сознания назначают регидратацию: 0,9% раствором NaCl из расчета 10 мл/кг в час до исчезновения симптомов обезвоживания, к раствору добавляют КCI из расчета 40 ммоль на литр жидкости до нормализации электролитных нарушений. Проводится мониторирование ЭКГ до нормализации Т-волн, контроль АД.
При нарушении сознания (любая форма) – сразу госпитализируем в ОРИТ.
Цели лечения состоят в коррекции обезвоживания, ацидоза и кетоза, постепенного восстановления гиперосмоляльности и гликемии до близкого к нормальному уровню, мониторинге и лечении осложнений ДКА, а также в выявлении и лечении сопутствующей патологии. Не рекомендуется введение натрия бикарбоната.
Дифференциальный диагноз коматозных состояний при сахарном диабете у детей:
ДКА необходимо дифференцировать, в первую очередь, с апоплектической, алкогольной (редко встречающихся у детей), гиперосмолярной, гипогликемическими комами и различными отравлениями. Явления кетоацидоза могут наблюдаться также при длительном голодании, алкогольной интоксикации, заболеваниях желудка, печени и кишечника.
Гипогликемия и гипогликемическая кома:
Уровень 1: значения глюкозы плазмы от 3,0 до < 3,9 ммоль/л (с симптомами или без) у больных СД, получающих сахароснижающую терапию, указывают на риск развития гипогликемии и требуют начала мероприятий по купированию гипогликемии независимо от наличия или отсутствия симптомов.
Уровень 2: значения глюкозы плазмы < 3.0 ммоль/л, с симптомами или без – клинически значимая гипогликемия, требующая немедленного купирования.
Уровень 3: тяжелая гипогликемия – гипогликемия в пределах вышеуказанного диапазона с таким нарушением когнитивных функций (включая потерю сознания, т.е. гипогликемическую кому), которое требует помощи другого лица для купирования.
Причины:
Избыток инсулина в организме по отношению к поступлению углеводов извне (с пищей) или из эндогенных источников (продукция глюкозы печенью), а также при ускоренной утилизации углеводов (например, мышечная работа).
Клинические и лабораторные критерии диагностики:
• Вегетативные симптомы: сердцебиение, дрожь, бледность кожи, потливость, мидриаз, тошнота, сильный голод, беспокойство, тревога, агрессивность;
• Нейрогликопенические симптомы: слабость, нарушение концентрации, головная боль, головокружение, сонливость, парестезии, нарушения зрения, растерянность, дезориентация, дизартрия, нарушение координации движений, спутанность сознания, кома; возможны судороги и другие неврологические симптомы;
• Глюкоза плазмы < 3,0 ммоль/л (при коме – как правило, < 2,2 ммоль/л).
Оказание неотложной помощи при гипогликемии:
Легкая гипогликемия (не требующая помощи другого лица):
Прием 1-2 ХЕ быстро усваиваемых углеводов: сахар (2-4 куска по 5 г, лучше растворить), или мед или варенье (1–1,5 столовых ложки), или 100–200 мл фруктового сока, или 100–200 мл лимонада на сахаре, или 4-5 больших таблеток глюкозы (по 3–4 г), или 1-2 тубы с углеводным сиропом (по 10 г углеводов). Если через 15 минут гипогликемия не купируется, повторить лечение. Если гипогликемия вызвана пролонгированным инсулином, особенно в ночное время, то дополнительно съесть 1-2 ХЕ медленно усваиваемых углеводов (хлеб, каша и т.д.).
Тяжелая гипогликемия: (потребовавшая помощи другого лица, с потерей сознания или без нее)
• Пациента уложить на бок, освободить полость рта от остатков пищи. При потере сознания нельзя вливать в полость рта сладкие растворы (опасность асфиксии!);
• В/в струйно ввести 40 – 100 мл 40 % раствора глюкозы, до полного восстановления сознания;
• Альтернатива – 1 мг (маленьким детям 0,5 мг) глюкагона п/к или в/м (вводится родственником больного);
• Если сознание не восстанавливается после в/в введения 100 мл 40 % раствора глюкозы – начать в/в капельное введение 5–10 % раствора глюкозы и госпитализировать;
• Если причиной является передозировка ПССП с большой продолжительностью действия, в/в капельное введение 5–10 % раствора глюкозы продолжать до нормализации гликемии и полного выведения препарата из организма.
Гиперосмолярная и гиперлактацидемическая комы:
Гиперосмолярное гипергликемическое состояние (ГГС) – острая декомпенсация СД, с резко выраженной гипергликемией (как правило, уровень глюкозы плазмы > 35 ммоль/л), высокой осмолярностью плазмы и резко выраженной дегидратацией, при отсутствии кетоза и ацидоза.
Основная причина: выраженная относительная инсулиновая недостаточность + резкая дегидратация.
Клиническая картина: выраженная полиурия (впоследствии часто олиго- и анурия), выраженная жажда (у пожилых может отсутствовать), слабость, головные боли; выраженные симптомы дегидратации и гиповолемии: сниженный тургор кожи, мягкость глазных яблок при пальпации, тахикардия, позднее – артериальная гипотензия, затем нарастание недостаточности кровообращения, вплоть до коллапса и гиповолемического шока; сонливость, сопор и кома. Запаха ацетона и дыхания Куссмауля нет.
Особенность клиники ГГС – полиморфная неврологическая симптоматика: (судороги, дизартрия, двусторонний спонтанный нистагм, гипер- или гипотонус мышц, парезы и параличи; гемианопсия, вестибулярные нарушения и др.), которая не укладывается в какой-либо четкий синдром, изменчива и исчезает при нормализации осмолярности.
Крайне важен дифференциальный диагноз с отеком мозга во избежание ОШИБОЧНОГО назначения мочегонных ВМЕСТО РЕГИДРАТАЦИИ.
Лечение: восстановление электролитного баланса, выявление и лечение заболеваний, спровоцировавших ГГС, и его осложнений.
Лактатацидоз – метаболический ацидоз с большой анионной разницей (≥10 ммоль/л) и уровнем молочной кислоты в крови > 4 ммоль/л (по некоторым определениям > 2 ммоль/л).
Основная причина – повышенное образование и снижение утилизации лактата и гипоксия.
Клиническая картина: миалгии, не купирующиеся анальгетиками, боли в сердце, не купирующиеся антиангинальными средствами, боли в животе, головные боли, тошнота, рвота, слабость, адинамия, артериальная гипотензия, тахикардия, одышка, впоследствии дыхание Куссмауля, нарушение сознания от сонливости до комы.
Лечение: Уменьшение образования лактата, выведение из организма лактата и метформина, борьба с шоком, гипоксией, ацидозом, электролитными нарушениями, устранение провоцирующих факторов.
На догоспитальном этапе: в/в инфузия 0,9 % раствора NaCl.
В реанимационном отделении или отделении интенсивной терапии: лабораторный и инструментальный мониторинг: проводится, как при ДКА, с более частым мониторированием уровня лактата.
43. Феохромоцитома. Этиология, патогенез, клинические синдромы, диагностика. Дифференциальная диагностика гипертензионного синдрома в подростковом возрасте, лечение.
Феохромоцитома (ФХЦ) – это опухоль мозгового слоя надпочечника, состоящая из хромаффинных клеток, продуцирующая катехоламины (адреналин, норадреналин и дофамин).
!Что должен знать каждый врач:
- Если вовремя НЕ выставлен диагноз и НЕ назначено адекватное лечение – это фатальное заболевание;
- Распространены бессимптомные формы;
- Диагностика: определение норметанефрина, метанефрина в плазме, суточной моче;
- Если диагностирована феохромоцитома, то назначение бета-блокаторов возможно только после достижение альфа-блокирующего эффекта;
- Необходима предоперационная подготовка минимум за 2 недели до операции (профилактика возникновения симпато-адреналового криза на операционном столе).
Этиология:
Большинство ФХЦ являются результатом спорадической мутации, однако в более, чем в 30% случаев опухоль возникает в результате герминальной мутации. По меньшей мере, у 40% детей с ФХЦ выявляется генетическая причина болезни.
Патогенез:
В клетках феохромоцитомы происходит синтез и накопление катехоламинов, как и в нормальных клетках мозгового вещества надпочечников. Выброс катехоламинов может провоцироваться изменениями кровотока, некрозом в ткани опухоли и другими причинами.
Разнообразие адренергического рецепторного аппарата, большое количество органов, в которых он представлен, возможность смешанной опухолевой секреции — это факторы, объясняющие, почему клинические проявления феохромоцитомы, в основе которых лежат столь различные патофизиологические механизмы, чрезвычайно разнообразны.
Изменение чувствительности адренорецепторов, нарушение механизмов инактивации катехоламинов и энергетическое истощение сосудистых миоцитов на фоне повышенного содержания катехоламинов в сосудистом русле может приводить к развитию катехоламинового шока, для которого характерно резко повышенное АД в центральных сосудах (вазоконстрикторный статус) и значительное снижение АД на периферии.
Клинические синдромы:
1) Синдром артериальной гипертензии (пароксизмальный или постоянный). Для классического пароксизма при феохромоцитоме характерна триада симптомов: сердцебиение, головная боль, повышенное потоотделение;
2) Нейропсихический синдром (нервная возбудимость, утомляемость, головные боли, парестезии);
3) Кардиальный синдром (тахикардия, одышка, явления сердечной астмы).
Диагностика:
Заподозрить при вышеупомянутой симптоматике у детей и подтвердить с помощью:
- Определение метилированных производных катехоламинов (метанефрин и норметанефрин) в плазме и суточной моче. Чувствительность и специфичность по 100%.
В плазме циркулируют до 8 часов, а в моче до 1 суток.
- Проведение КТ, МРТ-диагностики. Данные способы диагностики обладают, в нашем случае, обладают низкой чувствительностью и специфичностью. Нативная плотность феохромоцитомы на КТ всегда > 10 HU (ед. Хаунсфилда).
Дифференциальная диагностика гипертензионного синдрома в подростковом возрасте:
Дифференциальная диагностика гипертензивного синдрома в подростковом возрасте сложнее, чем у взрослых, так как причины могут быть разнообразными и не всегда очевидными. Важно исключить как первичную (эссенциальную) гипертензию, так и вторичную, обусловленную различными заболеваниями.
Основные направления дифференциальной диагностики:
1. Первичная (эссенциальная) артериальная гипертензия: это наиболее частая причина повышенного давления у взрослых, но у подростков встречается реже. Часто связана с генетической предрасположенностью, ожирением, малоподвижным образом жизни и нездоровым питанием. Диагноз ставится после исключения всех других возможных причин.
2. Вторичная артериальная гипертензия: это повышенное артериальное давление, вызванное каким-либо заболеванием или состоянием. В подростковом возрасте это наиболее вероятная причина гипертензии.
Необходимо тщательно исследовать следующие возможные причины:
* Заболевания почек: гломерулонефрит, пиелонефрит, поликистоз почек, обструкция мочевыводящих путей. Анализ мочи, УЗИ почек и другие исследования почек необходимы. * Заболевания надпочечников: Гиперальдостеронизм (синдром Конна), феохромоцитома (редкое заболевание надпочечников). Обязательно определение уровня альдостерона, ренина, катехоламинов в крови. * Заболевания эндокринной системы: гипертиреоз, гипотиреоз, акромегалия, синдром Кушинга. Необходимо определение уровня гормонов щитовидной железы, гормона роста и кортизола. * Аномалии почечных артерий: сужение или стеноз почечных артерий может привести к гипертензии. Ангиография почек может подтвердить диагноз. * Апноэ во сне: частые остановки дыхания во время сна могут повышать артериальное давление. Полисомнография может подтвердить диагноз. * Использование лекарственных препаратов: некоторые лекарства, такие как нестероидные противовоспалительные препараты (НПВС), могут повышать артериальное давление. * Коарктация аорты: сужение аорты, приводящее к повышению давления в верхней части тела. Эхокардиография и другие методы визуализации сердца необходимы для диагностики. * Другие причины: стресс, физическая нагрузка, употребление кофеина и алкоголя, могут временно повышать артериальное давление. Эти причины необходимо учитывать, но они не являются истинными заболеваниями.
Лечение:
Основа лечения – хирургическое удаление опухоли, но к этому ещё надо подготовиться, поэтому как только выставлен диагноз «феохромоцитома» необходимо незамедлительно начать проведение предоперационной подготовки (min. 2 недели):
Назначение альфа-блокаторов (целевые значения АД – 120/80 мм.рт.ст., сист. АД более 90 мм.рт.ст. в положении стоя, прием высокосолевой диеты на 2-3 сут (более 5 грамм соли в сутки), прием достаточного количества жидкости);
Назначение бета-блокаторов (после достижения эффекта альфа-блокаторов);
Предоперационная подготовка минимум 2 недели;
Собственно, хирургическая операция, после должной предопер.подготовки.
44. Несахарный диабет. Распространенность, этиология, клиника, дифференциальный диагноз. Лечение.
Несахарный диабет (НД) является гетерогенным клиническим синдромом, в основе которого лежат нарушения секреции антидиуретического гормона (АДГ) или резистентность почек к действию АДГ, или избыточное потребление жидкости. Несахарный диабет проявляется полиурией с низкой осмоляльностью мочи, полидипсией и плохой прибавкой в весе.
Распространенность:
Считается редким заболеванием (примерно 1 случай на 25.000 детей).
Этиология:
Первичный: наследственный, нарушения развития мозга, идиопатический;
Вторичный: травматический (ЧМТ, послеоперационный), опухолевый (опухоли ГМ), воспалительный (аутоиммунный, менингит, энцефалит и д.р.), сосудистый (аневризма, инфаркт, серповидно-клеточная анемия, апоплексия (о_О) гипофиза).
Клиническая картина:
- жажда (полидипсия; количество выпиваемой жидкости колеблется от 3 до 20 литров);
- обильное, учащенное мочеиспускание (полиурия), ночное мочеиспускание (никтурия);
- общая дегидратация (сухость кожи и слизистых оболочек, уменьшение слюно- и потоотделения);
- желудочно-кишечные проявления (постоянная перегрузка водой приводит к растяжению желудка, дегидратация может приводить к снижению секреторной функции желудочно-кишечного тракта и запорам);
- общая слабость, быстрая утомляемость, нарушения сна, в большей части случаев, связаны с необходимостью частого просыпания ночью для мочеиспускания и питья;
- при наличии патологии гипоталамо-гипофизарной области могут наблюдаться симптомы, связанные с вторичным дефицитом гормонов передней доли гипофиза и неврологические нарушения как результат сдавления опухолью структур головного мозга (например, сужение/выпадение полей зрения).
НД проявляется снижением реабсорбции воды в почках и выделением большого количества неконцентрированной мочи, что приводит к дегидратации (дефициту внутриклеточной и внутрисосудистой жидкости), развитию гиперосмоляльности плазмы, активации осморецепторов гипоталамуса и возникновению жажды.
Причиной заболевания служат, как правило, снижение порога чувствительности центра жажды, т.е. пациент чувствует жажду при совершенно нормальной или даже сниженной концентрации электролитов/осмоляльности крови, а также избыточный прием жидкости вследствие компульсивного (маниакального) желания пить, что может наблюдаться при манифестации различных психических расстройств. Объем циркулирующей жидкости в организме у таких пациентов повышен. Разведение крови проявляется снижением уровней электролитов/осмоляльности, что приводит к физиологическому блоку синтеза и секреции АВП и, таким образом, водному диурезу, целью которого является выведение лишней воды, поступившей в организм.
Дифференциальный диагноз:
- Дифференциальная диагностика проводится с первичной (психогенной, дипсогенной) полидипсией, сахарным диабетом, гиперкальциемией, гипокалиемией, постобструктивной уропатией;
- Для дифференциальной диагностики центрального и нефрогенного несахарного диабета рекомендуется проведение теста с десмопрессином: (в его основе проверка чувствительности пациента к действию десмопрессина, т.е. сохранение функциональной активности V2 рецепторов. Тест проводится сразу после окончания пробы с сухоедением, когда достигнут максимум возможности секреции/действия эндогенного АВП (таб. 5). Пациенту дается или 0,1 мг таблетированного десмопрессина под язык до полного рассасывания, или 60 мкг в виде подъязычных лиофилизированых таблеток МЕЛТ, или 10 мкг интраназально в виде спрея. Осмоляльность мочи измеряется до приема десмопрессина и через 2 и 4 часа после. Если прирост осмоляльности мочи относительно величин, достигнутых на фоне дегидратации, составит более 50%, то чувствительность V2 рецепторов почек сохранена и имеется ЦНД, если менее 50%, то ННД. В ходе теста пациенту разрешается пить, но не более 1,5 кратного объема выделенной мочи на пробе с сухоедением).
Лечение:
Медикаментозное: лечение центрального несахарного диабета рекомендуется проводить синтетическим аналогом вазопрессина – десмопрессином.
Основная цель лечения десмопрессином – подбор минимально эффективной дозы препарата для конкретной фармацевтической формы с целью купирования избыточной жажды и полиурии. Не следует считать целью лечения обязательное повышение относительной плотности мочи, особенно в каждой из проб анализа мочи по Зимницкому, поскольку не у всех пациентов с ЦНД на фоне клинической компенсации заболевания при этих анализах достигаются нормальные показатели концентрационной функции почек.
Лечение нефрогенного несахарного диабета проводится с помощью тиазидных диуретиков и нестероидных противовоспалительных средств (НПВС).
При идиопатической форме центрального НД рекомендуется проведение МРТ исследования головного мозга в динамике через 6 мес., 12 мес. и далее ежегодно в течение 5-7 лет после дебюта заболевания.
45. Гипоталамический синдром пубертатного периода. Этиопатогенез. Клинические синдромы. Дифференциальная диагностика. Принципы терапии, прогноз.
Сказали, что этот вопрос убрали
Гипоталамический синдром пубертатного периода (ГСПП) – это патологический симптомокомплекс, выражающийся полигландулярной дисфункцией с нарушением обменных трофических процессов, менструального цикла, нарушениях сердечно-сосудистой, нервной системы и возникающий в результате дисфункции гипоталамуса и сопряженных с ним структур центральной нервной системы в период полового созревания.
Гипоталамическая недостаточность у детей 7-15 лет встречается в 5% случаев, причем 75% ее приходится на препубертатный и пубертатный период. Гипоталамус детей более чувствителен к регуляции по типу обратной связи со стороны половых желез, чем гипоталамус взрослых людей. У детей центр регуляции половой функции в гипофизотропной зоне гипоталамуса находится в тесной анатомической близости от центра регуляции жирового обмена, в процессе роста организма эти центры отдаляются.
Этиопатогенез:
К этиологическим факторам ГСПП относятся психотравмирующие ситуации, черепномозговые травмы (ГСПП может возникнуть через 6 и более месяцев после травмы), менингит, интоксикации, тяжелые или часто повторяющиеся вирусные заболевания (грипп, ОРВИ, корь, герпес), тонзиллярная инфекция и другие очаги латентной инфекции, чрезмерная умственная нагрузка, родовая травма (реализующаяся в виде гипертензионно-гидроцефального синдрома).
В литературе имеются указания на то, что главная роль в возникновении данной патологии принадлежит систематическому перееданию и наследственной предрасположенности к ожирению – гипоталамический синдром возникает вторично. Действительно, чрезмерное высококалорийное питание, неправильный пищевой режим могут приводить к дислипидемии у детей, к стойкому возбуждению центров гипоталамуса, первично контролирующих массу тела. Данные о генетической передаче ожирения во многом противоречивы.
Имеются указания на этиологическую связь между хронической фето-плацентарной недостаточностью, внутриутробными инфекциями, угрожающим прерыванием беременности, гестозом, и развитием в дальнейшем ГСПП.
В развитии ГСПП принимает участие система гипоталамус-гипофиз-яичники-надпочечники и жировая ткань. В ответ на этиологическое воздействие происходит увеличение синтеза и выброса эндорфинов, приводящее к уменьшению выделения дофамина, следствием чего является нарушение циклической (цирхоральной) секреции ЛГ. В результате нарушается процесс фолликулогенеза в яичниках и развивается кистозная атрезия фолликулов. В свою очередь в кистозно атрезирующихся фолликулах нарушается синтез стероидов в сторону уменьшения образования конечного продукта – эстрогенов и накопления его предшественников – андрогенов. Уменьшение эстрогенов по механизму обратной связи вызывает увеличение выделения ЛГ и повышение его базального уровня в крови.
На нарушение регуляции функции яичников оказывает большое влияние избыточная жировая ткань, в которой повышенное количество андрогенов яичникового происхождения интенсивно метаболизируются в эстрогены.
Повышенный уровень экстрагонадных эстрогенов приводит к нарушению чувствительности передней доли гипофиза к люлиберину, что усугубляет нарушение механизма обратной связи и является вторым фактором, определяющим хроническое повышенное выделение ЛГ. Экстрагонадные эстрогены ответственны за развитие гиперпластических процессов в эндометрии и, кроме того, способствуют гиперплазии самих адипоцитов.
В развитии метаболических нарушений важную роль играет нарушение функции надпочечников. Под влиянием повышенного образования эндорфинов увеличивается выделение АКТГ и пролактина, усиливается синтез кортизола, способствующего ожирению и определяющему характер распределения жира. Гиперкортицизм содействует формированию таких симптомов как гипергликемия, гипертензия, появление полос растяжение на коже. Воздействие повышенного уровня андрогенов на яичник проявляется увеличением числа атрезирующихся фолликулов, утолщением и склерозом капсулы и стромы коркового слоя, т.е. формированием поликистозных яичников – морфологического субстрата нарушения менструального цикла и гиперандрогении, что влечет за собой значительные нарушения формирования репродуктивной системы, стойкую ановуляцию и увеличение риска бесплодия в будущем.
Клинические синдромы:
Клиническая картина ГСПП характеризуется наличием ряда синдромов одновременно. Это приводит к полисимптомности висцеральных нарушений, как правило, с наличием вегетативных дисфункций, эндокринной дисгармонии и нарушения метаболизма. Вначале поражение внутренних органов носит функциональный характер, с развитием в последующем дистрофических изменений.
Основные диагностические признаки ГСПП по степени их относительной значимости для скрининговых исследований: ожирение, стрии белые, стрии розовые, гирсутизм, увеличение щитовидной железы, головные боли, субфебрилитет, головокружение и обмороки, повышенная утомляемость, сонливость, потливость, гиперпигментация кожи, повышенный аппетит, колебания АД.
При всем этом подростки имеют абсолютно здоровый вид и часто выглядят старше своих лет и производят мнимое впечатление пышущих здоровьем. В большинстве случаев отличаются высоким ростом. Избыточная масса может достигать 40 кг. Конечности, и верхние, и нижние, отличаются полнотой.
У девочек может проявиться легкая вирилизация, появление растительности на лице и других частях тела по мужскому признаку, окрашивание сосков и малых половых губ в темнокоричневый цвет, чаще всего менструация становится нерегулярной.
Развитие симптоматики отмечается, как правило, в возрасте от 10 до 18 лет, причем чаще заболевание начинается в 11-13 лет.
Диагностика:
Клиническая картина заболевания достаточно характерна. На рентгенограмме черепа в большинстве случаев обнаруживаются признаки внутричерепной гипертензии. Со стороны глазного дна могут выявляться незначительно выраженные изменения в виде ангиопатии сетчатки (при наличии артериальной гипертензии), нарушения регуляции внутриглазного давления.
Экскреция 17-ОКС (в большей степени) и 17-КС с мочой повышена. Секреция АКТГ умеренно повышается, но чаще выявляются нарушение суточной секреции АКТГ и глюкокортикоидов и связывания их белками крови. Содержание СТГ в сыворотке крови в пределах нормы или повышено; уровень ФСГ в сыворотке крови также повышен.
При рентгенологическом исследовании (ретропневмоперитонеум, КТ и МР- томография) и УЗИ выявляются контуры надпочечников нормальной формы и величины.
Дифференциальная диагностика:
Дифференциальную диагностику необходимо проводить с болезнью Иценко-Кушинга, ожирением, синдромом поликистозных яичников (синдром Штейна-Левенталя).
Принципы терапии:
Санация очагов хронической инфекции (тонзиллит, гайморит, отит и др). Субкалорийная диета с достаточным количеством витаминов, липотропных веществ. Применение аноректических препаратов (минифаж, изолипан), глютаминовой кислоты, церебролизина, аминалона, мочегонных (фуросемид и др), а при наличии гипертензии антигипертензивные препараты.
Прогноз:
Урегулирование режима и характера питания бывает достаточно для снижения массы тела больного. Параллельно этому исчезают и признаки заболевания, нормализуется артериальное давление, у девушек восстанавливается нарушенный менструальный цикл.
При своевременной диагностике и достижении целей лечения – благоприятный.
