
- •ПРЕДИСЛОВИЕ
- •ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- •1.1. Основные понятия и определения
- •1.2.1. Моль. Эквивалент и эквивалентные массы
- •1.2.2. Газовые законы
- •1.2.3. Эквивалент. Эквивалентные массы
- •1.2.4. Определение атомных и молекулярных масс
- •1.2.5. Химические формулы. Валентность
- •1.2.6. Структурные и графические формулы
- •1.2.7. Уравнения химических реакций
- •1.2.8. Классификация химических реакций
- •2.1. Строение атома
- •2.1.2. Экспериментальные предпосылки квантовой теории строения атома
- •2.1.3. Квантовый характер света
- •2.2. Волновая теория строения атома
- •2.2.1. Основные положения
- •2.2.2. Квантовые числа
- •2.3. Периодическая система и изменение свойств элементов
- •2.3.2. Изменение свойств элементов в Периодической системе
- •3.1. Основные характеристики химической связи
- •3.1.1. Спектры молекул
- •3.1.2. Магнитные свойства
- •3.2. Современные теории химических связей
- •3.2.2. Ковалентная связь. Теория валентных связей
- •3.2.3. Теория молекулярных орбиталей (MO)
- •3.2.4. Ионные связи и поляризация
- •3.2.5. Теории металлической связи
- •3.2.6. Кристаллические решетки
- •3.3. Водородные связи
- •3.4. Межмолекулярные силы Ван-дер-Ваальса
- •3.5. Комплексные соединения
- •3.5.1. Определения, составные части и классификация
- •3.5.2. Равновесие в растворах комплексных соединений
- •3.5.3. Изомерия комплексных соединений
- •3.5.4. Химическая связь в комплексных соединениях
- •4.1. Определения. Первый закон термодинамики
- •4.2. Тепловые эффекты химических реакций
- •4.2.1. Термохимические уравнения
- •4.2.2. Термохимические расчеты. Закон Гесса и его следствия
- •4.2.3. Тепловые эффекты некоторых превращений
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.4. Химическое равновесие
- •4.4.1. Константа равновесия
- •4.4.2. Свободная энергия и константа равновесия
- •4.4.3. Смещение химического равновесия. Принцип Ле Шателье
- •РАЗДЕЛ 5 ХИМИЧЕСКАЯ КИНЕТИКА
- •5.1. Основные понятия и представления
- •5.2. Зависимость скорости химической реакции от концентрации реагентов
- •5.3. Зависимость скорости от температуры
- •5.4. Катализ
- •РАЗДЕЛ 6. РАСТВОРЫ
- •6.2. Способы выражения концентрации растворов
- •6.4. Свойства разбавленных растворов неэлектролитов
- •6.5. Свойства растворов электролитов
- •6.5.3. Электролитическая диссоциация воды. Водородный показатель
- •6.5.4. Произведение растворимости
- •6.5.5. Гидролиз солей
- •РАЗДЕЛ 7 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •7.1. Окислительно-восстановительные реакции (ОВР)
- •7.1.1. Уравнивание ОВР
- •7.1.2. Типы окислительно-восстановительных реакций
- •7.2. Химические источники электрической энергии
- •7.3. Направление окислительно-восстановительных реакций
- •7.4. Электролиз
- •7.5. Количественные законы электролиза
- •7.6. Использование электрохимических реакций
- •7.7. Коррозия металлов
- •СПИСОК ЛИТЕРАТУРЫ
- •ОГЛАВЛЕНИЕ

1.2.6.Структурные и графические формулы
Ввеществах (молекулярных, ионных, ковалентных, металлических) атомы связаны друг с другом в определённой последовательности,
амежду парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о гео-
метрии связей в веществах частично или полностью отражаются в структурных формулах. В этих формулах связь между атомами изо-
бражают чертой. Например, H2O изображают так: H−O−H; Hg2Cl2: Cl−Hg−Hg−Cl;
HNO2: H−O−N=O.
При изображении структурных формул часто принимают, что электронная валентность совпадает со стехиометрической. Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о связях.
Например, КNO3:
(неправильно) (правильно)
здесьV стх(N) = 5, однако Vē (N) = 4.
Структурные формулы, построенные по стехиометрическим валентностям (Vстх), иногда называются графическими.
Соединения, в которых у всех элементов Vстх действительно совпадает с электронной валентностью (Vē), называют простыми соединениями; к ним относятся только некоторые молекулярные соединения (например, CO2, SO2, SO3, CH4, ClF3 и др.). Соединения, в которых это условие не выполняется, называются сложными. К ним относятся, например, все комплексные соединения, CO, H2O2 и др.
Большинство оксидов, кислот, оснований и солей существуют в виде твердых или жидких соединений с частично ионными связями или в виде растворов, в которых соединения диссоциированы на ионы и которые, в свою очередь, гидратированы. Поэтому даже при совпадении Vстх и Vē графические формулы не соответствуют структуре, а носят формальный, условный характер, показывая, как могли бы соединяться атомы, если бы вещество состояло из молекул, соответствующих формуле.
24
Истинную структурную формулу можно изобразить лишь на основании исследования реальной структуры вещества – экспериментально или теоретически (см. раздел учебников химии «Химическая связь»).
При изображении структурных (графических) формул нужно выполнять следующие простые правила:
1. Число чёрточек, исходящих от каждого атома, равно его ва-
лентности (Vстх = Vē);
2. В обычных кислотах и солях со сложным кислородсодержащим катионом атомы H и Me соединяются с кислотообразующим элементом через кислород
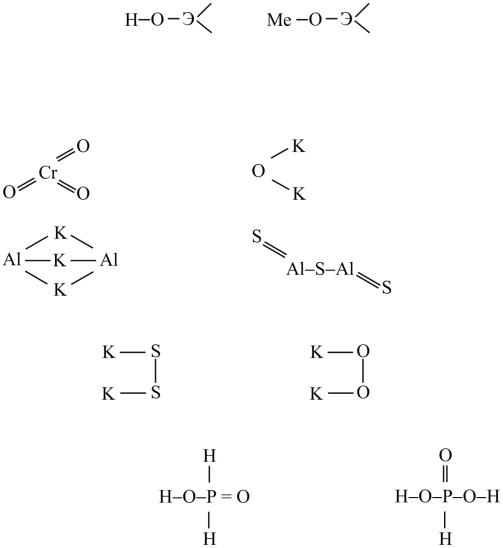
3. Одинаковые атомы не соединяются между собой, не образуют гомоцепей, они соединяются через атомы неметалла:
a) CrO3; |
б) K2O; |
в) Al2S3. |
а) |
|
б) |
в)
или
Правила нарушаются в сложных соединениях, например в пероксо- и персульфо-соединениях:
K2S2: K2O2:
Некоторые кислоты и соли фосфора также являются сложными соединениями.
Кислоты: H3PO2 H3PO3
Пример 19.Изобразить структурную формулу K2SO4.
Решение. Определяем стехиометрические валентности атомов: V(K) = 1; V(S) = 6; V(O) = 2. Изображаем структурную формулу, пользуясь правилами
1−3.
25
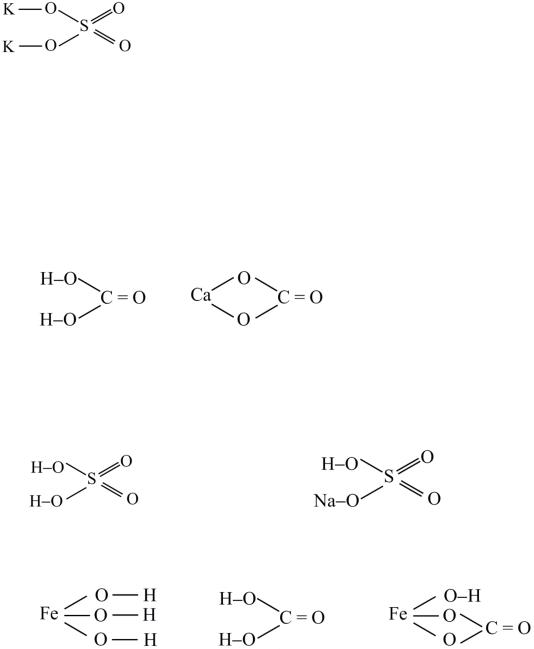
Эта формула – графическая. На самом деле таких молекул не существует (К2SО4 – формульная единица с ионной кристаллической решеткой твердого вещества).
В приведенных примерах углы между связями взяты произвольно. Однако они также могут быть точно указаны и изображены.
Для графического изображения формул солей можно исходить из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности, т. е. один атом водорода заменяется одновалентным металлом, два – двухвалентным, три – трехвалентным и т. д. Например, графическое изображение формулы карбоната кальция (CaCO3) можно представить так:
карбонат кальция – это средняя соль угольной кислоты H2CO3 :
Пример 20. Изобразите графические формулы кислой соли гидросульфата натрия и основной соли карбоната гидроксожелеза (III).
Решение. При составлении графических формул солей нужно отчетливо представлять себе графические формулы кислотных и основных остатков. Кислую соль (NaHSO4) можно представить как продукт замещения одного атома водорода в серной кислоте на атом натрия:
Основную соль (FeOHCO3) можно представить как продукт частичного замещения гидроксогрупп в основании Fe(OH)3 на кислотный остаток угольной кислоты:
1.2.7. Уравнения химических реакций
Химические реакции записывают в виде особых алгебраических уравнений, в которых каждый символ атома или молекулы обозначает атом (молекулу) или один их моль. Знак равенства между реагентами и продуктами отражает закон сохранения массы вещества в химических реакциях и, как следствие, тот факт, что число атомов каждого сорта среди реагентов равно числу таких же атомов среди продуктов. Например, для реакции
26
2Н2 + О2 = 2Н2О
реагенты продукты
это означает, что 2 молекулы Н2 (4 атома Н) реагируют с одной молекулой О2 (2 атома О) и при этом получается 2 молекулы воды, в которых столько же атомов Н (4) и О (2), сколько их было в реагентах. Коэффициенты перед формулами называют стехиометрическими; они относятся ко всем атомам формулы; коэффициент 1 не используется. Кроме того, в химических уравнениях сохраняется заряд; это важно при написании уравнений ионных реакций и полуреакций (см. разд. 6 и 7).
При написании химического уравнения сначала записывают его схему без стехиометрических коэффициентов, например
Н2 + N2 → NH3,
а затем уравнивают его. Общий метод уравнивания заключается в составлении уравнений баланса всех атомов. Для этого записывают химическое уравнение с неизвестными коэффициентами:
х1Н2 + х2N2 = x3NH3,
азатем – алгебраическую систему уравнений баланса по атомам:
1)2х1 = 3х3 (по атомам Н);
2)2х2 = х3 (по атомам N).
Система не имеет определенного решения, так как не хватает одного
уравнения. Решая эту систему, находим, что |
x3 |
= |
2 и |
|
x3 |
= 2. |
|
|
||
|
|
|
x |
3 |
|
x |
|
|
||
|
|
1 |
|
|
2 |
|
|
|
||
х2 |
|
Принимая далее один из коэффициентов |
равным 1 |
(например, |
||||||
= 1 – это и будет третье уравнение системы), найдем, |
что |
х3 = 2 |
||||||||
и |
х1 |
= 3. Таким образом, получим уравнение 3Н2 + N2 |
= 2NH3. |
|
|
|||||
|
|
Если получаются дробные коэффициенты, то их обычно приводят |
||||||||
к наименьшему целому. |
|
|
|
|
|
|
||||
|
|
Другие способы уравнивания будут рассмотрены в разделе 7.1.1. |
||||||||
|
|
Уравнение химической реакции замечательно |
тем, что по |
нему |
||||||
можно найти количества и массы всех реагирующих и получающихся веществ, если известно количество или масса хотя бы одного из них и если реакция протекает нацело.
Пример 21. Рассчитать массу 30%-й соляной кислоты, необходимой для разложения одного кг СаСО3. Определить объем СО2(н.у.), выделяющегося при этом.
Решение. Запишем уравнение реакции:
СаСО3 + 2НСl = CaCl2 + CO2 + H2O.
Из уравнения делаем вывод, что на разложение 1 моль СаСО3 требуется 2 моль кислоты и при этом выделяется 1 моль СО2. Из (1.1) следует: m = n M
27
