
- •ПРЕДИСЛОВИЕ
- •ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- •1.1. Основные понятия и определения
- •1.2.1. Моль. Эквивалент и эквивалентные массы
- •1.2.2. Газовые законы
- •1.2.3. Эквивалент. Эквивалентные массы
- •1.2.4. Определение атомных и молекулярных масс
- •1.2.5. Химические формулы. Валентность
- •1.2.6. Структурные и графические формулы
- •1.2.7. Уравнения химических реакций
- •1.2.8. Классификация химических реакций
- •2.1. Строение атома
- •2.1.2. Экспериментальные предпосылки квантовой теории строения атома
- •2.1.3. Квантовый характер света
- •2.2. Волновая теория строения атома
- •2.2.1. Основные положения
- •2.2.2. Квантовые числа
- •2.3. Периодическая система и изменение свойств элементов
- •2.3.2. Изменение свойств элементов в Периодической системе
- •3.1. Основные характеристики химической связи
- •3.1.1. Спектры молекул
- •3.1.2. Магнитные свойства
- •3.2. Современные теории химических связей
- •3.2.2. Ковалентная связь. Теория валентных связей
- •3.2.3. Теория молекулярных орбиталей (MO)
- •3.2.4. Ионные связи и поляризация
- •3.2.5. Теории металлической связи
- •3.2.6. Кристаллические решетки
- •3.3. Водородные связи
- •3.4. Межмолекулярные силы Ван-дер-Ваальса
- •3.5. Комплексные соединения
- •3.5.1. Определения, составные части и классификация
- •3.5.2. Равновесие в растворах комплексных соединений
- •3.5.3. Изомерия комплексных соединений
- •3.5.4. Химическая связь в комплексных соединениях
- •4.1. Определения. Первый закон термодинамики
- •4.2. Тепловые эффекты химических реакций
- •4.2.1. Термохимические уравнения
- •4.2.2. Термохимические расчеты. Закон Гесса и его следствия
- •4.2.3. Тепловые эффекты некоторых превращений
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.4. Химическое равновесие
- •4.4.1. Константа равновесия
- •4.4.2. Свободная энергия и константа равновесия
- •4.4.3. Смещение химического равновесия. Принцип Ле Шателье
- •РАЗДЕЛ 5 ХИМИЧЕСКАЯ КИНЕТИКА
- •5.1. Основные понятия и представления
- •5.2. Зависимость скорости химической реакции от концентрации реагентов
- •5.3. Зависимость скорости от температуры
- •5.4. Катализ
- •РАЗДЕЛ 6. РАСТВОРЫ
- •6.2. Способы выражения концентрации растворов
- •6.4. Свойства разбавленных растворов неэлектролитов
- •6.5. Свойства растворов электролитов
- •6.5.3. Электролитическая диссоциация воды. Водородный показатель
- •6.5.4. Произведение растворимости
- •6.5.5. Гидролиз солей
- •РАЗДЕЛ 7 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •7.1. Окислительно-восстановительные реакции (ОВР)
- •7.1.1. Уравнивание ОВР
- •7.1.2. Типы окислительно-восстановительных реакций
- •7.2. Химические источники электрической энергии
- •7.3. Направление окислительно-восстановительных реакций
- •7.4. Электролиз
- •7.5. Количественные законы электролиза
- •7.6. Использование электрохимических реакций
- •7.7. Коррозия металлов
- •СПИСОК ЛИТЕРАТУРЫ
- •ОГЛАВЛЕНИЕ
РАЗДЕЛ 5 ХИМИЧЕСКАЯ КИНЕТИКА
5.1. Основные понятия и представления
Термодинамика изучает только состояния систем, она не прослеживает подробно путь реакции, поэтому она определяет лишь потенциальную возможность ее протекания в определенном направлении. В уравнениях термодинамики нет такой величины, как время, поэтому она не может описать скорости процессов. Скорость реакции прямо не связана со значением энергии Гиббса (ΔG). Например, термодинамическая вероятность реакции окисления водорода до воды
Н |
|
+ |
1 |
О |
|
= Н |
О |
|
, |
G0 |
= −237,2 кДж/моль, |
|
2 |
|
2 |
|
2 |
2 |
|
(ж) |
|
298 |
|
значительно выше, чем вероятность реакции нейтрализации с образованием воды
Н+ + ОН− = Н |
О |
(ж) |
; |
G0 |
= −79,9 кДж/моль. |
2 |
|
|
298 |
|
Однако первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает мгновенно.
Кинетика – наука о скоростях и механизмах процессов. Химическая кинетика изучает скорости и механизмы химических реакций.
Скорость химической реакции (Vх.р) измеряется изменением кон-
центрации какого-либо реагента или продукта в единицу времени:
C (t → 0) = dC |
, |
моль |
или |
1 |
|
. |
(5.1) |
||
л с |
см3 |
с |
|||||||
t |
dt |
|
|
|
|
||||
При этом скорости изменения концентраций всех продуктов и реагентов однозначно связаны между собой. Для реакции
аА+ bВ +…= сС + dD +…
− |
1 dCA = − |
1 dCB = …= |
1 |
dCC = |
1 |
|
dCD |
= … |
(5.2) |
|
a dt |
b dt |
C dt |
d dt |
|
||||
Под механизмом реакции в кинетике понимают путь реакции, то есть подробное изменение координат всех частиц в ее ходе, сближение и удаление атомов и радикалов, повороты молекул и их частей, разрыв и образование новых химических связей. В ходе изменения координат атомов происходит изменение энергии.
Механизм химической реакции удобно описывать с помощью кривых потенциальной энергии (КПЭ) в координатах энергия (Е) – путь реакции (q); (на самом деле реакция описывается поверхностью по-
133
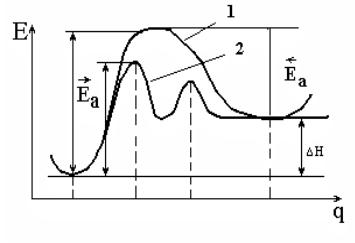
тенциальной энергии – ППЭ в многомерном пространстве координат всех атомов системы).
На рис. 5.1 показана схематично КПЭ для реакции реагент → продукт (кривая 1). Видно, что ход реакции описан максимально подробно; на КПЭ есть минимумы (реагенты и продукты) и максимум – для промежуточного переходного состояния. Такие максимумы – энергетические барьеры (Еа) на пути реакции, причем они разные для прямой и обратной реакции, так что
Ea − Ea = Hреакции. |
(5.3) |
Здесь Еа – величины энергетических барьеров, которые называют энергиями активации. Это выражение дает связь между кинетикой (Еа – кинетический параметр) и термодинамикой ( Н) реакции.
Ключевым утверждением химической кинетики является положение о том, что реакции происходят в результате столкновений атомов или молекул реагентов; часть столкновений приводит к реакции.
Кривая 1, изображенная на рис. 5.1, относится к случаю простой (элементарной) реакции, то есть реакции, которая проходит в одно столкновение и в которой не образуются промежуточные устойчивые соединения. Кривая 2 соответствует сложной реакции, протекающей через две стадии (два барьера) и через один промежуточный устойчивый продукт (минимум в середине кривой).
Рис. 5.1. Кривая потенциальной энергии для элементарной (1) и сложной (2) химической реакции
На скорость реакции влияют многие факторы: концентрация реагентов, температура, давление, катализаторы, внешние воздействия, например излучения и др.
134
5.2. Зависимость скорости химической реакции от концентрации реагентов
Так как скорость химической реакции зависит от столкновений, а количество столкновений в единице объема, очевидно, пропорционально концентрации сталкивающихся молекул, то можно предположить, что скорость реакции пропорциональна концентрациям реагентов, то есть для необратимой простой реакции
аА+ bВ +…= сС + dD +… |
|
V = k[A]a [B]b |
(5.4) |
(закон действующих масс для кинетики).
Здесь k – константа скорости, то есть скорость реакции при
[A] = [B] = 1 моль/л.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновении участвуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д. Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а и b (они меньше их). В этом случае кинетическое уравнение записывается:
V = k [A]α [B]β. |
(5.5) |
В других случаях имеют место более сложные уравнения. Например, для сложной (цепной) реакции
H2 + Br2 = 2HBr
V = |
d [HBr] |
= |
k[H2 ] [Br2 ]1/2 |
|
|||
dt |
|
|
. |
(5.6) |
|||
1+ |
k′[HBr] |
||||||
|
|
|
[Br2 ] |
|
|
|
|
Уравнения типа (5.4)–(5.6) называются кинетическими уравнения-
ми химических реакций.
Коэффициенты а и b в уравнении (5.4) носят название «молекулярность» реакции по веществу А и В, соответственно; сумма (а + b) – суммарная (общая) молекулярность простой реакции. Понятие «молекулярность» применимо только к простой реакции. Вычисления и наблюдения показывают, что (а + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
135

Коэффициенты α и β в уравнении (5.5) носят название «частный порядок» реакции по веществу А и В, соответственно, а сумма (α + β) – общий порядок реакции. Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю. Порядок и молекулярность не всегда совпадают и в случае простой реакции; если, например, концентрация одного из реагентов много больше, чем других, то скорость практически не зависит от этой концентрации и, хотя в реакции участвуют все молекулы, ее порядок будет меньше молекулярности. На этом основано нахождение порядков реакций по веществам – метод понижения порядка реакции.
Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов, направления реакции (природы продуктов) и от температуры. Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., α, β,...)
k = |
V |
|
[A]α [B]β . |
(5.7) |
Как видно из этого выражения, размерность k зависит от порядка реакции:
для реакции первого порядка (α + β +... = 1) – с−1;
для реакции второго порядка – л · с−1·моль−1; для реакции третьего порядка – л2 · с−1 · моль−2 .
Особенности кинетики гетерогенных реакций. Гетерогенные ре-
акции идут на поверхности раздела фаз, поэтому особенностью кинетики этих реакций является влияние площади реакционной поверхности (S) на скорость реакции, при этом константа скорости k = k′ S.
Если в реакции участвуют твердые или жидкие вещества (не растворы), то их концентрация в уравнении (5.5), как и в ЗДМ для равно весия, не учитывается. Например, для реакции
CaOк + CO2(г) = CaCO3к
кинетическое уравнение имеет вид
V = k [CO2 ]a = k′S [CO2 ]a ,
а для реакции
CaOк + H2Oж = Ca(OH)2к |
V = k = k′S. |
136
