
все Тесты химия КТ
.docxВопрос: Расположите в порядке возрастания осмотического давления 0,2М растворы KCN, (NH4)2SO4, К3РО4,Al2(SO4)3 учитывая, что кажущаяся степень диссоциации этих солей примерно одинакова. 1. KCN, К3РО4,(NH4)2SO4, Al2(SO4)3 2. KCN,(NH4)2SO4,К3РО4,Al2(SO4)3 3. Al2(SO4)3,К3РО4,(NH4)2SO4, KCN 4. Al2(SO4)3,(NH4)2SO4,К3РО4,KCN 5. (NH4)2SO4,Al2(SO4)3, К3РО4, KCN Ответ: 2 Правильно!

Вопрос: В 1000 г воды растворено 0,1 моля KCl. Считая диссоциацию соли полной, определить температуру замерзания раствора, если Ккр.= 1,86. 1. -0,186°С 2. -0,37°С 3. -0,56°С 4. -1,86°С 5. 0,186°С Ответ: 3 Неправильно!
Вопрос: Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,86 °С, тогда как чистый эфир кипит при 35,60 °С. Определить молекулярную массу растворенного вещества. 1. 12,8 г/моль 2. 1,3 г/моль 3. 64 г/моль 4. 128,2 г/моль 5. 1282 г/моль Ответ: 4 Правильно!
Вопрос: Определить давление пара раствора, содержащего 4 г NaOH (μ = 40) в 180 г воды при 100°С, если кажущаяся степень диссоциации NaOH составляет 80%. 1. 99,5 кПа 2. 103,1 кПа 3. 99,8 кПа 4. 102,1 кПа 5. 101,3 кПа Ответ: 1 Правильно!
Вопрос: Вычислить осмотическое давление 0,04%-ного раствора НCl при 37°С, при полной диссоциации НCl. Плотность раствора принять равной единице. 1. 596,0 кПа 2. 59,6 кПа 3. 29,8 кПа 4. 68,4 кПа 5. 94,5 кПа Ответ: 2 Правильно!
Вопрос: Укажите формулы амфотерных оксидов 1. ZnO 2. Na2O 3. Al2O3 4. CO2 5. N2O Ответ: 13 Правильно!
Вопрос: Укажите формулу кислотного оксида 1. NO 2. Na2O3 3. CO2 4. Cs2O 5. CO Ответ: 3 Правильно!
Вопрос: Укажите оксид, не реагирующий с PbO 1. Li2O 2. N2O5 3. CO2 4. CO 5. P2O3 Ответ: 1 Неправильно!
Вопрос: Укажите формулу метафосфорной кислоты. 1. HPO2 2. H3PO4 3. HPO3 4. H4P2O7 5. H3PO3 Ответ: 3 Правильно!
Вопрос: Укажите название солей хлорноватистой кислоты. 1. хлораты 2. хлориты 3. хлориды 4. гипохлориты 5. перхлораты Ответ: 4 Правильно!
Вопрос: Укажите схему суммарной диссоциации пирофосфорной кислоты. 1. H4P2O7 ⇄ H+ + H3P2O72- 2. H4P2O7 ⇄ 2H+ + H2P2O72- 3. H4P2O7 ⇄ 4H+ + P2O74- 4. H3PO4 ⇄ 3H+ + PO43- 5. HPO3 ⇄ H+ + PO3- Ответ: 1 Неправильно!
Вопрос: Укажите вещество, усиливающее диссоциацию гидроксида фосфора (V). 1. HCl 2. NaCl 3. Na2SO4 4. NaOH 5. H2O Ответ: 4 Правильно!
Вопрос: Укажите группу формул, соответствующих следующим солям: гипохлорит натрия; перманганат калия; хлорит кальция. 1. Ca(ClO)2; CaOCl2; K2MnO4 2. NaClO3; KMnO4; CaSO4 3. KClO3; NaClO2; KMnO4 4. NaClO4; KMnO4; CaSO3 5. NaClO; KMnO4; Ca(ClO2)2 Ответ: 5 Правильно!
Вопрос:
Укажите
формулу метаоловянной кислоты
1.  2.
2.  3.
H - O - Sn - O - H
4.
3.
H - O - Sn - O - H
4.  5.
H - O - Sn ═ O
Ответ: 2
Правильно!
5.
H - O - Sn ═ O
Ответ: 2
Правильно!
Вопрос: Укажите формулу средней (нормальной) соли 1. K2Cr2O7 2. KHCr2O7 3. KHS 4. CaOHCl 5. KAl(SO4)2 Ответ: 3 Неправильно!
Вопрос: Укажите формулу кислой соли 1. Na2CrO4 2. MgClNO3 3. KAl(SO4)2 4. AlОHSO4 5. NaHCrO4 Ответ: 5 Правильно!
Вопрос: Укажите формулу основной соли 1. K2SO4 2. KAl(SO4)2 3. KClNO3 4. CaOHNO3 5. Ca(HS)2 Ответ: 4 Правильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить основную соль
1. ![]() 2.
2. ![]() 3.
3. ![]() 4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 5
Неправильно!
4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 5
Неправильно!
Вопрос: Укажите реакцию, в результате которой можно получить кислую соль 1. 2. 3. 4. H2SO4 + Ba(OH)2 → 5. CoSO4 + NH4OH → Ответ: 4 Неправильно!
Вопрос: Укажите формулу сульфата гидроксокобальта (II) 1. CoSO4 2. Co(HS)2 3. (CoOH)2SO4 4. CoOHCl 5. [Co(NH3)6]SO4 Ответ: 1 Неправильно!
Вопрос: Для последовательного осуществления превращений по схеме SO2 → H2SO3 → BaSO3 → Ba(OH)2 → Ba(H2PO4)2 необходимы вещества ____ 1. H2SO4; H2O; SO3; H3PO4 2. H2;KOH; ВaCl2;H3PO4(недостаток.) 3. H2О; ВаO; NaOH;H3PO4(избыток.) 4. SO3;О2; КОН; H3PO4(избыток.) Ответ: 3 Правильно!
Вопрос: С помощью какого реагента можно отличить в растворах KCl и ZnCl2 1. HNO3 2. CaCl2 3. AgNO3 4. BaCl2 5. H2S Ответ: 3 Неправильно!
Вопрос: Константа диссоциации одноосновной кислоты равна 1•10–6. Определить концентрацию раствора кислоты, pH которого равен 6. 1. 1•10–12 моль/л 2. 1•10–6 моль/л 3. 1•10–18 моль/л 4. 6•10–6 моль/л 5. 6•106 моль/л Ответ: 2 Правильно!
Вопрос: Определить эффективную концентрацию ионов NH4+ в 0,1н растворе, если кажущаяся степень диссоциации NH4Сl равна 85%. 1. 0,17 моль-ион/л 2. 0,34 моль-ион/л 3. 1,7 моль-ион/л 4. 0,085 моль-ион/л 5. 0,85 моль-ион/л Ответ: 4 Правильно!
Вопрос: Определить гидроксильный показатель pОH в 0,01М растворе NН4OH при α = 0,0001. 1. 6 2. 3 3. 2 4. 10 5. 8 Ответ: 2 Неправильно!
Вопрос: Определить молярную концентрацию раствора HCN pOH которого составляет 10, а степень диссоциации 2,5%. 1. 4·10–8 моль/л 2. 0,4 моль/л 3. 4·10–2 моль/л 4. 2·10–6 моль/л Ответ: 3 Неправильно!
Вопрос: Вычислить произведение растворимости гидроксида магния при 18℃ , если его растворимость при этой температуре равна 1,7·10–4 моль/л. 1. 1,7•10–4 2. 3,4•10–4 3. 1,96·10–11 4. 4,08•10−3 5. 5,78•10−3 Ответ: 3 Правильно!
Вопрос: Закончите предложение: при экзотермических реакциях … 1. тепло поглощается и ∆ Н˚ р < 0 2. тепло выделяется и ∆ Н˚ р > 0 3. тепло поглощается и ∆ Н˚ р > 0 4. тепло выделяется и ∆ Н˚ р < 0 Ответ: 4 Правильно!
Вопрос: Определите знак изменения энтропии ∆S0 в реакции 2H2S(г) + 3O2(г) = 2H2O(ж) + 2SO2(г) 1. ∆S > 0 2. ∆S = 0 3. ∆S < 0 4. ∆S ≤ 0 Ответ: 3 Правильно!
Вопрос: Выражением скорости химического процессса, протекающего по уравнению CO2(г) + C(т) = 2CO(г) 1. V = K[CO2] 2. V = K[CO2][C] 3. V = K[CO]2 4. V = K[C] Ответ: 2 Неправильно!
Вопрос:
Выражение
константы равновесия для обратимой
реакции Cl2 +
H2O
↔ H+ +
Cl– +
HClO следующее…
1. ![]() 2.
2. ![]() 3.
3. ![]() 4.
4. ![]() Ответ: 4
Неправильно!
Ответ: 4
Неправильно!
Вопрос: Для приготовления 5%-ного раствора в 100 г воды следует растворить ……..г КСl 1. 15,06 2. 5,26 3. 10,52 4. 1,56 Ответ: 2 Правильно!
Вопрос:
Уравнение
Вант-Гоффа , применимого для электролита,
имеет вид…
1. ![]() 2.
Δtкип =
Kэб m
3.
Pосм =
iCRT
4.
Pосм =
CRT
Ответ: 3
Правильно!
2.
Δtкип =
Kэб m
3.
Pосм =
iCRT
4.
Pосм =
CRT
Ответ: 3
Правильно!
Вопрос: Укажите, гидролиз какой из перечисленных солей, приводит к образованию основной соли: 1. K3PO4 2. ZnCl2 3. (NH4)2S 4. Cr2(CO3)3 Ответ: 2 Правильно!
Вопрос: ПР((Co(OH)2) = 2·10–16. Растворимость этого гидроксида ( в моль/л ) составляет…. 1. 3,8·10–9 2. 1,8·10–7 3. 1,8·10–8 4. 3,7·10–6 Ответ: 3 Неправильно!
Вопрос: Сколько граммов медного купороса CuSO4∙5H2O нужно взять для приготовления 2 л 0,1 .н раствора? 1. 50 г 2. 32 г 3. 5,0 г 4. 25 г 5. 16 г Ответ: 5 Неправильно!
Вопрос: Определить массу сульфата натрия, необходимую для приготовления 100 мл 2 н раствора. 1. 28,4 г 2. 14,2 г 3. 7,1 г 4. 284 г 5. 142 г Ответ: 2 Правильно!
Вопрос: Вычислить процентную концентрацию 8 н. раствора HNO3, плотность которого 1,26 г/мл. 1. 50,4% 2. 40,0% 3. 25,2% 4. 20,0% 5. 60,0% Ответ: 2 Правильно!
Вопрос: Сколько граммов 2 н. раствора хлорида натрия (ρ = 1,4 г/мл) необходимо для приготовления 200 г 5,85% раствора? 1. 280 г 2. 70 г 3. 100 г 4. 50 г 5. 140 г Ответ: 5 Правильно!
Вопрос: На нейтрализацию 20мл 5М раствора гидроксида натрия израсходовано 50мл раствора серной кислоты. Вычислить молярность раствора серной кислоты. 1. 2М 2. 4М 3. 1М 4. 0,5М 5. 3М Ответ: 4 Неправильно!
Вопрос: При сжигании угля образовалось 22 г СО2 , при этом выделилось 196,75 кДж тепла (ΔНр = – 197,84 кДж). Теплота образования углекислого газа(в кДж/моль) равна: 1. 395,68 2. – 197,84 3. 197,84 4. –393,50 Ответ: 1 Неправильно!
Вопрос: Вычислите теплоту образования SO3(г), если при сгорании 16 г серы выделяется 197,7 кДж тепла. 1. 395,8 кДж./моль 2. –395,8 кДж./моль 3. 395,8 Дж./моль 4. – 197,9 кДж/моль Ответ: 1 Неправильно!
Вопрос: Тепловой эффект реакции С(графит) + 2N2О(г) = СО2 + N2 равен: –557,5 кДж. Вычисленная теплота образования N2О(г) равна….. (ΔH0 СО2(г)= – 393,5 кДж/моль) 1. 82,0 кДж/моль 2. –82,0 кДж/моль 3. 164,0 кДж/моль 4. – 164 кДж/моль Ответ: 1 Правильно!
Вопрос: Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и НCl. При использования 10 л аммиака (н.у.) тепловой эффект ΔH0 (в кДж) , рассчитанный по этой реакции равен:….. если: (ΔH0NН3(г) = – 46,2 кДж/моль, ΔH0 НCl(г) = – 92,3кДж/моль, ΔH0 NН4Cl(к)= – 314,2 кДж/моль) 1. 783,6 2. – 783,6 3. – 78,36 4. 78,36 Ответ: 4 Неправильно!
Вопрос: Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Тепловой эффект ΔH0 (в кДж) этой реакции при получении 67, 2 л метана (н.у.) составляет… (если ΔH0СН4 (г)= – 74,81 кДж/моль, ΔH0СО(г) = – 110,52кДж/моль, ΔH0Н2О(г) = – 250,37 кДж/моль) 1. 338,94 2. 169,47 3. -338,94 4. -169,47 Ответ: 3 Неправильно!
Вопрос:
Вычислить
энтальпию образования CaSiO3 (ΔH0CaSiO3)
по реакции: SiO2(к)
+ CaO(к) = CaSiO3(к)
+ 87,9 кДж (ΔH0р =
–87,9 кДж), если известны следующие
данные:
 1.
1581
2.
-1581
3.
-791
4.
791
Ответ: 2
Правильно!
1.
1581
2.
-1581
3.
-791
4.
791
Ответ: 2
Правильно!
Вопрос: Вычислите значения ΔH0 (в кДж) для протекающих в организме реакций превращения глюкозы: а) С6Н12О6(к) = 2С2Н5ОН(ж) + 2СО2(г); б) С6Н12О6(к) = 6О2(г) + 6CO2(г) + 6H2O(г), если известно, что теплота образования С6Н12О6(ж) равна – 1273,0 кДж/моль, а С2Н5ОН(ж): –277,6 кДж/моль. 1. а) – 69,2; б) – 2803 2. а) + 69,2; б) – 1803 3. а) + 75,2; б) – 2803 4. а) – 69,2; б) + 2803 Ответ: 4 Неправильно!
Вопрос:
Изменение
энтропии для реакции, протекающей по
уравнению 2СН4(г)
= С2Н2(г)
+ 3Н2(г),
составляет:
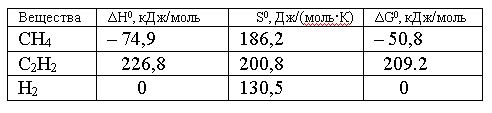 1.
–220,21
2.
110,10
3.
-110,10
4.
220,21
Ответ: 4
Правильно!
1.
–220,21
2.
110,10
3.
-110,10
4.
220,21
Ответ: 4
Правильно!
Вопрос:
Изменение
энтропии для реакции, протекающей по
уравнению N2(г)
+ 3H2(г)
= 2NH3(г),
составляет:
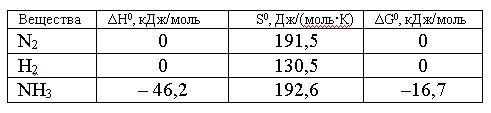 1.
198,26
2.
-99,13
3.
-198,26
4.
99,13
Ответ: 3
Правильно!
1.
198,26
2.
-99,13
3.
-198,26
4.
99,13
Ответ: 3
Правильно!
Вопрос:
При
какой температуре наступит равновесие
системы СН4(г)
+ СО2(г)
= 2СО(г); ΔH0 =
+247,37 кДж.
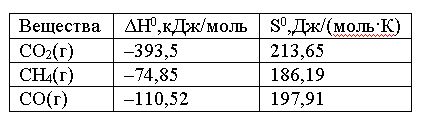 1.
≈ 1225 К
2.
≈ 961,9 К
3.
≈ – 961,9 К
4.
≈ 961,9 °C
Ответ: 2
Правильно!
1.
≈ 1225 К
2.
≈ 961,9 К
3.
≈ – 961,9 К
4.
≈ 961,9 °C
Ответ: 2
Правильно!
Вопрос:
Вычислите,
при какой температуре начнется диссоциация
пентахлорида фосфора, протекающая по
уравнению:
PCl5(к)
= PCl3(к)
+ Cl2(г);
ΔH0 =
+ 92,59 кДж.
 1.
∼
509°C
2.
∼
–1018 K
3.
∼
509 K
4.
∼
–1018°C
Ответ: 3
Правильно!
1.
∼
509°C
2.
∼
–1018 K
3.
∼
509 K
4.
∼
–1018°C
Ответ: 3
Правильно!
Вопрос: При 00С теплота плавления льда (Q) равна 6009,48 Дж/моль. Изменение энтропии в процессе плавления (ΔS) составляет: 1. –22,01 2. 44,02 3. 22,01 4. –44,02 Ответ: 2 Неправильно!
Вопрос:
Вычислить
ΔG0 реакции
СаСО3(к)
= СаО(к) + СО2(г)
и
сделать вывод о возможности ее
самопроизвольного протекания при
10000С,
если известны следующие
данные:
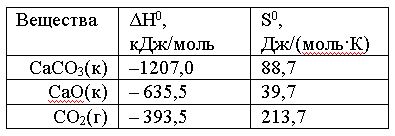 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
22,01; реакция невозможна
2.
–31,66; реакция возможна
3.
–22,01; реакция возможна
4.
31,66; реакция возможна
Ответ: 2
Правильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
22,01; реакция невозможна
2.
–31,66; реакция возможна
3.
–22,01; реакция возможна
4.
31,66; реакция возможна
Ответ: 2
Правильно!
Вопрос:
Вычислить
ΔG0 реакции
СаСО3(к)
= СаО(к) + СО2(г)
и
сделать вывод о возможности ее
самопроизвольного протекания при 250С,
если известны следующие данные:
 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
–177,95 < 0; реакция возможна
2.
–76,93 < 0; реакция возможна
3.
76,93 < 0; реакция возможна
4.
177,95 >0; реакция невозможна
Ответ: 4
Правильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
–177,95 < 0; реакция возможна
2.
–76,93 < 0; реакция возможна
3.
76,93 < 0; реакция возможна
4.
177,95 >0; реакция невозможна
Ответ: 4
Правильно!
Вопрос:
Вычислить
ΔG0 реакции
Cu2S(к)
+ 2Cu2O(к)
= 6Cu(к) + SO2(г)
и
сделать вывод о возможности ее
самопроизвольного протекания при 250С,
если известны следующие
данные:
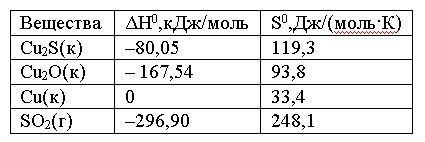 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
76,63; реакция не протекает
2.
–76,63; реакция возможна
3.
172,5; реакция возможна
4.
–172,5; реакция невозможна
Ответ: 1
Правильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
76,63; реакция не протекает
2.
–76,63; реакция возможна
3.
172,5; реакция возможна
4.
–172,5; реакция невозможна
Ответ: 1
Правильно!
Вопрос:
Вычислить
ΔG0 реакции
Cu2S(к)
+ 2Cu2O(к)
= 6Cu(к) + SO2(г)
и
сделать вывод о возможности ее
самопроизвольного протекания при
5000 С,
если известны следующие
данные:
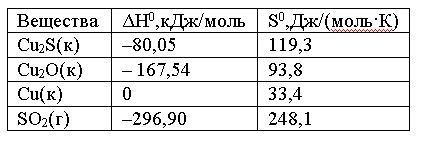 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
–8,46; реакция возможна
2.
203,8; реакция не протекает
3.
8,46 кДж; реакция не протекает
4.
–203,8; реакция возможна
Ответ: 4
Неправильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
–8,46; реакция возможна
2.
203,8; реакция не протекает
3.
8,46 кДж; реакция не протекает
4.
–203,8; реакция возможна
Ответ: 4
Неправильно!
Вопрос:
Вычислить
ΔG0 реакции
Cu2S(к)
+ 2Cu2O(к)
= 6Cu(к) + SO2(г)
и
сделать вывод о возможности ее
самопроизвольного протекания при
20000С,
если известны следующие
данные:
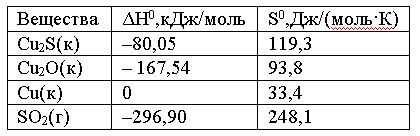 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
508 > 0; реакция невозможна
2.
–508 > 0; реакция возможна
3.
–76,63; реакция возможна
4.
–203,88 < 0; реакция возможна
Ответ: 4
Правильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
508 > 0; реакция невозможна
2.
–508 > 0; реакция возможна
3.
–76,63; реакция возможна
4.
–203,88 < 0; реакция возможна
Ответ: 4
Правильно!
Вопрос:
Вычислите
ΔG0 реакции
ТiO2(к)
+ 2C(к) = Ti(к) + 2CO(г)
и сделайте вывод
о возможности ее самопроизвольного
протекания при 10000 С,
если известны следующие
данные:
 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
245,1 < 0; реакция возможна
2.
245,1 > 0; реакция невозможна
3.
–203,88 < 0; реакция возможна
4.
–245,1 < 0; реакция возможна
Ответ: 2
Неправильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь
1.
245,1 < 0; реакция возможна
2.
245,1 > 0; реакция невозможна
3.
–203,88 < 0; реакция возможна
4.
–245,1 < 0; реакция возможна
Ответ: 2
Неправильно!
Вопрос:
Вычислите
ΔG0 реакции
ТiO2(к)
+ 2C(к) = Ti(к) + 2CO(г)
и сделайте вывод
о возможности ее самопроизвольного
протекания при 30000С,
если известны следующие
данные:
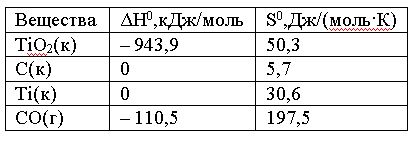 Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь.
1.
508 > 0; реакция возможна
2.
508 > 0; реакция невозможна
3.
245,1 < 0; реакция возможна
4.
245,1 > 0; реакция невозможна
Ответ: 3
Неправильно!
Зависимостью
ΔH0 и
ΔS0 от
температуры пренебречь.
1.
508 > 0; реакция возможна
2.
508 > 0; реакция невозможна
3.
245,1 < 0; реакция возможна
4.
245,1 > 0; реакция невозможна
Ответ: 3
Неправильно!
Вопрос: Укажите уравнение Гиббса: 1. ΔF0 = ΔU0 – TΔS0 2. ΔG0 = ΔH0 − TΔS0 3. ΔH0 = ΔU + PΔV 4. ΔS0 = ΔH0 / T Ответ: 2 Правильно!
Вопрос: Формула, по которой, используя следствие из закона Гесса, можно рассчитать ΔS0 реакции: 1. ΔSр = Σ Sпродуктов – Σ S исходных 2. ΔG0 = ΔH0 − TΔS0 3. ΔS0 = ΔH0 /T 4. ΔF0 = ΔU0 – TΔS0 Ответ: 3 Неправильно!
Вопрос: Размерность энтропии S: 1. ккал/(град·моль) или Дж/(К· моль) 2. кал/(град·моль) или кДж/(К· моль) 3. кал/(град·моль) или Дж/(К· моль) 4. ккал/(град·моль) или кДж/(К· моль) Ответ: 2 Неправильно!
Вопрос: Формулы для выражения I закона термодинамики а) при Р- const и б) V=const имеют вид: 1. а) QР = ΔU+ PΔV; б) Qv=ΔU+ PΔV 2. а) QР = ΔH0 − TΔS0; б) Qv=ΔU+ PΔV 3. а) QР = ΔU + PΔV; б) Qv=ΔU– PΔV 4. а) QР = ΔU– PΔV; б) Qv=ΔU– PΔV Ответ: 3 Неправильно!
Вопрос: а) Формула для выражения свободной энергии Гельмгольца имеет вид…. б) условия применения этого уравнения 1. а) ΔF0 = ΔU0 – TΔS0; б) ( Р = const) 2. а) ΔG0 = ΔH0 − TΔS0 ; б) ( Р = const) 3. а) ΔG0 = ΔH0 − TΔS0 ; б) (V = const) 4. а) ΔF0 = ΔU0 – TΔS0; б) ( V = const) Ответ: 4 Правильно!
Вопрос:
Формула
Больцмана имеет вид….
1. 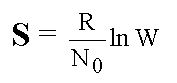 2.
ΔF0 =
ΔU0 –
TΔS0
3.
ΔS0 =
ΔH0 /T
4.
ΔG0 =
ΔH0 −
TΔS0
Ответ: 1
Правильно!
2.
ΔF0 =
ΔU0 –
TΔS0
3.
ΔS0 =
ΔH0 /T
4.
ΔG0 =
ΔH0 −
TΔS0
Ответ: 1
Правильно!
Вопрос: В чем состоит принцип Бертло и всегда ли он справедлив? 1. Критерием выгодности протекания процесса является тепловой эффект реакции; не справедлив при высоких температурах 2. Все системы самопроизвольно стремятся к минимуму ΔH, но максимуму S, справедлив при высоких температурах 3. Мерой «химического сродства» является величина S, справедлив при высоких температурах 4. Критерием выгодности протекания процесса является тепловой эффект реакции; не справедлив при любых температурах Ответ: 3 Неправильно!
