
- •Перенесення фосфатної групи із ФЕП на АДФ
- •99. Чому цикл Кребса називають амфіболічним шляхом?
- •105. Якщо в хворого в сечі виявлено високий вміст цитруліну, то «недостатність» якого ензиму має місце? Загальна характеристика біохімічних процесів (порушення якого метаболічного шляху) за цієї патології.
- •Цитрулін є одним із проміжних метаболітів оринітинового циклу синтезу сечовини (2-га реакція). Збільшення концентрації цитруліну в крові і сечі вказує на порушення синтезу сечовини в орнітиновому циклі (блок на рівні аргініносукцинату)
- •111. Ознаками якого рецесивного спадкового захворювання є, наприклад: підвищений цукор у крові, збільшені в розмірі печінка та селезінка, катаракта кришталика в дитини? Загальна характеристика біохімічних процесів за цього захворювання.
- •117. Яких імуноглобулінів (IgA, IgD, IgE, IgG, IgM) є більше у молозиві корови?
- •120. Чи відбувається активно біосинтез триацилгліцеролів у печінці, кишечнику, в лактуючій молочній залозі та в жировій тканині? Загальна характеристика.
2. Чи можливий транспорт іонів через мембрани і яким чином?
Транспорт іонів через мембрани відбувається за механізмами пасивного і активного транспорту. Пасивний транспорт – це перенесення речовини за градієнтом концентрації без енергетичних витрат; він поділяється на полегшену дифузію (наприклад, іонні канали на мембранах нервових і м’язових клітин для транспорту К+, Ca2+, Na+) і обмінну дифузію – одні йони обмінюються на інші, рухаючись за градієнтом концентрації (наприклад обмін Na+ на K+). Активний транспорт – перенос речовин проти градієнта концентрації або електрохімічного градієнта з витратою енергії. Він буває уніпортний, симпортний (транспорт однієї речовини за градієнтом концентрації іншої ) та антипортний (транспорт градієнту однієї речовини проти градієнту концентрації іншої).Вільний, гідратований та іммобілізований стан води в організмі.
5. Вільний, гідратований та іммобілізований стан води в організмі
Між різними видами води існує динамічна рівновага.
Вільна вода – це міжклітинна вода у вільному стані, яка приймає участь у доставці поживних речовин і видаленні продуктів обміну.
Гідратаційна вода – це вода, яка входить до складу міцел колоїдних часточок і приймає участь в утворенні гідратаційних оболонок. 10-80 % такої води зв’язують білки.
Іммобілізована вода – це вода внутрішнього середовища клітин, чиї молекули розміщуються між мембранами, волокнистими структурами. Така вода розчиняє багато речовин і легко бере участь у реакціях.
8. Всмоктування води, водний баланс. Загальна характеристика проміжного і кінцевого обміну води.
Вода, яка поступає у шлунково-кишковий тракт, у результаті дифузії і осмосу (частково піноцитозу й активного транспортування) разом з перетравленими речовинами проникає через клітини епітелію слизових оболонок у міжклітинний простір, міжклітинну рідину. З міжклітинної рідини вода проходить через венозну частину мікроцикруляторного русла у вени, далі через брижі, ворітну вену і печінку, та зрештою потрапляє у велике коло кровообігу.
Водний баланс - це відношення кількості спожитої води до кількості виділеної. Позитивний баланс води характерний для організмів, які ростуть; баланс води від’ємний у старіючих організмів.
Проміжний обмін води характеризується транспортом води в різні органи, тканини і клітини організму за допомогою таких білків крові як альбуміни і глобуліни.
Кінцевий обмін води характеризується остаточним виділенням води з організму з сечею (до 50%), потом і видихуваним повітрям (до 35%), з калом (до 15%).
11. Загальнобіологічні властивості вітамінів
Вітаміни є незамінними факторами харчування, оскільки в організмі людини вони не синтезуються, або синтезуються в невеликій кількості.
Вітаміни не виконують в організмі ні структурні, ні енергетичні функції.
В організмі вітаміни проявляють свою біологічну активність в малих дозах (мг чи мкг), вони є необхідною складовою для нормального функціонування усіх життєвих процесів.
За недостатнього надходження або порушення засвоєння вітамінів в організмі виникають патологічні стани у вигляді специфічних гіпо- й авітамінозів.
У підвищених дозах вітаміни можуть використовуватися з лікувальною метою як потужні неспецифічні фармакологічні засоби.
14. Вітамін D і загальна характеристика за його надлишку чи нестачі.
Вітамін D – це жиророзчинні вітаміни групи D (D2 , D3 , D4 , D5 , D6 , D7 ), які відрізняються між собою лише за будовою бокового ланцюга. Вітамін D регулює всмоктування Са2+ з кишечнику і мобілізацію Са2+ з кісток, сприяє підтримці фосфорно-кальцієвого гомеостазу, регулює проліферацію і диференціацію клітин усіх органів і тканин, зокрема клітин крові, імунокомпетентних клітин, тощо.
Надлишок вітаміну D характеризується демінералізацією кісток, внаслідок чого кістки ламаються, у сироватці крові значно підвищується концентрація Са2+ і фосфату (це призводить до кальцифікації багатьох м’яких тканин і утворення каменів у нирках).
Нестача вітаміну D спричиняє такі захворювання як рахіт (розлад правильного утворення скелета та функцій внутрішніх органів і систем), остеомаляція (розм'якшення кісток внаслідок недостатньої мінералізації кісткових тканин), остеопороз (ураження скелету, зниження щільності і порушення структури кісткової тканини).
17. Дати пояснення гіповітамінозам. Навести приклади.
Гіповітаміноз – стан часткової нестачі певного вітаміну, обумовлений недостатнім надходженням вітаміну або неповним його засвоєнням. Недостатня вітамінна забезпеченість погіршує лікування хвороб і сприяє хронізації захворювань. Вітамінний дефіцит знижує активність імунної системи, прискорює старіння організму, збільшує частоту виникнення злоякісних пухлин, скорочує тривалість життя. Явища гіповітамінозу може бути викликане наявністю в кормах антивітамінів.
Приклади гіповітамінозів:
А-гіповітаміноз – спостерігають кон'юнктивіт, ксерофтальмію, кератомаляцію, ослаблення зору, ентероколіт, ураження дихальних шляхів;
D-гіповітаміноз – рахіт, остеомаляція, остеопороз;
Е-гіповітаміноз у самців – зниження статевої активності, у самиць – порушення овуляції, у молодняку – розлад функції кори головного мозку через розм'якшення мозку (енцефаломаляції);
К-гіповітаміноз – зниження згортання крові й геморагічний діатез;
Гіповітамінози вітамінів групи В – спостерігають ураження центрального й периферичного відділів нервової системи (паралічі, парези, конвульсії, судоми), дерматити, екземи, анемії, ураження внутрішніх органів.
20. Коензими та їх роль у каталітичних процесах за дії ензимів.
Коензими – це непротеїнові компоненти складних ензимів, яким властива висока хімічна активність; вони вільно входять до складу активних центрів складних ензимів і є важливими для їх каталітичної активності.
Багато коферментів легко відділяються від ферментного білка і служать переносниками електронів, окремих атомів або груп атомів субстрату, перетворення якого каталізує даний фермент, тобто функціонують як проміжні акцептори.
У обміні речовин коферменти найчастіше залучені як до реакцій передачі групи, наприклад кофермент A і аденозинтрифосфат (АТФ), так і до окислювально-відновлювальних реакцій, наприклад кофермент

Q10 і нікотинамідаденіндинуклеотид (НАД+). Коферменти постійно споживаються і переробляються в процесі обміну речовин.
23. Яка різниця між субстратами і продуктами ензимних реакцій?
В ензимних реакціях субстрат – це молекули, що перетворюються ферментом в результаті специфічної фермент-субстратної взаємодії. Отримані продукти називають продуктами ензимних реакцій.
26. Як всі каталізатори, ензими працюють зі зниженням чи підвищенням енергії активації (Ea) реакції?
Ензими, як всі каталізатори, працюють за пониженням енергії активації (Ea) реакції, що сильно підвищує швидкість реакції. Внаслідок цього продукти утворюються швидше і реакція швидше досягає відповідної рівноваги. Реакції, каталізовані ензимами, проходять в мільйон разів швидше, ніж реакції без них.
29. У чому полягає модифікація моделі «замок-ключ», що характеризує дію ензиму?
Модифікація моделі «замок ключ» створена Деніелом Кошландом у 1958 році і носить назву «моделі індукованої відповідності». Ця модифікація полягає у тому, що комплементарність субстрату ферменту
– це лише частина складної картини взаємодій між ферментом і субстратом: при зв'язуванні субстрату з активним центром відбувається зміна конформації молекули ферменту. Тобто фермент «підлаштовується» під субстрат, як «рукавичка під руку».
32. За хімічною природою гормони поділяють на які групи? Навести приклади.
За хімічною природою гормони поділяють на:
гормони протеїно-пептидної природи: протеїни (інсулін), пептиди (окситоцин);
гормони - похідні амінокислот (тиреоїдні гормони: наприклад, тироксин);
гормони-ліпіди: стероїди (гормони кори наднирників – глюкокортикоїди, мінералокортикоїди і статеві гормони: наприклад, естрадіол, тестостерон, прогестерон);
ейкозаноїди – похідні арахідонової кислоти (простагландини, тромбоксани, лейкотрієни, ізопростани);
похідні фенолів (адреналін).
35. Дати загальну характеристику механізму дії стероїдних гормонів на метаболічні процеси.
Стероїдним гормонам притаманний цитозольний механізм дії. Біологічний ефект стероїдних гормонів виникає через кілька годин і гаситься за кілька годин та днів. Гормон проникає всередину клітини і зв’язується зі специфічними рецепторами цитозолю з утворенням гормонрецепторного комплексу, який проникає в ядро, приєднується до клітинного геному, що впливає на експресію генів і подальший біосинтез протеїнів-ензимів.
38. Які процеси обміну вуглеводів індукує глюкагон?
Глюкагон стимулює процес фосфоролізу глікогену (за рахунок активації аденілатциклазної системи в мембранах гепатоцитів), і через більш тривалий час – процес глюконеогенезу. Таким чином він підвищує рівень вільної глюкози у крові.
41. До якого класу ензимів належать переважно травні ензими?
Переважна більшість травних ензимів належать до класу ензимів гідролази. Цей клас ензимів характеризується каталізом гідролізу різних зв’язків: амілаза, мальтаза - 1,4-α-глікозидні зв'язки,

лактаза – 1,4-β-глікозидні зв’язки, пепсин, трипсин – пептидні зв’язки, ліпаза – естерні зв’язки, нуклеаза, нуклеозидаза – фосфодиефірні зв’язки між субодиницями нуклеїнових кислот.
44. З допомогою яких ензимів перетравлюються олігосахариди?
У перетравленні олігосахаридів приймають участь ензими класу гідролаз. Назви цих ензимів відповідають назвам олігосахаридів: сахароза – ензим сахараза, мальтоза – ензим мальтаза, целобіоза
– ензим целобіаза, лактоза – ензим лактаза, трегалоза – трегалаза. Ці ензими гідролізують різні за положенням глікозидні зв’язки, внаслідок чого олігосахариди перетворюються на моносахариди, які далі вступають у метаболічні шляхи моносахаридів – спиртове бродіння, гліколіз.
47. Яким чином перетравлюються нуклеопротеїни?
Під впливом пептид-гідролазних ензимів шлунка, і частково соляної кислоти, нуклеопротеїни їжі розпадаються на білки й нуклеїнові кислоти. Білки під впливом трипсину, хімотрипсину і пептидаз гідролізуються до амінокислот, які в свою чергу всмоктуються слизовою оболонкою тонкого кишечника .Розпад нуклеїнових кислот відбувається у дванадцятипалій кишці під дією нуклеаз, нуклеозидаз і нуклеотидаз, які входять до складу соку підшлункової залози. Внаслідок цього розпаду з нуклеїнових кислот утворюються пуринові та пиримідинові основи, рибоза, дезоксирибоза, рибозота дезоксирибозо-1-фосфати, вільна фосфорна кислота. Ці метаболіти або піддаються наступним перетворенням до кінцевих продуктів, або включаються в інші процеси обміну.
50.Описати в загальних рисах де у процесах гліколізу, глікогенолізу, окисного фосфорилювання бере участь Фосфор?
Упроцесі глікогенолізу під дією ферменту фосфорилази тa за участі фосфатної кислоти відбувається фосфороліз крайнього глікозидного зв'язку між залишками глюкози з невідновлюючого кінця глікогену. При цьому від глікогену відщеплюється один залишок глюкози у вигляді глюкозо-1-фосфату.
Упроцесі гілколізу фосфор у складі фосфату АТФ приймає участь у фосфорилюванні глюкози, що перешкоджає її вільному виходу з клітини, а також утворенні фруктозо-1,6-дифосфату (швидкістьлімітуюча реакція гліколізу); у стадії «утворення АТФ» запасається у вигляді АТФ за рахунок субстратного фосфорилювання АДФ і утворення НАДН.
Упроцесі окисного фосфорилювання синтезується від 30 до 36 молекул АТФ за рахунок 10 НАДН і 2 молекул сукцинату, що утворилися при окисленні однієї молекули глюкози до вуглекислого газу і води.
53. Як змінюється рівень секреції інсуліну за гіперглюкоземії, гіперглікемії? Загальна характеристика.
За гіперглюкоземії, гіперглікемії рівень секреції β-клітинами острівкової частини підшлункової залози інсуліну підвищується. Інсулін підвищує проникність плазматичних мембран для глюкози (окрім головного мозку); зменшує катаболітичну швидкість ензимів глюконеогенезу у печінці; посилює гліколіз стимулюючи синтез ключових регуляторних ферментів гліколізу; стимулює глікогеногенез в печінці та м’язах, чим знижує рівень вільної глюкози у крові.
56. Як глюкагон діє на швидкість синтезу глюконеогенезу? Дати загальну характеристику
Глюкагон стимулює синтез фосфоенолпіруваткаброксикінази - підвищений рівень глюкагону стимулює синтез цАМФ у гепатоцитах, який зв'язується із транскрипційним фактором CRE-зв'язуючим білком. CRE-зв'язуючий білок приєднується до регуляторної ділянки цАМФ-чутливий елемент
у промоторі гену ФЕП-карбоксикінази, активуючи експресію останнього.
Він також стимулює у гепатоцитах цАМФ-залежний сигнальний шлях, що призводить до фосфорилювання біфункціонального ферменту протеїнкіназою А. Фосфорильована форма цього білка

функціонує як ФБФаза-2 і гідролізує фруктозо-2,6-бісфосфат, внаслідок чого відбувається активація
фруктозо-1,6-бісфосфатази і пригнічення фосфофруктокінази-1.
59.До якого класу ензимів належить аконітаза? Загальна характеристика даного класу ензиму та його типова реакція.
Аконітаза – це ензим класу ліаз, який каталізує стереоспецифічну реакцію ізомеризації цитрату в ізоцитрат в циклі Кребса без окислювально-відновного механізму. Цей клас ензимів характеризується розрізанням різних зв'язків, відмінних від зв’язків при гідролізі та окисненні («розрізають» або «утворюють» подвійні зв'язки).
Типовою реакцією аконітази є дегідратація лимонної кислоти з утворенням цис-аконітової кислоти з подальшим приєднанням до неї молекули води з утворенням ізоцитрату.
62.Реакція ЦТК, що каталізується мультиензимним альфа-кетоглутаратдегідрогеназним комплексом. Субстрати і продукти вказаної реакції та класи ензимів, загальна їх характеристика.
У реакції окиснювального декарбоксилювання альфакетоглутарату ензимом виступає мультиензимний α -кетоглутаратдегідрогеназний комплекс.
Суть реакції полягає у перетворенні α-кетоглутарату в сукциніл-КоА і СО2 під дією мультиензимного α- кетоглутаратдегідрогеназного комплексу. В якості акцептора електронів виступає НАД+, а КоА функціонує як переносник сукцинільної групи. Енергія окиснення α-кетоглутарату запасається при утворенні тіоефірного зв'язку в сукциніл-КоА.
До складу α -кетоглутаратдегідрогеназного комплексу входять 3 ферменти: E1 – оксоглутаратдегідрогеназа з класу оксидоредуктаз, E2 - дигідроліпоїлсукцинілтрансфераза з класу трансфераз і E3 – дигідроліпоїлдегідрогеназа з класу оксидоредуктаз. Кофакторами є тіамінпірофосфат, ліпоат, ФАД, НАД і кофермент А.
65.ФАД-залежна сукцинатдегідрогеназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
ФАД-залежна сукцинатдегідрогеназна реакція ЦТК полягає у окисненні бурштинової кислоти до фумарової кислоти (фумарату) за дії ФАД-залежної сукцинатдегідрогенази. Окиснення відновленого коферменту (ФАДН2 ) за допомогою коензиму Q дихального ланцюга мітохондрій призводить до синтезу за рахунок окисного фосфорилювання 2 молекул АТФ.
ФАД-залежна сукцинатдегідрогеназа – це ензим класу оксидоредуктаз, який містить 3 різних залізосірнистих кластеру і одну молекулу ковалентно зв'язаного з ним ФАД, який є простетичною групою ферменту. Електрони від сукцинату проходять через ФАД і залізосірнисті кластери, далі вони в складі переносників електронів потрапляють на дихальний електронтранспортний ланцюг, розташований на внутрішній мембрані мітохондрій.
Фумарат є інтермедіатом, у наступній реакції ЦТК він перетворюється на малат (яблочну кислоту).
68. Де переважно локалізовані езими клітинного дихання? Загальна характеристика.
Клітинне або тканинне дихання — сукупність біохімічних реакцій живих організмів, що протікають у клітинах, в ході яких відбувається окиснення вуглеводів, ліпідів і амінокислот. Вивільнена енергія запасається в хімічних зв'язках макроенергетичних сполук (АТФ та ін.) і може бути використана в міру необхідності. Реакції клітинного дихання входять до групи процесів катаболізму. Ензими клітинного дихання знаходяться на внутрішній мембрані мітохондрій.
71. Роль холевої кислоти у перетравленні ліпідів. Загальна характеристика.

Холева кислота, разом з хенодезоксихолановою, є основними жовчними кислотами. У жовчному міхурі холева кислота присутня головним чином у вигляді кон'югатів - парних з'єднань з гліцином і таурином. При кон'югації з гліцином утворюється глікохолева кислота, а з таурином (точніше, з продуктом деградації цистеїну - попередника таурину) - таурохолева кислота. У кишечнику вони емульгують жири, активуючи ліпазу і стимулюючи всмоктування вільних жирних кислот.
95. За яких процесів синтезуються полірибонуклеотиди? Загальна їх характеристика.
Транскрипція — процес синтезу РНК з використанням ДНК як матриці, що відбувається у всіх живих клітинах. Транскрипція каталізується ферментом ДНК-залежною РНКполімеразою, процес синтезу РНК протікає в напрямку від 5'- до 3'- кінця. Транскрипція складається з 3 стадій – ініціації (процес зв'язування ДНК-залежної РНК-полімерази з промотором і отримання стабільного комплексу для продовження транскрипції), елонгацій (власне синтез РНК - РНК-полімераза переміщується матричною ниткою і, використовуючи властивість комплементарності основ, будує на ДНК-матриці РНК копію) та термінації (закінчення транскрипції - розрізання РНК, після чого до її 3' кінця фермент додає полі-А- хвіст). Рівень транскрипції більшості генів чітко регулюється за допомогою факторів транскрипції.
98. Які знаєте травні ензими вуглеводів, ліпідів, протеїнів і нуклеїнових кислот? Яка їх спільна характеристика?
Переважна більшість травних ензимів належать до класу ензимів гідролази. Цей клас ензимів характеризується каталізом гідролізу різних зв’язків.
Наприклад, вуглеводні ензими – амілаза, мальтаза – 1,4-α-глікозидні зв'язки, лактаза – 1,4-β-глікозидні зв’язки; протеїнові ензими – пепсин, трипсин – пептидні зв’язки; ліпідні ензими – ліпаза – естерні зв’язки; ензими нуклеїнових кислот – нуклеаза, нуклеозидаза – фосфодиефірні зв’язки між субодиницями нуклеїнових кислот.
101. Які патологічні компоненти можуть бути виявлені при лабораторному дослідженні сечі хворої на цукровий діабет собаки? Загальна характеристика біохімічних процесів за цього захворювання.
При лабораторному дослідженні сечі хворої на цукровий діабет собаки можуть бути виявлені такі патологічні компоненти як глюкоза і ацетонові тіла. Основним проявом цукрового діабету є гіперглікемія, яка виникає через порушення секреції та/або дії інсуліну, результатом чого є абсолютна або відносна недостатність інсуліну чи інсулінорезистентність.
104. Про які процеси свідчить виявлення підвищеного рівня сечової кислоти в сечі хворої людини, що страждає від сильних болів у суглобах? Загальна характеристика біохімічних процесів за цього захворювання.
Виявлення підвищеного рівня сечової кислоти в сечі хворої людини, що страждає від сильних болів у суглобах, свідчить про виникнення такого захворювання як подагра. Захворювання на подагру розвивається при порушенні обміну пуринових нуклеотидів. В результаті в організмі накопичується сечова кислота. Збільшення вмісту сечової кислоти та її солей в крові (гіперурикемія) веде до їх відкладення в суглобах, що супроводжується нападами різкого болю в суглобах, їх почервонінням та припухлістю. Недостатнє виведення сечової кислоти нирками — головна причина гіперурикемії приблизно у 90 % випадків, тоді як надмірне вироблення є причиною лише у 10 % випадків.
107. Який головний нітрогеновмісний компонент сечі? Загальна характеристика складу органічних компонентів.
Основну масу органічного залишку сечі займає сечовина. На азот цієї сполуки припадає близько 80–90 % всього азоту сечі. Зменшення концентрації сечовини спостерігається за умов обмеження білка в раціоні, порушенні функцій печінки, а також у період інтенсивного росту організму.
Основну масу органічного сухого залишку сечі займають нітрогенвмісні продукти обміну білка (сечовина, сечова кислота, пуринові й піримідинові основи, креатинін, креатин, гіпурова кислота, індикан та ін.). Із речовин органічної природи в сечі містяться також у невеликій кількості пігменти (урохром, уробілін, уробіліноген), вітаміни (С, В1, В2, В6, В12 та ін.), гормони та продукти їх обміну (естрол, андростерон, 17-кетостероїди та ін.), ліпіди (холестерин, нейтральні жири та ін.), а також ферменти (протеїнази, ліпази, амілази та ін.).
110. За біохімічних досліджень сечі новонародженого виявлено цитрулін та високий вміст аміаку, що є наслідком порушення синтезу яких сполук? Загальна характеристика біохімічних процесів за цієї патології.
Виявлення цитруліну та високого вміст аміаку у сечі новонародженого свідчить про порушення синтезу сечовини. Синтез сечовини є основним шляхом знешкодження аміаку та кінцевим продуктом білкового обміну у печінці.
Аномалії циклу сечовини спричинюють так звані розлади циклу сечовини:
Недолік (дефіцит) транскарбомоїлази
Дефіцит карбамоїлфосфатсинтетази (дефіцит орнітинтранслокази)
Аргініносукцинатна ацидурія
Aргінінемія
Гіперорнітинемія, гіперамонемія, синдром гомоцитрулінурії
Нетерпимість лізинсечового білку
Цітрулінемія
N-ацетилглутамат синтазний дефіцит.
Найчастіше зустрічаються генетичні дефекти по карбамоїлфосфатсинтетазі та орнітинкарбамоїлфосфаттрансферазі.
113. Внаслідок чого виникає спадкове захворювання галактоземія і як її розвиток може бути затриманий? Загальна характеристика біохімічних процесів за цього захворювання.
Галактоземія – це спадкове захворювання, в основі якого лежить порушення обміну речовин на шляху перетворення галактози в глюкозу. Захворювання викликають три можливі дефіцити: дефіцит ензиму галактозо-1-фосфофатуридилтрансферази, дефіцит галактокінази, дефіцит уридиндифосфатгалактозо- 4-епімерази.
При підтвердженні діагнозу необхідно перевести дитину на харчування з виключенням молока. Для цього розроблені спеціальні продукти: сояваль, нутраміген, безлактозний енпіт. Рекомендуються замінні переливання крові, дробові гемотрансфузії, вливання плазми. З лікарських препаратів показано призначення оротату калію, АТФ, кокарбоксилази, комплекс вітамінів.
116. Для синтезу якої речовини використовується галактоза в молочних залозах? Загальна характеристика складу молока.
Вуглеводи молока представлені головним чином лактозою. D-глюкоза крові та D-галактоза є попередниками лактози молока. D-галактоза в крові відсутня й синтезується з глюкози в молочній залозі в момент утворення лактози.

До складу молока входять понад сто компонентів: понад 20 амінокислот, більше 30 жирних кислот, близько 40 різних мінеральних речовин, у ньому виявлені 17 вітамінів, десятки ферментів, гормони, вуглеводи, нейтральні жири, фосфатиди, стерини, протеозо-пептидні компоненти тощо.
119. Де відбувається активний синтез жирних кислот (наприклад: в адипоцитах жирової тканини, у клітинах кишечнику, в епітеліальних клітинах молочної залози під час лактації, в гепатоцитах)? Загальна характеристика.
Активний синтез жирних кислот (ліпогенез) відбувається в адипоцитах жирової тканини; обмежено у гепатоцитах, у клітинах кишечнику, в епітеліальних клітинах молочної залози під час лактації.
Джерелами ліпогенезу є активні форми жирних кислот (ацил-КоА) та гліцеролу (гліцерол-3-фосфат), який постачається з окиснення глюкози. Спочатку до гліцерол-3-фосфату приєднується два залишки жирних кислот з утворенням фосфатидної кислоти. Потім фосфатидна кислота гідролізується до 1,2- диацилгліцеролу, до якого приєднується третій залишок жирної кислоти з утворенням тригліцериду.
Вопросы Ксюши
66. Фумарат-гідратазна (фумаразна) реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
Суть фумарат-гідратазної (фумаразної) реакції ЦТК полягає у перетворенні фумарової кислоти на яблучну кислоту (L-малат) внаслідок приєднання води до фумарату за дії ензиму фумаратгідратази (фумарази). Перехідним продуктом реакції є карбаніон.
Фумараза є стереоспеціфічним ензимом класу ліаз: вона каталізує гідратацію подвійного зв'язку у фумараті (транс-ізомери), але не в малеаті (цис-ізомер фумарату). Фумараза також проявляє стереоспецифічність і при здійсненні зворотної реакції: D-малат не може служити субстратом для нього.
69. Яким чином (шляхом простої дифузії (?), піноцитозу(?)) всмоктуються моноацилгліцероли? Описати в загальних рисах процес всмоктування.
Приблизно 50% метаболітів гідролізу ТАГ всмоктуються у вигляді моноацилгліцеролів (шляхом простої дифузії або піноцитозу).
Коротколанцюгові ЖК – шляхом простої дифузії, довголанцюгові ЖК і холестерин – у вигляді комплексів з жовчними кислотами.
Холеїнові комплекси у стінці кишечника розпадаються, вивільнені жовчні кислоти через кров потрапляють у печінку, звідки разом із жовчю знову виділяються в кишечник (відбувається процес кишково-печінкової рециркуляції жовчних кислот). За добу таких циклів може бути від 4 до 10.
ЖК, гліцерол та моноацилгліцероли, які всмоктались у стінку кишечника вступають у ресинтез (повторний синтез ТАГ чи інших ліпідів), який відбувається в печінці, жировій тканині та інших органах.
72. Роль холанової кислоти у перетравленні ліпідів. Загальна характеристика.

Усі жовчні кислоти вищих хребетних за хімічною природою є похідними С24-5β-холанової кислоти. Відомо, що ця кислота у природі не зустрічається.
75. Розпад триацилгліцеролу за дії ензимів: відщеплення останнього ацильного залишку (субстрати, продукти, ензим).
Не понимаю
78. Яка речовина бере участь у ліпідному обміні, виконуючи функції переносника залишків жирних кислот через мембрани мітохондрій? Загальна характеристика відповідного процесу.
Не понимаю
81. Що відбувається за процесу трансамінування? Загальна характеристика реакції, навести приклад з назвами субстратів і продуктів.
Трансамінування – це перенос аміногрупи від α-амінокислоти на α-кетокислоту з утворенням нових α- амінота α-кетокислот. Процес каталізується амінотрансферазами (трансаміназами), які використовують як кофермент – піридоксальфосфат (ПАЛФ) – похідне вітаміну В6.
У реакції трансамінування в основному вступають глутамінова, аспарагінова кислоти і, в окремих випадках, аспарагін і аланін. Однак цей процес може відбуватися за участю інших амінокислот. Переамінування (трансамінування) – це основна біосинтетична реакція замінних амінокислот, яка відбувається за участі кофермента, роль якого відіграє піридоксальфосфат.
Приклади:
L-аланін вступає в реакцію з α-кетоглутаратом, і під дією ензиму аланінамінотрансферази утворюються фенілпіруват і L-глутамат;
L-аспартат вступає в реакцію з α-кетоглутаратом, і під дією аспартатамінотрансферази утворюються оксалоацетат і L-глутамат;
L-лейцин вступає в реакцію з α-кетоглутаратом, і під дією лейцинамінотрансферази утворюються α- кетоізокапроат і L-глутамат.
84. Які коензими ензимів, що каталізують реакції трансамінування, декарбоксилювання і дезамінування? Загальна характеристика.
Всі ензими реакцій трансамінування мають один і той же кофактор - піридоксальфосфат (активована форма вітаміну B6).
Первинні аміни утворюються у реакції декарбокислювання L-амінокислот, каталізованої ензимом декарбоксилазою (стереоспецифічним ензимом, що взаємодіє тільки з L-амінокислотами) з коферментом піридоксальфосфатом (ПАЛФ).
Уреакції дезамінування глутамінової кислоти. каталізуючим ензимом є глутаматдегідрогеназа, коферментом глутаматдегідрогенази є НАД+.
Упечінці й нирках знайдено фермент оксидазу L-амінокислот, здатний дезамінувати деякі L- амінокислоти. Коферментом у таких реакціях виступає ФМН.
Непряме дезамінування амінокислот відбувається з участю двох ферментів: амінотрасферази (кофермент ПФ) і глутаматдегідрогенази (кофермент НАД+).
87. Локалізація реакцій орнітинового циклу в клітині. Загальна характеристика.

Орнітиновий цикл (синтез сечовини) метаболічний шлях перетворення токсичного аміаку, що утворюється, в процесі обміну амінокислот, у сечовину. Цей цикл відбувається у мітохондріях і цитоплазмі гепатоцитів, звідки його кінцевий продукт — сечовина — транспортується кров'ю до нирок, де відбувається її екскреція із сечею.
Цикл сечовини складається із п'яти реакцій, дві з яких протікають у матриксі мітохондрій, а три — у цитозолі. Сумарне рівняння метаболічного шляху:
NH3 + HCO-3 + Аспартат + 3 АТФ → Сечовина + Фумарат + 2 АДФ + 2 Фн + АМФ + ФФн. Джерелом одного атома нітрогену є аспартат, іншого – аміногрупи транспортних форм аміаку, а атома карбону – вуглекислий газ.
90. Які кінцеві катаболічні продукти піримідинових нуклеотидів? Назвати продукти. Значення такого катаболічного процесу.
Кінцевими продуктами реакції розпаду піримідинових нуклеотидів є СО2, NН3, сечовина, β-аланін і β- аміноізомасляна кислота. Гідролітичний розпад піримідинів є головним джерелом для утворення β - аланіну, який може служити джерелом для синтезу ансерину і карнозину, а також для утворення КоА. Відомо, що β – аланін у тваринних тканинах піддається подальшому розпаду. У тканинах тварин відкрита специфічна амінотрансфераза, яка каталізує трансамінування між β-аланіном і піровиноградною кислотою. В процесі цієї зворотної реакції синтезуються α-аланін і формілацетат. Формілацетат далі підлягає окиснювальному декарбоксилуванню з утворенням вуглекислоти та ацетил-КоА.
93. Які сполуки слугують своєрідним джерелом атомів піримідину? Назвати відповідні сполуки та вказати значення цього процесу.
Піримідини спершу утворюють піримідинове кільце, до якого згодом приєднується 5- фосфорибозил- 1-пірофосфат (5-Ф-Р-1-піроФ). Піримідинове кільце утворене з трьох компонентів: Атоми Нітрогену N-1 і Карбонів від C-4 до C-6 «походять» від аспартату, Карбон C-2 утворюється із HCO3- , А другий Нітроген (N-3) утворюється із амідної групи глутаміну. Біосинтез молекул піримідину є складним та життєво необхідним майже для всіх клітин організму, оскільки вони входять до складу нуклеозидів, нуклеотидів, нуклеїнових кислот, коферментів, макроергічних сполук (ЦТФ, УТФ, ТТФ) та інших БАР.
ЮЛЯ
1. Пасивний і активний трансмембранний транспорт речовин. Загальна характеристика.
Пасивний транспорт – перенесення речовини за градієнтом концентрації без витрат енергії, але за допомогою спеціальних засобів: полегшена (за допомогою протеїнівпереносників та іонних каналів) і обмінна дифузія (за антипортним механізмом). Активний транспорт – перенос речовин проти градієнта концентрації або електрохімічного градієнта з витратою енергії. Є первинний і вторинний транспорт: під час первинного транспорту енергія витрачається при безпосередньому переносі речовин крізь мембрану, вторинний активний транспорт буває симпортним (транспорт однієї речовини за градієнтом концентрації іншої) і антипортним (транспорт градієнту однієї речовини проти градієнту концентрації іншої).
4.Дати пояснення вторинному активному транспорту

Активний транспорт – перенос речовин проти градієнта концентрації або електрохімічного градієнта з витратою енергії. Вторинний активний транспорт буває симпортним і антипортним. Симпорт – це транспорт однієї речовини за градієнтом концентрації іншої: наприклад, всмоктування глюкози і амінокислот в кишечнику за рахунок градієнту Nа +. Антипорт – це транспорт градієнту однієї речовини проти градієнту концентрації іншої.
7.Джерела екзогенної і ендогенної води клітин.
Екзогенна вода надходить разом з їжею і питтям. Вона складає 6/7 від усієї води. Ендогенна вода (1/7 від загальної маси води) утворюється в тканинах як кінцевий продукт окиснення ліпідів, вуглеводів, білків і НК. При повному окисненні 100 г жиру організм отримує 107,1 г води, 100 г вуглеводів – 55,6г, 100г протеїнів – 41,3 г.
10.Загальна характеристика трофічних ланцюгів живлення
Усі хімічні елементи, які в природних умовах утворюють розчинні у воді сполуки, у складі їжі, питних вод та повітря потрапляють у рослини, організм людини і тварини, утворюючи трофічні ланцюги або ланцюги живлення.
13.Провітаміни та вітамери вітаміну А, їх загальна характеристика.
Вітамін А (антиксерофтальмічний, вітамін росту); ретинол – це жиророзчинний вітамін, що має декілька вітамерів: А1 (ретинол), А2 (дегідроретинол), А3, що існують у вигляді ряду геометричних ізомерів. Ретиналь (альдегід вітаміну А1) є компонентом родопсину — основного зорового пігменту, бере участь у фотохімічному
акті зору, ретиноєва кислота контролює диференціацію та проліферацію епітеліальних і статевих клітин, а також вітамін А є важливим антиоксидантом. Провітаміни вітаміну А – каротиноїди, що з а хімічною будовою вони є поліізопреноїдами, Найбільш поширеними в природі пігментами є каротини, серед яких найбільше значення мають - , - і - каротини.
16.Дати пояснення гіпервітамінозам. Навести приклади.
Гіпервітамінози – патології, що пов’язані з надлишковим надходженням вітамінів до організму. Для водорозчинних вітамінів характерним є гострий гіпервітаміноз обумовлений одноразовим введенням великої дози вітаміну, хронічний гіпервітаміноз для водорозчинних вітамінів не характерний, оскільки вони не здатні накопичуватись в організмі. Жиророзчинні вітаміни окрім гострого, можуть викликати й хронічний гіпервітаміноз, що пов'язано з їх ліпофільністю та здатністю накопичуватися в організмі. Гіпервітаміноз має неспецифічні прояви у вигляді нудоти, діареї, почервоніння шкіри. Наприклад, гіпервітаміноз ретинолу (А) викликає тяжкі розлади обміну речовин, травлення, анемію; а при гіпервітамінозі холекальциферолу (D3) вітамін D3 починає діяти як отрута, порушується жировий обмін, відбувається втрата маси тіла, різко підвищується вміст Са і Р в крові та надлишкове відкладення їх у кістах, нирках, кровоносних судинах, серці.
19.Навести приклади гіпервітамінозу та дати загальну характеристику
Гіпервітамінози – патології, що пов’язані з надлишковим надходженням вітамінів до організму. Водорозчинним вітамінам характерний гострий вітаміноз, жиророзчинним
– як гострий, так і хронічний. Наприклад при гіпервітамінозі холекальциферолу (D3 - жиророзчинний) вітамін D3 починає діяти як отрута, порушується жировий обмін, відбувається втрата маси тіла, різко підвищується вміст Са і Р в крові та надлишкове

відкладення їх у кістах, нирках, кровоносних судинах, серці. А при гіпервітамінозі аскорбінової кислоти (С -водорозчинний) проявляються: алергійні
реакції у вигляді висипів на шкірі, безсоння, кровотечі, підвищується дратівливість, утворюються камені у нирках.
22. Як називають генетично обумовлену ділянку ензиму, де відбуваються хімічні перетворення?
Активний центр - функціональні групи, пептидні зв'язки та гідрофобні ділянки молекули ферменту, на яких відбуваються хімічні перетворення. Активний центр являє собою місце в порожнинах чи в заглибинах на поверхні об'ємних ферментів, в які входять молекулярні частинки реактантів. Більшість ензимів є набагато більшими за субстрат і тому вони діють тільки своєю малою частиною (біля 3–4 амінокислот) у каталітичному процесі. Область, на якій зосереджені “активні” залишки амінокислот, зв'язує субстрат і там проходить відповідна реакція – таку область називають активним сайтом.
25. Чи мають ензими зв’язувальні сайти для продуктів чи субстратів каталізованої ними реакції?
Більшість ензимів є набагато більшими за субстрат і тому вони діють тільки своєю малою частиною (біля 3–4 амінокислот) у каталітичному процесі. Область, на якій зосереджені “активні” залишки амінокислот, зв'язує субстрат і там проходить відповідна реакція. Таку область називають активним сайтом. Після зв’язування активного сайту з субстратом, утворюється ензим-субстратний комплекс, який перетворюється в комплекс ензим-продукт. Продукти залишають активні центри ензиму.
28.Чи оборотній процес каталітичного етапу односубстратної ензимної реакції?
Ензим зв’язує субстрат внаслідок чого утворюється продукт. Цей процес має 2 стадії: 1) зв’язування субстрату: ензим зв’язує субстрат з утворенням ензим-субстратного комплексу, ця реакція є оборотною; 2) каталітична стадія: ензим-субстратний комплекс розпадається на ензим та продукт. Каталітична стадія є необоротною. Найпростіша односубстратная реакція описується зазвичай рівнянням Міхаеліса – Ментен.
31. Які біологічно активні речовини продукуються залозами внутрішньої секреції і виділяються безпосередньо у кров? Дати загальну характеристику.
Гормони - біологічно-активні хімічні речовини, які виділяються ендокринними залозами безпосередньо у кров, лімфу або ліквор і впливають на організм у цілому або на певні органи та тканинимішені. Гормони є гуморальними регуляторами певних процесів у певних органах і системах. 1) За хімічною природою гормони поділяються на: гормони протеїно-пептидної природи, гормони-похідні амінокислот, гормониліпіди; 2) за місцем синтезу поділяються на: гормони центральних ендокринних утворень, переферійних ендокринних утворень, органів змішаної функцій, дифузної ендокринної системи; 3) за характером біологічної дії: істинні («справжні»), гормоноподібні речовини; 4) за характером дії: пускові гормони та гормони-виконавці; 5) за механізмом і швидкістю передачі сигналів: іонотропний (характерний для нейромедіаторів), мембранний та цитозольний.
34. За яким механізмом глюкагон впливає на ліполіз триацилгліцеролів? Дати загальну характеристику.
Глюкагон стимуляє ліполіз в адипоцитах. Стимулюючі ефекти глюкагону на ліполіз реалізуються через активацію аденілатциклазної системи і посилення утворення

цАМФ. Останній активує протеїнкіназу, яка фосфорилює триацилгліцеролліпазу і активує її. Під дією активної ліпази ТАГ розщеплюються до жирних кислот та гліцеролу.
37.Вплив інсуліну на засвоєння глюкози клітиною та її метаболізм.
Інсулін підвищує ступінь проникності плазматичних мембран багатьох клітин для глюкози (окрім головного мозку). Інсулін зменшує швидкість ензимів глюконеогенезу в печінці, стимулює синтез ключових регуляторних ферментів гліколізу (посилюючи гліколітичний розпад глюкози) і синтетичні процеси утворення глікогену в печінці та м'язах, і таким чином, знижує рівень вільної глюкози. Інсулін зв'язується з рецептором, який започатковує початок каскадної активації багатьох ензимів. Це включає транслокацію через глюкозний транспортер-4 (Glut-4) до плазматичної мембрани і потік глюкози, синтез глікогену, гліколіз та синтез жирних кислот.
40. Які гормони і як впливають на ліполітичні процеси в організмі? В загальному пояснити на 1-2 прикладах.
Гормони, які впливають на ліполітичні процеси, поділяють на 2 групи: 1) Гормони прямої дії (адреналін, глюкагон, соматотропін, інсулін) 2) Гормони опосередкованої дії (тиреоїдні гормони, глюкокортикоїди, статеві гормони, лептин). Адреналін, глюкагон, соматотропін, статеві гормони, тироксин і трийодтиронін, лептин – стимулюють ліполіз в адипоцитах, а інсулін пригнічує. Наприклад, стимулюючі ефекти глюкагону на ліполіз реалізуються через активацію аденілатциклазної системи і посилення утворення цАМФ. Останній активує протеїнкіназу, яка фосфорилює триацилгліцеролліпазу і активує її. Гальмуюча дія інсуліну реалізується через блокування утворення цАМФ, внаслідок активації фосфодіестерази - ензиму, який руйнує цАМФ.
43.Чи можуть гормони регулювати травлення і як?
До травних гормонів відносяться: 1) Гастрин - стимулює шлункові залози секретувати пепсиноген (неактивна форма пепсину) і HCl. 2) Секретин - секретує натрій бікарбонат і стимулює секрецію жовчі в печінці, цей гормон відповідає на кислотність хімусу. 3) Холецистокінін - стимулює вивільнення травних ензимів у підшлунковій залозі та жовчі з жовчного міхура, цей гормон секретується у відповідь на появу жиру в хімусі. 4) Шлунковий інгібіторний пептид знижує травну активність шлунку у відповідь на звільнення перетравлюваної маси з нього та секретує інсулін. 5) Мотилін
–підвищує «мігрування» міоелектричного комплексного компоненту шлунковокишкової рухливості та стимулює продукцію пепсину.
46.За дії яких ензимів перетравлюються холестериди?
Естерази - ферменти, що каталізують в клітинах гідролітичні розщеплення складних ефірів на спирти і кислоти за участю молекул води (гідроліз). Естерази належать до класу гідролаз. До естераз відносяться: ліпази, фосфатази, сульфатази і власне естерази. До останніх належать численні специфічні ферменти: холінестераза, хлорофіллаза, танназа, пектаза.
49.Які у гліколізі три реакції (їх субстрати, продукти та ензими) є незворотніми ?
У гліколізі виділяють 3 незворотні реакції: гексокіназна (або глюкокіназна в печінці), фосфофруктокіназна та піруваткіназна. Гексокіназна реакція — фосфорилювання

глюкози з утворенням глюкозо-6-фосфату, що каталізується ферментом гексокіназою. Донором фосфатної групи є молекула АТФ, кофактором виступають іони Mg2+. Друга реакція фосфорилювання (фосфофруктокіназна), за якої фруктозо-6-фосфат перетворюється на фруктозо-1,6-дисфосфат завдяки приєднанню фосфатної
групи АТФ, ензимом є 6-фосфофруктокіназа, кофактором – іони Mg2+. Піруваткіназна реакція— перенесення фосфатної групи з фосфоенолпірувату на АДФ —
каталізує піруваткіназа за наявності іонів K+ та Mg2+ або Mn2+, продуктом цієї реакції є піруват.
52.Окиснення глюкози в м’язах, у мозку тощо зменшує чи збільшує глюкоземію?
Окиснення глюкози в м'язах, мозку тощо призводять до гіпоглюкоземії (зменшення вмісту глюкози в крові).
55.Яке біологічне значення глюкозо-аланінового циклу?
Важливий субстрат глюконеогенезу в печінці – аланін, який може утворюватися у зворотній реакції трансамінування пірувату з глутаматом у скелетних м'язах. Вивільняючись із працюючих м'язів у кров, аланін поглинається гепатоцитами і після перетворення в піруват використовується в глюконеогенезі. Також метою глюкозоаланінового циклу є виведення зайвого азоту з м’язів. Утворений аланін є транспортною формою пірувату та азоту з м'яза в печінку. У гепатоциті йде зворотна реакція трансамінування, аміногрупа передається на синтез сечовини, піруват використовується для синтезу глюкози.
58.Які субстрати і продукти цитратсинтазної реакції ЦТК? Значення цієї реакції.
Цитатсинтазна – це перша реакція ЦТК. Характеризується вона утворенням лимонної кислоти (цитрату) за рахунок конденсації ацетил-КоА з щавелевооцтовою кислотою (оксалоацетатом). Ензимом є цитратсинтаза – це регуляторний фермент, активність якого гальмується АТФ, НАДН, сукциніл-КоА та довголанцюговими ацил-КоА. Синтетаза цитрату виявлена практично у всіх клітинах аеробних організмів, реакція, що каталізується, є лімітуючою на першому етапі Циклу трикарбонових кислот. Цитратсинтазна реакція забезпечує субстратом (цитратом) наступну реакцію ЦТК.
61. (НАД-залежна) ізоцитратдегідрогеназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
Ізоцитратдегідрогеназна реакція характеризується дегідруванням та декарбоксилюванням ізоцитрату (субстрат) з утворенням альфа-кетоглутарової кислоти (продукт). Внаслідок ізоцитратдегідрогеназної реакції утворюється 3 АТФ. Реакція каталізується НАД-залежною ізоцитратдегідрогеназою, яка є регуляторним ферментом, позитивний модулятор якого – АДФ, негативний - НАДН. Ензим ізоцитратдегідрогеназа відноситься до оксидоредуктаз. Оксидоредуктази каталізують реакції оскинення та відновлення.
64. Нуклеозидфосфокіназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
За сукцинілтіокіназної реакції утворюється ГТФ, який потім передає свою кінцеву фосфатну групу на АДФ у нуклеозидфосфокіназної реакції з утворенням АТФ. Субстратами є ГТФ і АДФ, продуктами ГДФ і АТФ. Нуклеозидфосфокіназну реакцію каталізує нуклеозидфосфокіназа. Цей ензим відноситься до трансфераз, які переносять функціональні групи (наприклад, фосфатну, метильну, аміно-групу).

67. Малатдегідрогеназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
Малатдегідрогеназна реакція завершує цикл трикарбонових кислот. Малатдегідрогеназна реакція характеризується окисленням малату (субстрат) до оксалоацетату (продукт) за дії НАД-залежної малатдегідрогенази мітохондрій. Окиснення утвореного НАДН у дихальному ланцюзі мітохондрій призводить до генерації 3 молекул АТФ. Ензимом є маталдегідрогеназа, що відноситься до 1 класу ензимів – оксидоредуктази. Оксидоредуктази каталізують реакції окиснення та відновлення.
70. Яким чином (шляхом простої дифузії (?), піноцитозу(?)) всмоктуються 50 % продуктів гідролізу ТАГ? Описати в загальних рисах процес всмоктування.
Близько 50% продуктів гідролізу ТАГ всмоктуються у вигляді моноацил-гліцеролів (шляхом простої дифузії або піноцитозу). Всмоктування відбувається в тонкому відділі кишечнику. Дифузія – це самочинний процес вирівнювання концентрації речовини у всьому об'ємі розчину, зумовлений тепловим рухом частинок розчиненої речовини і розчинника. Дифузія відбувається із розчину більшої концентрації розчиненої речовини у розчин з меншою концентрацією цієї речовини. Піноцитоз – це різновид ендоцитозу, що характеризується перенесенням крапель рідини через мембрани разом з частиною плазматичної мембрани всередину клітини.
73. Особливості травлення жирів у дорослих (щодо наявності ферментів у різних відділах шлунково-кишкового тракту). Загальна характеристика.
У ротовій порожнині та стравоході ферменти, що розщеплюють ліпіди, відсутні. У шлунку є малоактивна ліпаза, що розщеплює гідролітично емульгований жир. Головним місцем травлення ліпідів є дванадцятипала кишка, куди надходить неактивна підшлункова ліпаза, яка активується коліпазою і жовчними кислотами, активна ліпаза діє лише на емульговані жири; емульгаторами є жовчні кислоти. У порожній та клубовій кишках завершується перетравлювання ліпідів та відбувається всмоктування продуктів їх розщеплення. Тобто у перетравлюванні ліпідів беруть участь жовч, сік підшлункової залози і кишковий сік.
76. Локалізація процесів бета-окиснення ЖК (активація ЖК і саме реакції їх бетаокиснення). Загальна характеристика.
Окиснення відбувається в мітохондріях, оскільки там інтенсивно перебігає процес дихання, але починається цей процес у цитоплазмі, де здійснюється активування жирних кислот. Процес активування жирних кислот відбувається за участю АТФ, коферменту A (HS-СoA) та іонів Mg2+. Транспортування активованих жирних кислот з довгим ланцюгом через щільну мітохондріальну мембрану здійснюється за допомогою карнітину (1 етап бета окиснення жирних кислот - карнітиновий човниковий механізм). 2 етап – власне бета окиснення жирних кислот складається з послідовних реакцій дегідрування за допомогою фермента ацил-КоА-дегідрогенази, реакції гідратації еноїл-КоА, друга стадія дегідрування за дії фермента оксіацил-КоА- дегідрогенази і тіолазної реакції, що каталізується тіолазою.
79. Яка характерна реакція для ензимів класу трансфераз? Загальна характеристика реакції, навести приклад з назвами субстратів і продуктів.

Другий клас ензимів – трансферази, переносять функціональні групи (наприклад, фосфатну, метильну, аміно-групу). Прикладом трансферази може бути гексокіназа, що каталізує першу (необоротну) реакцію гліколізу. За дії гексокінази глюкоза, використовуючи фосфатну групу АТФ, фосфорилюється до глюкозо-6-фосфату. Субстратами в цій реакції є глюкоза та АТФ, продуктами – глюкозо-6-фосфат та АДФ.
82.Які перетворення відбуваються у реакції декарбоксилювання
амінокислот? Загальна характеристика реакції, навести приклад з назвами субстратів і продуктів.
Декарбоксилювання амінокислот – це відщеплення карбоксильної групи від амінокислоти у вигляді СО2 . В результаті декарбоксилювання амінокислот утворюються біогенні аміни. У цю реакцію, каталізовану декарбоксилазою з коферментом піридоксальфосфатом (ПАЛФ), вступають всі L-амінокислоти.
Наприклад, утворення з L-глутамату гамма-аміномасляної кислоти (ГАМК) та СО2. У цій реакції субстратом є L-глутамат, а продуктами ГАМК та СО2.
85. Карбомоїлфосфатсинтетазна реакція орнітинового циклу (субстрати і продукти). Загальна характеристика класу відповідного ензиму і його типової реакції.
Карбомоїлфосфатсинтетазна реакція орнітинового циклу характеризується об’єднанням NH3, СО2 та АТФ у молекулу карбомоїлфосфату за дії карбомоїлфосфатсинтетази. Субстратами в цій реакції виступають NH3, СО2 та АТФ, а продуктами – карбомоїлфосфат, АДФ та Фн. Карбомоїлфосфатсинтетаза відноситься до 6 класу ензимів – лігази. Характерними реакціями для лігаз є об’єднання двох молекул з ковалентними зв’язками.
88. Головні стадії біосинтезу протеїну та його значення. Загальна характеристика стадій.
Трансляція – це передача інформації з мРНК на поліпептидний ланцюг (тобто трансформація інформації з нуклеотидної послідовності ДНК на мРНК і згодом – у амінокислотну послідовність білкової молекули) за допомогою рибосом. Трансляція складається з 1) ініціації – приєднання мРНК до рибосоми, приєднання тРНК, що несе метіонін, до Р сайту; 2) елонгація – процес приєднання першої амінокислоти, що несе тРНК, до А сайту, утворення пептидних зв’язків між амінокислотами, рух рибосоми на 3 нуклеотидні основи, звільнення тРНК, яка вже віддала свою амінокислоту (повторення цих процесів до появи «стоп-кодону»); 3) термінація – потрапляння стоп кодону в А сайт, відділення оліго/поліпептидного ланцюга та вивільнення складових трансляційної машини. Біосинтез білка – це анаболітичний процес, який забезпечує організм будівельним матеріалом (білками).
91. Які виникають патологічні стани внаслідок порушення катаболізму пуринів? Дати загальну характеристику.
Кінцеві продукти розпаду пуринів – сечова кислота. Внаслідок накопичення сечової кислоти у великій кількості у крові розвивається гіперурикемія, що може спричиняти акумуляцію кристалів сечової кислоти в організмі. Відкладення таких кристалів у суглобах спричиняє дуже болісні «атаки» подагри. Рідкісна спадкова хвороба – синдром Леша-Ніхана, є наслідком дефекту гіпоксантингуанінфосфорибозилтрансферази (ензиму, який забезпечує повторне

використання вільних гіпоксантину і гуаніну). Пошкоджена «переробка» пуринових основ спричиняє гіперурикемію та гострі нейрологічні захворювання.
94. Яка відмінність між синтезом пуринових і піримідинових нуклеотидів? У загальних рисах описати відмінності.
За синтезу пуринових нуклеотидів до утвореного рибозо-5’-фосфату приєднуються почергово атоми пуринової азотистої основи. Гліцин є донором для C-4, C-5, і N-7; C-6 утворюється з HCO3-; амідні групи глутаміну утворюють атоми N-3 і N-9; а спартат є донором аміногрупи для утворення N-1; C-2 і C-8 «походять» від формільних груп N10-форміл-тетрагідрофолату. На відміну від пуринів піримідини спершу утворюють піримідинове кільце, до якого згодом приєднується 5- фосфорибозил-1-пірофосфат. N- 1 і C-4, С-5 і C-6 «походять» від аспартату; C-2 утворюється із HCO3-; N-3 утворюється із амідної групи глутаміну.
97. Які біомолекули привносить ретровірус до клітин-«мішеней»? Загальна характеристика процесу.
Геномна РНК ретровірусів перетворюється в ДНК за допомогою зворотної транскриптази – ензиму, привнесеного у клітину вірусною часткою. Зворотна транскриптаза каталізує синтез комплентарного ланцюга ДНК, розщеплення РНК і наступний синтез ДНК-ланцюга.
100.Що є спільним та відмінним у катаболічних й анаболічних процесах?
Катаболізм – це сукупність процесів розщеплення біомолекул з вивільненням енергії. Анаболізм – синтез специфічних, генетично притаманних даному організмові біомолекул (білків, НК, полісахаридів, ліпідів, біорегуляторів тощо), що необхідні для утворення власних клітинних та позаклітинних біоструктур; ці процеси потребують використання енергії у формі АТФ. Тобто відмінним є те, що катаболізм – це розпад, екзергонічний процес; метаболізм – синтез, ендергонічний процес. Спільним є те, що катаболізм та анаболізм формують обмін речовин (метаболізм). Продукти та енергія, що утворюються катаболітичних реакціях використовується в реакціях анаболізму.
103. Наслідком катаболізму яких речовин є підвищення екскреції сечової кислоти? Загальна характеристика біохімічних процесів за цього захворювання.
Сечова кислота утворюється внаслідок катаболізму нуклеїнових кислот, а саме пуринів. Сечова кислота є слабо розчинною у воді сполукою. Внаслідок її накопичення у великій кількості у крові розвивається гіперурикемія, що може спричиняти акумуляцію кристалів сечової кислоти в організмі. Відкладення таких кристалів у суглобах спричиняє дуже болісні «атаки» подагри.
106. Якщо в крові та сечі дитини підвищений вміст аргініносукцинату та спостерігається блювота, порушення координації рухів, відраза до продуктів, збагачених білками, то це є наслідком порушення якого метаболічного шляху? Загальна характеристика.
Якщо в крові та сечі дитини підвищений вміст аргініносукцинату та спостерігається блювота, порушення координації рухів, відраза до продуктів, збагачених білками, то це є наслідком порушення орнітинового циклу (цитрулінемія). Ця хвороба пов’язана з генетичною недостатністю ензиму аргінінсукцинатсинтази. Аргінінсукцинатсинтаза каталізує перетворення цитруліну в аргінінсукцинат.
109. Якщо в сечі пацієнта виявлено глюкозу і ацетонові тіла, то це характерно, передусім, для якого захворювання? Загальна характеристика біохімічних процесів за цього захворювання.

Якщо в сечі пацієнта виявлено глюкозу і ацетонові тіла, то це характерно для цукрового діабету. Інсулін зменшує швидкість ферментів глюконеогенезу в печінці, стимулює синтез ключових регуляторних ферментів гліколізу (посилюючи гліколітичний розпад глюкози) і синтетичні процеси утворення глікогену в печінці та м'язах, і таким чином, знижує рівень вільної глюкози. За недостатнього синтезу інсуліну спостерігається стійка гіперглікемія. При цукровому діабеті рівень кетонових тіл різко підвищується (кетонемія), збільшується їх виділення з сечею (кетонурія). Причиною кетонемії є зменшення утилізації ацетил-КоА в ЦТК при порушенні вуглеводного обміну.
112. Яка в дитини вроджена ензимопатія, що характеризується затримкою розумового розвитку, збільшенням розміру печінки, помутнінням кришталика ока, та виявляється за споживання молока? Загальна характеристика біохімічних процесів за цього захворювання.
Галактоземія характеризується затримкою розумового розвитку, збільшенням розміру печінки, помутнінням кришталика ока, та виявляється за споживання молока. Спадкове захворювання - галактоземія виникає внаслідок неспроможності біохімічних систем організму перетворити глюкозу на галактозу. За цієї хвороби відбувається мутація структурного гена, відповідального за синтез ферменту галактозо-1- фосфатуріділтрансферази. Її розвиток може бути затриманий дієтичним обмеженням в споживанні молока.
115. З яких моносахаридів складається лактоза (молочний цукор)? Загальна характеристика складу молока.
Лактоза (молочний цукор)– це олігосахарид, що складається з галактози та глюкози. До складу молока входять понад сто компонентів, основні з яких: вода, білки (казеїн, сироваточні білки), лактоза, жири, мінеральні речовини (в тому числі
і мікроелементи), гормони, вітаміни, ферменти, антитіла (IgA). Деякі компоненти (казеїн, лактоза) не зустрічаються в інших продуктах харчування. Казеїн молока відноситься до фосфопротеїнів, існує 4 типи казеїнових білків. Молочний жир – це триацилгліцерол, до якого входять залишки міристинової, пальмітинової та олеїнової кислот.
118. В яких тканинах активно «працює» пентозофосфатний шлях (наприклад: скелетні м’язи, жирова тканина, лактуюча молочна залоза, кора наднирників, сім’яники)? Загальна характеристика.
Реакції пентозофосфатного шляху (ПФШ) відбуваються у тканинах з вираженим анаболізмом: лактуюча молочна залоза (компоненти молока), печінка (синтез жирних кислот і холестеролу); наднирники, cім`яники і яєчник (синтез стероїдів); жирова тканина (синтез жирних кислот). Пентозофосфатний шлях є альтернативним метаболічним процесом перетворення глюкози, внаслідок якого генерується відновлений НАДФН, що далі може використовуватися в анаболічних процесах; ПФШ забезпечує пентозами синтези багатьох важливих біомолекул. Він складається з окиснювальної стадії, яка генерує НАДФН і неокиснювальної стадії, в якій взаємоперетворюються фосфорильовані цукри. Одна з шести молекул глюкози повністю окиснюється до СО2 з акумуляцією відновлюваних еквівалентів (12 атомів Гідрогену) у вигляді НАДФН.
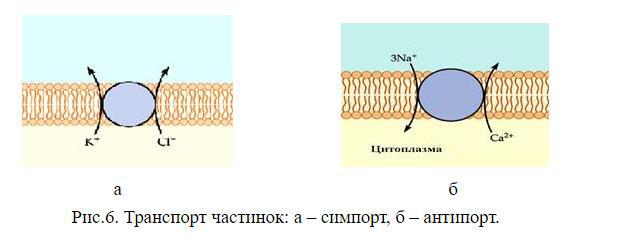
3. Дати пояснення термінам синпорт, антипорт і уніпорт
Існує три форми вторинного активного трансторту: антипорт, сімпорт, уніпорт. Транспорт двох частинок в одному напрямі називають симпортом, а в протилежному напрямку – антипортом . Симпорт – це активне перенесення речовини через мембрану, що здійснюється за рахунок енергії градієнта концентрації іншої речовини. Транспортна АТР-аза в даному випадку має центри зв’язування для двох речовин. Антипорт – це перенесення речовини проти градієнта своєї концентрації. При цьому інша речовина переміщається в протилежному напрямку по градієнту своєї концентрації. Симпорт і антипорт можуть відбуватися при всмоктуванні амінокислот із кишечника і реабсорбції глюкози із первинної сечі. При цьому використовується енергія градієнта концентрації іонів , який створений , -АТР-азою.
Уніпорт– транспорт однієї речовини в одному напрямку в залежності від градієнта. Уніпорт здійснює, наприклад, потенціал-залежний натрієвий канал, крізь який в клітину під час генерації потенціалу дії переміщуються іони натрію.
6. Біологічне значення води для організму
Вода виконує важливі функції. Це розчинник мінеральних і органічних речовин, що є у складі їжі і продуктів обміну. Приймає участь у реакціях обміну: гідролізу, гідратації, окиснення, відновлення тощо. Вода бере участь у терморегуляції організму. Біля 25% надлишку теплової енергії організму виділяється з водою (випаровування з поверхні шкіри). Близько 25% теплоти виділяється з парою видихуваного повітря. Це дає можливість організму підтримувати ~ сталу температуру, відповідні форми органів та повноцінний перебіг всіх реакцій, просторової (вторинної, третинної) та інших структур протеїнів і багатьох сполук й утворень (мембрани).
9. Макро-і мікроелементи і їх роль для організму тварин
Більше 70 хімічних елементів виявлено в організмі. З них 47 міститься постійно у клітинах і тканинах. Це біогенні хімічні елементи. Вони утворюють неорганічний і органічний склад речовин. Основою неорганічних речовин є вода і мінеральні сполуки (солі, основи, кислоти). Вода складає ~66% загальної маси тіла тварини, а мінеральні і органічні сполуки, відповідно – 5,6% і 28,4 %.До елементів, які постійно присутні в біологічних тканинах, належать С, N, O, H, K, Na, Ca, Mg, S, P, J, Fe, Mn, Cu, Co, Zn, Se. Ці елементи називають біоелементами. Вміст макроелементів не нижче 10-3 % (>0,001%) маси організму (О, С, Н, Са, К, N, P, S, Cl, Mg, Na), макроелементи є в органах і тканинах у мг; Вміст мікроелементів коливається в межах від 10-3 до 10-6 % (від 0,001 до 0,000001 %) маси організму (Cu, Fe, Mn, Zn, B, Co й ін.), мікроелементи є в органах і тканинах у мкг і нг Біологічне значення мінеральних речовин характеризується
•підтриманням нормального водного балансу і розподіленням води в тканинах,
•забезпеченням постійного осмотичного тиску та кислотно-лужної рівноваги,
•нормалізацією нервово-м’язового збудження і проведенням нервових імпульсів,
•генерацією біотоків та ін.
Мінеральні речовини входять до складу
•опорних тканин (Са, Р і Mg),
•біологічно-активних сполук (Р, Fe, Zn, Co, J, Cu і Mn),
•високо енергетичних сполук (Р і S),
•сполук, які впливають на ферментну активність, захисні функції організму, транспорт поживних речовин Найбільше мінеральних речовин у кістках (48 – 74 % від загальної маси) і хрящах (2 – 10 %). Мінеральні речовини є в тканинах і клітинах можуть бути у вільному і зв’язаному стані. Так, у кістках, хрящах і дентині – у вигляді міцних нерозчинних відкладів – неорганічних солей вугільної, ортофосфорної та інших кислот. В окремих біорідинах (кров, лімфа, молоко, травний сік) багато з них міститься у вільному стані або у вигляді окремих йонів. Частина з них входить у склад біоорганічних сполук.
Ферум – у склад гемоглобіну, каталази і трансферинів. Фосфор – у нуклеїнових кислотах, протеїнах, фосфоліпідах, фосфорних естерах вуглеводів, макроергів (АТФ, АДФ) тощо. Сульфур – КоА, глутатіон, цистеїн, цистин і т.д. Йод – у молекулах гормонів щитовидної залози. Мінеральні речовини – будівельний матеріал для кісток, мембран тощо. Розчинні мінеральні речовини – регулятори фізикохімічних процесів (осмосу, осмотичного тиску...).
Натрієві і калієві солі фосфорної, вугільної та деяких органічних кислот утворюють з протеїнами тканин і крові буферні системи.
З наявністю заряду неорганічного йона пов’язані фізико-хімічні властивості колоїдів організму (явища гідратації, в’язкість, розчинність, здатність до набрякання... Окремі катіони (Ca2+ , Mg2+ , Mn2+ і Zn2+ ) є активаторами або інгібіторами ензимних реакцій. Деякі метали входять до складу вітамінів, гормонів та інших сполук. З наявністю мінеральних речовин (NaCl) у кормі пов’язані засвоєння його організмом і секреторна функція травного каналу. Деякі мінеральні речовини (H2SO4 ) приймають участь у нейтралізації отруйних речовин і продуктів, що утворюються в організмі при обміні речовин, чи надходять ззовні.
12. Навести приклади водорозчинних вітамінів, їх роль для життєдіяльності організму.
Вітаміни (латинською мовою vita – життя) – це низькомолекулярні органічні речовини різної хімічної природи, які є необхідними для існування живого організму в дуже малих кількостях у порівнянні з основними продуктами харчування.
Водорозчинні вітаміни:
вітамін В1 (антиневритний, аневрин); тіамін
вітамін В2 (вітамін росту); рибофлавін
вітамін В5(3) (антидерматитний); пантотенова кислота
вітамін В3(5) (РР; антипеларгічний); нікотинамід, ніацин, нікотинова кислота вітамін В6 (антидерматитний; адермін); піридоксин
вітамін В7(8) (Н; антисеборейний); біотин
вітамін В9 (Вс); фолієва кислота
вітамін В12 (антианемічний); ціанкоболамін
вітамін С (антицинготний, антискорбутний) аскорбінова кислота
вітамін Р (капіляроукріплюючий, вітамін проникності); біофлавоноїди крові та регулює проникливість судин.
вітамін U (противиразковий)
Вітамін В1 або тіамін — важливий кофактор ферментів обміну глюкози та жирів. Він стає захищає судини від шкідливого впливу глюкози та інсуліну,
Вітамін В1 потрібен для адекватної роботи центральної і периферійної нервової систем — нейрони використовують саме глюкозу як джерело енергії, і брак вітаміну В1 може призвести до їх загибелі. Як наслідок, порушується короткотривала пам’ять і координація рухів. Вітамін В1 — це кофактор синтезу нейромедіатору ацетилхоліну.
Вітамін B2 інтенсифікує процеси обміну речовин в організмі, беручи участь у метаболізмі білків, жирів і вуглеводів. Рибофлавін необхідний для утворення червоних кров'яних тілець і антитіл, для дихання і росту клітин. Він полегшує поглинання кисню клітинами шкіри, нігтів і волосся.
пантотенова кислота відповідає за синтез у організмі гормонів (наднирніків, статевих, росту), незамінних жирних кислот, гемоглобіну, холестерину, ацетилхоліну і гістаміну;
вітамін В5 як складова коферменту вітаміну А, відповідає за метаболізм білків, вуглеводів і жирних кислот, а також, активує окисно-відновні реакції у клітинах тканин організму.
пантотенова кислота входить до складу лікувальних засобів від опіків та косметичних препаратів, оскільки вона є єдиним вітаміном, що всотується у шкіру при нанесенні.
Ускладі НАД+ і НАДФ+ ніацин бере участь в обміні речовин. Є приблизно сотня нікотинамідзалежних ферментів. НАД+ і НАДФ+ є коферментами багатьох дегідрогеназ, необхідних для вироблення енергії в клітині: виступають акцепторами і проміжними переносниками атомів водню на початкових стадіях окиснення вуглеводів, жирних кислот, амінокислот, гліцерину, на стадії циклу Кребса і в термінальних стадіях дегідрування в дихальному ланцюзі та монооксигеназному ланцюзі.
Таким чином, вітамін В35бере участь в енергозабезпеченні клітин і в знешкодженні шляхом окиснення природних та чужорідних речовин (монооксигеназний ланцюг окиснення).
Біологічна роль вітаміну В6 визначається його участю як коферменту у функціонуванні багатьох ферментів, у першу чергу ферментів амінокислотного обміну. Піридоксин бере участь у синтезі арахідонової кислоти, вітаміну PP, має велике значення в профілактиці атеросклерозу, а також підвищенні кислотності шлункового соку.
Біологічна дія вітаміну В12 тісно пов'язана з внутрішнім фактором Касла, який відіграє важливу роль у механізмі всмоктування кобаламінів. Основна дія кобаламіну – антианемічна.
15. Антивітаміни та їх загальна характеристика
Відкриття вітамінів відіграло виключно велику роль у профілактиці та лікуванні багатьох захворювань. Деякі бактерії для свого росту і розвитку потребують наявності багатьох вітамінів для синтезу коензимів. При цьому введення в організм структурних аналогів вітамінів, які ще називаються антивітамінами, призводить до загибелі мікроорганізмів. Антивітаміни зазвичай блокують активні центри ензимів, витісняючи з них відповідні похідні вітамінів (коензим) і викликають конкурентне пригнічення активності даних ензимів. До антивітамінів відносять речовини, що здатні після їх введення в організм тварин викликати класичну картину гіпочи авітамінозу. Антивітаміни – це речовини, що викликають зниження чи повну втрату біологічної активності вітамінів. За механізмом дії антивітаміни поділяються на дві групи: 1. Антивітаміни, що мають структуру подібну до нативного вітаміну і тому можуть включатись замість вітаміну в каталітичну ділянку активного центру ферменту, що призводить до зниження або втрати вітаміном їх коензимних функцій. Приклади: • протитуберкульозні препарати – гідразиди ізонікотинової кислоти
– здатні знижувати активність піридинзалежних ферментів; • протипухлинні препарати – метотрексат знижує активність фолатзалежних ензимів, блокуючи тим самим синтез нуклеїнових
кислот і розмноження клітин; • сульфаніламіди включаються замість параамінобензойної кисалоти (ПАБК) у структуру фолієвої кислоти і тому порушують функцію останньої; • кумарини (дикумарол, варфарин) заміщають вітамін К в реакціях перетворення неактивних факторів згортання крові в активні; завдяки цим властивостям кумарини застосовуються для лікування гіперкоагуляційних станів. 2. Антивітаміни, що викликають зміну структури вітамінів, порушують всмоктування, транспорт та, відповідно, знижують їх біологічну активність. Прикладами є тіаміназа, що руйнує вітамін В1, протеїн авідин, який зв'язує біотин (віт.В8) з утворенням неактивного комплексу.
18. Чим відрізняється авітоміноз від гіповітамінозу.
Гіповітаміноз - стан часткової нестачі певного вітаміну, що може мати як стерту так й яскраво виражену клінічну картину. Недостатня вітамінна забезпеченість погіршує лікування хвороб і знижує його ефективність, що зрештою сприяє хронізації захворювань. Вітамінний дефіцит знижує активність імунної системи, прискорює старіння організму, збільшує частоту виникнення злоякісних пухлин, скорочує тривалість життя
Авітаміноз – стан, що виникає за повної відсутності або повному порушенні засвоювання певного вітаміну, що завжди проявляється яскраво вираженою клінічною картиною. В деяких випадках може призводити до смерті.
Гіповітамінози – обумовлені недостатнім надходженням вітамінів або неповним їх засвоєнням. Більшість вітамінів не може накопичуватись в організмі тварин та людини, тому потрібно постійно поповнювати їх дефіцит. Явища гіпо- і авітамінозів можуть бути викликані наявністю в кормах антивітамінів – структурних аналогів вітамінів, що витісняють вітаміни з відповідних реакцій обміну речовин і не здатні виконувати їх функції
21.Що являє собою активний центр ензиму?
Активний центр — особлива частина молекули ферменту, що визначає його специфічність і каталітичну активність.
Активний центр безпосередньо здійснює взаємодію з молекулою субстрату або з тими її частинами, які беруть участь в реакції.
Активний центр зазвичай має вигляд маленької «кишені» на поверхні ферменту, яка містить залишки, що відповідають за специфічність до субстрату (заряд, гідрофобність, стеричні перешкоди), що з'єднуються з різними ділянками субстрату, і каталітичні залишки, які часто служать донорами або акцепторами протону, або відповідають за
зв'язування кофактору (наприклад PLP, TPP або НАД+). Відомі ферменти, що мають більш ніж один активний центр, і вони можуть одночасно адсорбуватись до частинок субстрату багатьма центрами одночасно. В деяких ферментах при адсорбції на субстрат, відбувається зміна його четвертинної структури, яка може відкрити ще один активний центр для іншого типу субстрату.
Активний центр — також ділянка зв'язування інгібіторів ферменту.
24.Чи співпадають місця зв’язування кофакторів ензимів з їх активними центрами?
Ні
27. Чи оборотній процес зв’язування субстрату з ензимом під час односубстратної ензимної реакції?
Так
30.В яких межах знаходиться температурний оптимум дії більшості ензимів у тварин, С?
Температурний оптимум дії більшості ферментів тварин знаходиться в межах температури тіла – 37 – 40°С. Виключенням є папаїн, найбільша активність каталітичної дії якого виявляється при 80°С, і каталаза, температурний оптимум дії якої лежить між 0 і 10°С. При підвищенні температури середовища на 10°С швидкість реакції зростає в 1,5 – 3 рази (правило ле Шательє) приблизно в межах від 0 до 25°С; потім поволі підвищується і після 40°С починає зменшуватися

33. Які виділяють два механізми гормонального впливу на метаболічні процеси? Загальна характеристика.
За механізмом дії гормони поділяють на дві групи. До першої належать гормони, які взаємодіють з мембранними рецепторами (пептидні гормони, адреналін, а також гормони місцевої дії – цитокіни та ейкозаноїди) і контролюють процеси швидкої адаптації організму, які потребують термінового включення певного біохімічного процесу або фізіологічної функції (глікогенолізу, ліполізу, м,язового скорочення). Друга група включає гормони, які взаємодіють з внутрішньоклітинними рецепторами (стероїдні та тиреоїдині гормони), їх біологічна дія повільніша (потребує для свого проявлення декількох годин), вони відповідають за процеси довготривалої адаптації організму. Детальніше про це буде описано згодом.
36.Описати в загальних рисах біосинтез інсуліну.
Інсулін синтезується b-клітинами підшлункової залози з амінокислот, що поступають з крові або утворюються в цих клітинах. Спочатку проходить синтез препроінсуліну (М.м 14500), який перетворюється у просторі трубочок ендоплазматичного ретикулуму в проінсулін. Його синтез починається з b-ланцюга та закінчується a-ланцюгом. Між ними локалізується С-пептид, який складається з 33 амінокислот. Всього проінсулін містить 78-86 амінокислотних залишків у залежності від виду тварини.
Синтез проінсуліну проходить в рибосомах ендоплазматичного ретикулуму. Цей процес активується глюкозою, яка сприяє утворенню і-РНК проінсуліну та посилює процеси трансляції. Після біосинтезу проінсулін транспортується у цистерни апарату Гольджі, де проходить його конверсія в інсулін, при цьому від проінсуліну відщеплюється С-пептид під дією ферментів, що подібні до трипсину та карбоксипептидази В. С-пептид відщеплюється в гранулах b-клітин перед секрецією у кров, і виділяється у кількостях еквівалентних кількості інсуліну. Відомо декілька проміжних форм проінсуліну (інтермедіат - І, інтермедіат-ІІ). Біологічна активність проінсуліну становить 2-20% активності інсуліну. Специфічних проінсулінових рецепторів у тканинах не виявлено. Він сприяє метаболізму глюкози у жировій тканині та м’язах.
Молекула інсуліну побудована з двох поліпептидних ланцюгів: А-ланцюг вміщає 21, а В- ланцюг - 30 амінокислотних залишків. Обидва ланцюги пов'язані між собою двома дисульфідними мостиками між залишками цистеїну у положенні А7 та В7, А20 - В19. А -ланцюг має внутрішній дисульфідний зв’язок А6 - А4. У 1965 р. вперше проведений лабораторний синтез інсуліну. Виявлені видові особливості його будови. Найбільш близькими за своїм амінокислотним складом є молекули інсуліну людини, свині, собаки, кита, кроля, які відрізняються однією амінокислотою у положенні В30. Молекула інсуліну у просторі знаходиться у скрученому стані (вторинна та третинна структури молекули). Відщеплення однієї амінокислоти або заміна її з будь - якого кінця А-ланцюга веде до втрати активності інсуліну. У більшості організмів його полімеризація в підшлунковій залозі проходить навколо атома цинку, при цьому навколо кожного з 2-х атомів металу утворюється по 3 молекули. Ці цинк-інсулінові гексамери знаходяться у вигляді кристалів, що депонуються у b-клітинах. Гексамери вивільняються з b-клітин при відповідних значеннях рН середовища, дисоціюють на димери та мономери. Біосинтез інсуліну активується глюкозою.
39.Біологічний вплив адреналіну і нор-адреналіну на організм. Загальна характеристика.
Адреналін́, також епінефри́н — гормон та медіатор мозкової речовини надниркових залоз, що входить до групи фізіологічно активних речовин — катехоламінів. Лікарський препарат «Адреналін» відносять до адренергічних препаратів (адреноміметиків).

Адреналін
Прискорює і посилює серцебиття, спричинює звуження кровоносних судин, чим зумовлює підвищення кров'яного тиску, зумовлює розслаблення гладкої мускулатури бронхів і травної системи, підвищення обміну речовин. У медичній практиці розчин солянокислої солі адреналіну вводять підшкірно (а іноді й внутрішньовенно чи внутрішньосерцево) при глибоких розладах кровообігу (гемодинаміки), що бувають при захворюваннях серцево-судинної системи, колапсі, деяких видах шоку (зокрема при анафілактичному), при алергічних захворюваннях, астматичних приступах, деяких отруєннях.
У спокійному стані у людини адреналін виробляється, але значно у меншій кількості, ніж при стресах.
Норадреналін́ — гормон мозкової речовини наднирників і нейромедіатор. Належить до біогенних амінів, до групи катехоламінів. У жінок стимулює скорочення матки, у чоловіків збільшує периферичний судинний опір і систолічний та діастолічний тиск. Норадреналін — біогенний амін, що разом із адреналіном і дофаміном належать до катехоламінів. На відміну від адреналіну, який, здебільшого, проявляє гормональну активність, норадреналін є медіатором, що відіграє трансмітерну роль в адренергічних синапсах ЦНС та ПНС.
У головному мозку людини норадренергічні нейрони знаходяться, переважно, в зонах блакитної плями, гіпокампу та значній частині кори мозку. Функціональну роль норадреналіну як одного з основних медіаторів центральної нервової системи пов'язують із підтриманням рівня активності нервово-психічних реакцій, формуванням когнітивних та адаптивних процесів.
Адренорецептори широко розповсюдженні як у нервовій системі, так і в інших органах і тканинах. Існують декілька підтипів адренорецепторів, що розрізняються за своїми біохімічними, фізіологічними та фармакологічними властивостями.
Взаємодія лігандів (норадреналіну, адреналіну тощо) із бета-адренорецепторами супроводжується активацією аденілатциклази, збільшенням внутрішньоклітинної концентрації цАМФ і через систему цАМФ-залежних протеїнкіназ — стимуляцією відповідних метаболічних процесів та фізіологічних функцій клітини; прикладом таких реакцій є стимуляція адреналіном глікогенолізу в печінці та м'язах і ліполізу в жировій тканині.
У центральній нервовій системі адренорецептори локалізовані як на постсинаптичних мембранах, забезпечуючи передачу нервового сигналу на нейрон або ефекторний орган, так і на пресинаптичних мембранах, гальмуючи за негативним зворотним зв'язком вивільнення норадреналіну в синаптичну щілину.
Норадреналін має складні біохімічні та функціональні зв'язки на прета постсинаптичному рівнях із іншими нейромедіаторами та модуляторами функцій центральної нервової системи: ацетилхоліном, серотоніном, дофаміном, нейропептидами тощо.
42.За допомогою яких біологічно активних сполук відбувається травлення?
Їжа в травному апараті піддається механічній і хімічній обробці, ця обробка відбувається під впливом ферментів, до складових частин, які придатні до всмоктування в кишках і подальшого засвоєння в тканинах.
І. Ферменти шлункового соку:
пепсиногени – неактивні ферменти, які під дією соляної кислоти перетворюються в пепсині, що розщеплюють складні білки на більш прості та амінокислоти.
ліпаза шлунку – у дорослих не має великого значення, дещо активніша у дітей – впливає на природно емульговані жири (молоко).
желатиназа розщеплює білок желатин, що вміщується в сполучній тканині тваринних продуктів.
хімозин – разом з пепсином діє на білки молока (звурджує).
До складу слини входять ферменти: птіалін і мальтази (амілази), які розщеплюють крохмаль до моносахаридів, проте повного розщеплення ними не відбувається бо їжа в роті перебуває мало часу
(10-15 сек.).
Дванадцятипала кишка (duodenum) – порівняно короткий (25 см), але важливий відрізок, в якому здійснюється основне травлення. Реакція середовища лужна, нейтралізує кисле середовище шлункового вмісту, що поступає сюди. Сюди відкриваються протоки підшлункової залози і печінки. В 12-палій кишці багато різних ферментів: як своїх (ентерокіназа), так і тих, що поступають в складі жовчі та підшлункового соку. Ентерокіназа перетворює неактивний фермент трипсиноген в активний
– трипсин. Жовч наділена властивістю активізувати травні ферменти кишок, а також емульгувати жири, і таким чином, збільшує поверхню взаємодії ферментів (ліпаз) із жирами, полегшуючи їх розщеплення. Гормони жовчного міхура пригнічують жовчовиділення.
Кишкова фаза шлункової секреції полягає в тому, що стимулюючі імпульси на залози шлунка надходять з кишок. Такими факторами можуть бути речовини, що знаходяться у самій їжі (відвари м’яса, риби, овочів). Надходячи з кишок у кров вони по великому колу кровообігу потрапляють до залоз шлунка і стимулюють їхню діяльність. Гальмівний факт на шлункову секрецію здійснює гормон секретин, який утворюється у слизовій оболонці дванадцятипалої кишки і інші речовини що виробляються клітинами кишок.
45.За дії яких ензимів перетравлюються фосфоліпіди?
Фосфоліпіди гідролізуються групою ліполітичних ферментів, що називаються фосфоліпазами. Існує декілька типів фосфоліпаз (А1, А2, С і D), які гідролізують різні зв'язки в молекулі фосфоліпіду. Їхню дію показано на
прикладі лецитину
Під впливом панкреатичної фосфоліпази А2 (лецитинази) лецитин гідролізується з відщепленням залишку жирної кислоти R1 в -положенні і 54 перетворюється в лізолецитин. Останній є речовиною з досить сильною гемолітичною дією (він міститься в отрутах деяких змій). Однак під впливом іншого панкреатичного ферменту фосфоліпази А1 від лізолецитину відщеплюється друга молекула жирної кислоти, і він перетворюється на гліцерофосфорилхолін. Останній під впливом ферменту фосфоліпази D (гліцеролфосфорилхоліндиестерази) втрачає азотисту частину (холін) і перетворюється на гліцеринфосфорну кислоту, яка гідролізується фосфоліпазою С на гліцерин і фосфорну кислоту.
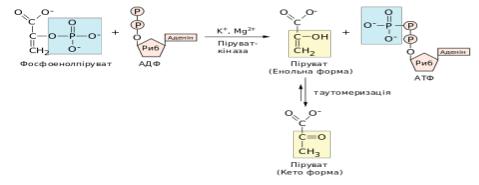
Гідроліз інших харчових фосфоліпідів-негліцеридів – сфінгофосфатидів, а також гліколіпідів не досить вивчений. Проте в стінці кишківника виявлені ферменти сфингомієлінази та церамідази. Перші з них гідролізують зв'язок, утворений фосфорною кислотою і сфінгозином у сфінгомієлінах, а другі – N-ацильний зв'язок у молекулі цераміду. Це призводить до звільнення сфінгозину, жирної кислоти і фосфохоліну.
48.Завершальна реакція анаеробного гліколізу.
Перенесення фосфатної групи із ФЕП на АДФ
Остання реакція гліколізу — перенесення фосфатної групи з фосфоенолпірувату на АДФ — каталізує її піруваткіназа за наявності іонів K+ та Mg2+ або Mn2+. Продуктом цієї реакції є піруват, який спочатку утворюється в енольній формі, після чого швидко й неферментативно таутомеризується в кетонну форму.
Реакція має велику від'ємну зміну вільної енергії, головним чином, завдяки екзергонічому процесу таутомеризації. Близько половини енергії (30,5 кДж/моль), що виділяється при гідролізі ФЕП (61,9 кДж/моль), використовується на субстратне фосфорилювання. Решта (31,5 кДж/моль) слугує рушійною силою, що штовхає реакцію в бік утворення пірувату та АТФ. За клітинних умов реакція є незворотною
51. Як функціонує ПФШ у тканинах з вираженим анаболізмом (у клітинах яких найінтенсивніше відбуваються синтези ліпідів, вільних нуклеотидів та нуклеїнових кислот)?
Пентозофосфатний шлях окислення глюкози має важливе фізіологічне значення для функціонування інших анаболічних (біосинтетичних) механізмів, а саме:
1)за рахунок функціонування пентозофосфатного шляху метаболізму глю-кози в організмі утворюється приблизно половина пулу НАДФН (решта — в результаті дії НАДФ-залежних ізоцитратдегідрогенази та малатдегідрогенази), що використовується у відновлювальних синтезах жирних кислот та стероїдів;
2)пентозо-фосфатний шлях є постачальником рибозо-5-фосфату, якийвикористовується для утворення нуклеотидів нуклеїнових кислот ДНК та РНК, коферментних біомолекул НАД (НАДФ), ФАД, АТФ, КоА, циклічних нуклеотидів 3',5'-АМФта 3',5'-ГМФ; У зв’язку із зазначеними біохімічними функціями, реакції пентозофосфатного шляху найбільш активно перебігають у тканинах із вираженим анаболізмом, у клітинах яких найбільш інтенсивно відбуваються синтези ліпідів, вільних нуклеотидів та нуклеїнових кислот — у жировій тканині, печінці, молочній залозі в період лактації, корі надниркових залоз, сім’яниках. У тканинах з переважанням окислювального метаболізму, зокрема скелетних м’язах, реакції пентозофосфатного шляху перебігають на дуже низькому рівні. Оскільки при циклічному функціонуванні пентозофосфатного шляху основним продуктом усього процесу є саме генерація НАДФН, ПФШ має характер метаболічного циклу в адипоцитах жирової тканини, де головною його функцією є саме генерація відновлювальних еквівалентів для синтезу ліпідів (тобто існує переважання потреб в НАДФН над потребами в пентозо-фосфатах). У решті клітині з високим анаболічним потенціалом (де відбувається активний
синтез як ліпідів, так і нуклеотидів) — тканини із збалансованими потребами в НАДФН та пентозофосфатах — пентозофосфатний шлях або закінчується на окислювальнійстадії, або переходить в гліколітичний шлях окислення глюкози на етапі утворення тріозофосфатів;
54. Підвищується чи знижується рівень секреції глюкагону за гіпоглюкоземії, гіпоглікемії? Загальна характеристика процесів за даного стану організму.
Глюкаго́н — гормон альфа-клітин острівців Лангерганса підшлункової залози. За хімічною будовою глюкагон є пептидним гормоном. Також він є одним із антагоністів інсуліну, сприяє утворенню глюкози в печінці.
Нормальна секреція гормону забезпечує надійний контроль за підтриманням сталості рівня глюкози крові. Нестача інсуліну при цукровому діабеті супроводжується надлишком глюкагону, який, власне, і є причиною гіперглікемії. Значне збільшення концентрації глюкагону в крові є ознакою глюкагономи — пухлини α-клітин. Майже у всіх випадках порушується толерантність до глюкози і розвивається цукровий діабет. Діагностика захворювання заснована на виявленні в плазмі крові дуже високої концентрації глюкагону. У новонароджених, якщо мати хвора на діабет, порушена секреція глюкагону, що може відігравати важливу роль у
розвитку неонатальної гіпоглікемії. Гіпоглікемічна стимуляція викиду глюкагону відсутня у хворих на цукровий діабет I типу. Дефіцит глюкагону може відображати загальне зниження маси тканини підшлункової залози, викликане запаленням, пухлиною або панкреатектомією. При дефіциті глюкагону виявляють відсутність підйому його рівня в тесті стимуляції аргініном.
57. Вплив соматотропіну (гормону аденогіпофіза) на глюконеогенез у печінці? Дати загальну характеристику.
Гормон росту (соматотропін, соматотропний гормон, СТГ) - один з гормонів, що виробляється аденогіпофізом (передньою долею гіпофізу). Особливістю гормону є його сильно виражена видова специфічність. Це означає, соматотропін тварин не має дії на людину.
На обмін вуглеводів С.г. діє протилежно до інсуліну: його введення викликає гіперглікемію, зумовлену посиленням глюконеогенезу в печінці та зниженням периферичної утилізації глюкози. С.г. викликає мобілізацію ліпідів у жировій тканині, підвищує вміст вільних карбонових кислот у крові та їх окиснення в печінці. С.г. сполучається з лактогенними рецепторами і має певні властивості пролактину. Виявлено, що С.г. багато своїх ефектів реалізує не сам, а через соматомедини — сполуки пептидної природи.
60. Які етапи аконітазної реакції ЦТК (в цілому)? Субстрати, інтермедіати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
Цикл трикарбо́нових кисло́т (цикл Кре́бса, цитра́тний цикл) — центральна частина загального шляху катаболізму, циклічний біохімічний процес аеробних організмів, в ході якого відбувається перетворення двох- і трьохвуглецевих сполук, що утворюються як проміжні продукти в живих організмах при розпаді вуглеводів, жирів і білків, до CO2. При цьому звільнений водень прямує в ланцюг тканинного дихання, де надалі окислюється до води, беручи безпосередню участь в синтезі універсального джерела енергії — АТФ.

63. Сукцинілтіокіназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
65. ФАД-залежна сукцинатдегідрогеназна реакція ЦТК. Субстрати і продукти вказаної реакції та клас ензиму і його загальна характеристика.
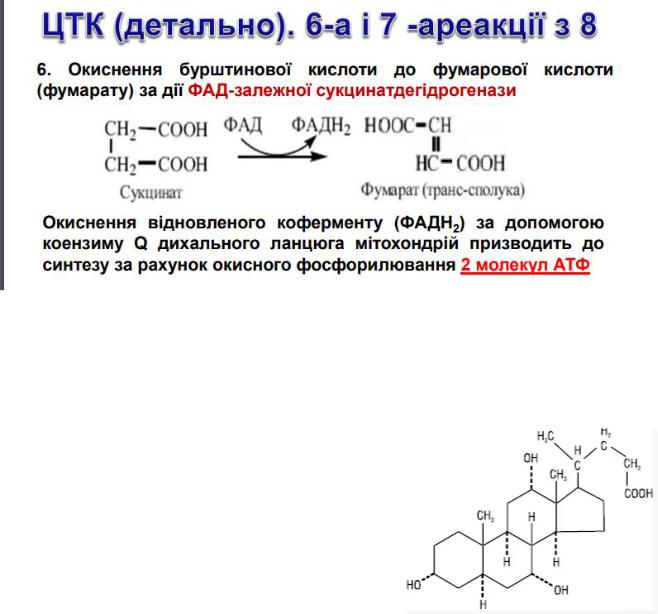
68. Де переважно локалізовані ензими клітинного дихання?
71. Роль холевої кислоти у перетравленні ліпідів. Загальна характеристика.
КИСЛОТИ ЖОВЧНІ — стероїдні сполуки з 24 атомами карбону, похідні холанової кислоти, що мають від однієї до трьох гідроксильних груп і бічний ланцюг з 5 атомів карбону з карбоксильною групою на кінці ланцюга. В організмі людини найбільш важливою є холева кислота.
У жовчі при слабколужному рН вона присутня у вигляді холат-аніону. Інші дві кислоти, дезоксихолева і літохолева, називаються вторинними, оскільки вони утворюються шляхом дегідроксилювання по С-7
первинних кислот у ШКТ. У печінці утворюються кон’югати жовчних кислот . з амінокислотами (гліцином або таурином), з’єднані пептидним зв’язком. Ці кон’югати є більш сильними кислотами і присутні в жовчі у формі солей (холатів і дезоксихолатів Na+ і К+, що називаються солями К.ж.). Оскільки жовч містить значну кількість іонів натрію та калію і має лужну реакцію, заведено розглядати К.ж. та їх кон’югати у формі солей, звідки і виник термін «жовчні солі».
Жовчні кислоти надходять з жовчю в кишечник у вигляді глікохолевої і таурохолевої кислот.Жовчні кислоти мають властивості детергентів, тобто за рахунок високої поверхневої активності забезпечують емульгування жирів і тим самим поліпшують їхнє травлення і засвоєння, активують ліпазу — фермент, що розщеплює жири. Первинні і вторинні К.ж. всмоктуються в клубовій кишці, а 98–99% ЖК що надійшли до кишечнику, повертаються через систему ворітної вени в печінку. Цей цикл називається кишково-печінковою циркуляцією.
74. Особливості травлення жирів у немовлят (щодо наявності ензимів у різних відділах шлунково-кишкового тракту). Загальна характеристика.
Шлунок:
У новонароджених дітей рівень рН у шлунку високий, майже нейтральний 6,5 – 8,0, на протязі 4-5 годин після народження кислотність швидко наростає до 2-3,5 (імовірно під впливом гастрину материнської крові, що переходить до дитини трансплацентарно), і знову знижується до рН 3- 5. Пепсин виділяється у неактивній формі (пепсиноген) і активується соляною кислотою. У дітей раннього віку виділяється велика кількість катепсину ферменту, який поряд з гастриксином,
здійснює згортання молока. Жири під впливом ліпази розщеплюються до гліцеролу і жирних кислот. У дорослих шлункова ліпаза не має особливого значення, оскільки вона діє на емульговані жири,
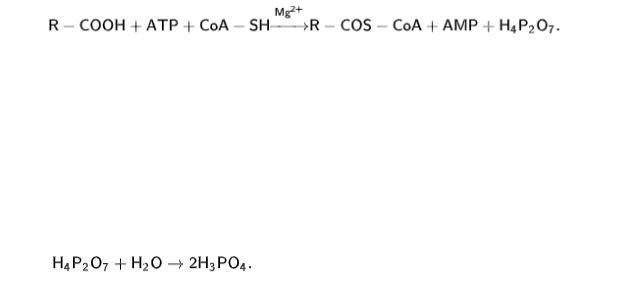
однак у дітей вона розщеплює до 25% молочного жиру, який вже знаходиться в емульгованому стані. У немовлят, які знаходяться на природному вигодовуванні, перетравлювання жирів відбувається і під впливом молочної ліпази, якої достатньо у грудному молоці.
З шлунка їжа потрапляє до 12-палої . У 12-палій кишці під впливом жовчі, соку підшлункової залози і , швидко міняється її рН і продовжується гідроліз за участі протеолітичних, амілолітичних і ліполітичних ферментів. Гідролітичні процеси завершуються мембранним травленням, що створює умови до всмоктування продуктів гідролізу, вітамінів, мінеральних речовин, води.
Подальше травлення і всмоктування його продуктів проходить у тонкій кишці. Перетравлювання і всмоктування емульгованих дією жовчі жирів відбувається в основному в тонкій кишці під впливом, причому найбільш інтенсивно у голодній кишці (95%). Гідроліз жирів здійснюється ліпазами соку підшлункової залози і слизової .
77. Бета-окиснення ЖК: що відбувається за реакції, яку каталізує ацил- КоА-синтетаза (тіокіназа) (субстрати, продукти, коензтм; назва реакції за перетворенням, що відбувається)?
Активація жирних кислот
Жирні кислоти, які утворилися в клітині шляхом гідролізу триацилгліцеридів або надійшли в неї з крові повинні бути активовані, так як самі по собі вони є метаболічними інертними речовинами, і внаслідок цього не можуть бути схильні до біохімічних реакцій, включаючи і окислення. Процес їх активування відбувається в цитоплазмі за участю АТФ, коферменту A (HS-СoA) і іонів Mg2 +. Реакція каталізується ферментом ацил-КоА-синтетазою жирних кислот з довгим ланцюгом, процес є ендергонічним, тобто протікає за рахунок використання енергії гідролізу молекули АТФ:
ацил-КоА-синтетази знаходяться як в цитоплазмі, так і в матриксі мітохондрій. Ці ферменти відрізняються по специфічності до жирних кислот з різною довжиною вуглеводневого ланцюга. Жирні кислоти з короткою і середньою довжиною ланцюга (від 4 до 12 атомів вуглецю) можуть проникати в матрикс мітохондрій шляхом дифузії. Активація цих жирних кислот відбувається в матриксі мітохондрій
Жирні кислоти з довгим ланцюгом, які переважають в організмі людини (від 12 до 20 атомів вуглецю), активуються ацил-КоА-синтетазами, розташованими на зовнішній стороні зовнішньої мембрани мітохондрій.
Пірофосфат, що виділився в ході реакції гідролізується ферментом пірофосфатазою (КФ 3.6.1.1)
При цьому відбувається зсув рівноваги реакції в бік утворення ацил-КоА.
Оскільки процес активації жирних кислот відбувається в цитоплазмі, то далі необхідний транспорт ацил-КоА через мембрану всередину мітохондрії.
80. Яке значення амінотрансфераз АсАТ і АлАТ? Загальна характеристика реакції, навести приклад з назвами субстратів і продуктів.
Амінотрансферази (англ. aminotransferases; синонім: трансамінази) — підклас ферментів з класу трансфераз, що каталізує реакції трансамінування, тобто перенесення α-аміногрупи від амінокислоти на α-вуглецевий атом α-кетокислоти — акцептора аміногрупи. У результаті реакції утворюється α- кетоаналог вихідної амінокислоти та нова амінокислота. Назва окремої амінотрансферази складається з назви амінокислоти, що крім глутамату, є субстратом чи продуктом реакції та слова амінотрансфераза[2].

Аланін- (АлАТ) та аспартатамінотрансфераза (АсАТ) є представниками даної групи ферментів, яким притаманний найвисокий рівень активності, який можливо визначити у відповідних реакціях.
Аспартатамінотрансфераза (L-аспартат: 2-оксоглутарат-амінотрансфераза, АсАТ або назва, яка використовується рідше, – глутаматоксалоацетат-трансаміназа (ГОТ); КФ 2.6.1.1). АсАТ каталізує оборотну реакцію перенесення аміногрупи від аспарагінової кислоти на α-кетоглутарат із утворенням оксалоацетату та глутамінової кислоти.
Аланінамінотрансфераза (КФ 2.6.1.2. L-аланін: 2-оксоглутаратамінотрансфераза, АлАТ або назва, яка використовується рідше - глутаматпіруваттрансаміназа (ГПТ)). АлАТ – фермент, що каталізує перенесення аміногрупи від аланіну на α-кетоглутарат із утворенням пірувату та глутамінової кислоти.
Амінотрансферази каталізують процеси трансамінування, вони розподілені по всіх органах і тканинах. АсАТ має2 ізоферменти, локалізовані якуцитозолі – ц-АсАТ (при електрофоретичному розділенні рухається до анода), так і в мітохондріях – м-АсАТ (при електрофорезі мігрує до катода), АлАТ – переважноцитоплазматичний фермент, його мітохондріальна форма нестабільна, її вмістуклітині низький. Роль коферментув трансаміназних реакціяхвідіграє піридоксальфосфат (похідне вітамінуВ6).
АсАТ у високих концентраціях наявний у клітинах серцевого й скелетного м’язів, печінці, нирках, нервовій тканині, підшлунковій залозі й еритроцитах. Ураження будь-якого з цих органів і тканин може призвести до істотного підвищення АсАТусироватці крові.
АлАТу високих концентраціях наявний у клітинах печінки та меншою мірою у скелетних м’язах, нирках і серці. Підвищення активності АлАТ найчастіше відмічається при гострих захворюваннях печінки та жовчних шляхів. Активність АлАТ різко підвищується у хворих на гострі вірусні гепатити в ранні терміни хвороби: приблизно у 50 % хворих вона збільшується за 5 днів до появи жовтяницітагепатомегалії, у 90 % хворих – за 2 дні до появи цих симптомів.
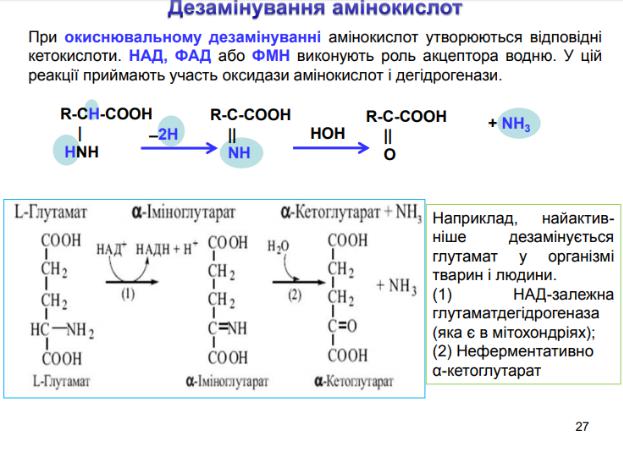
83. Які продукти утворюються у реакціях дезамінування амінокислот? Загальна характеристика реакції, навести приклад з назвами субстратів і продуктів.
Дезамінування амінокислот – це відокремлення аміногрупи від амінокислоти у вигляді аміаку. Є 4 типи дезамінування: окиснювальне (частіше такому дезамінуванню підлягає глутамінова кислота); гідролітичне (наприклад, дезамінування АМФ, глутаміну); внутрішньомолекулярне (дезамінування гістидину до урокаїнової кислоти); відновлювальне (наприклад, дезамінування ГМФ)
Окислювальне дезамінування глутамату. Це один з важливих шляхів утворення аміаку в організмі, оскільки глутамінова кислота є транспортною формою аміаку. Дезамінування відбувається в два етапи (ферментативний і неферментативний): 1) утворюється α-іміноглутарат за участі НАД-залежної глутаматдегідрогенази, 2) неферментативний гідроліз призводить до утворення α-кетоглутарату і аміаку
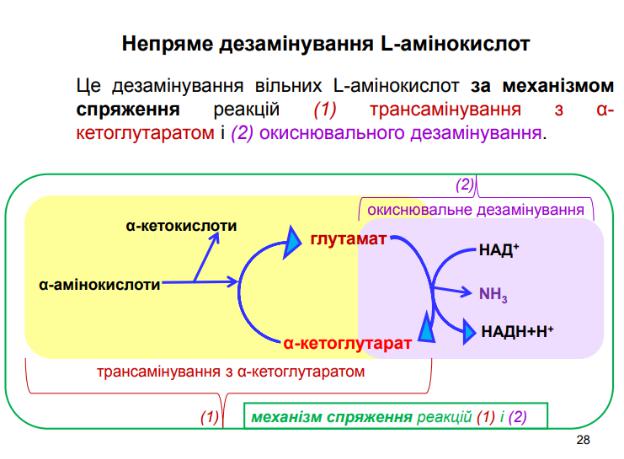
86. Аргіназна реакція орнітинового циклу (субстрати і продукти). Загальна характеристика класу відповідного ензиму і його типової реакції.
В організмі ключовим ферментом, що впливає на доступність та трансформацію аргініну клітинам за межами кишечнику, є аргіназа.Аргіназа відноситься до КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. В останній реакції циклу сечовини на аргінін діє фермент аргіназа, що розщеплює його до сечовини та орнітину. Орнітин переноситься у
матрикс мітохондрій та вступає у наступний оберт циклу сечовини. Існує дві ізоформи аргінази, що мають практично однакову ензиматичну активність. Аргіназа I – цитоплазматичний фермент циклу сечовини, його експресія відбувається майже винятково в гепатоцитах. Аргіназа II – мітохондріальний фермент, що у невеликих кількостях представлений у нирках, мозку, тонкій кишці, молочних залозах, макрофагах, проте майже відсутня в печінці. Її роль, ймовірно, полягає у регуляції доступу аргініну для інших шляхів його катаболізму, зокрема вона може обмежувати доступність субстрату для синтезу NO, зібльшувати кількість орінтину, необхідного для
утворення поліамінів (путресцину, спермідину та сперміну) та проліну.
89.Які кінцеві катаболічні продукти пуринових нуклеотидів? Назвати продукти. Значення такого катаболічного процесу.
Кінцевим продуктом катаболізму пуринів є сечова кислота. Метаболічний шлях утворення сечової кислоти дослідив український вчений І. Я. Горбачевський. Він вперше здійснив хімічний синтез сечової кислоти та відкрив ксантиноксидазу – фермент катаболізму пуринів
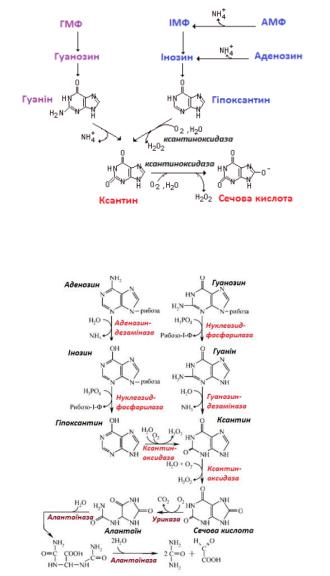
У деяких живих організмів присутні ферменти, що каталізують окиснення сечової кислоти до сечовини та гліоксилевої кислоти, яка в подальшому розщеплюється до СО2 і Н2О.
У риб та амфібій кінцевим продуктом катаболізму пуринів є сечовина. У ракоподібних та морських безхребетних під дією уреази сечовина гідролізуєтья до СО2 і NH3. У водних організмів NH3 вимивається водою і тому не здійснює токсичну дію. Наземні організми втратили ферменти катаболізму сечової кислоти, оскільки накопичення NH3 призводить до отруєння. Головним ферментом катаболізму пуринів є ксантиноксидаза, що каталізує окиснення гіпоксантину до ксантину з подальшим утворенням сечової кислоти. В реакціях, каталізованих ксантиноксидазою, електрони переносяться від субстрату безпосередньо на О2 з утворенням Н2О2. Найвищий вміст ксантиноксидази виявлений у клітинах печінки та слизової оболонки кишечника
92. Які сполуки слугують своєрідним джерелом атомів пурину? Назвати відповідні сполуки та вказати значення цього процесу.
Азотисті основи в НК є похідними ароматичних гетероциклічних компонентів пурину (purine) і піримідину (pyrimidine). Біосинтез цих молекул є складним та життєво необхідним майже для всіх клітин.

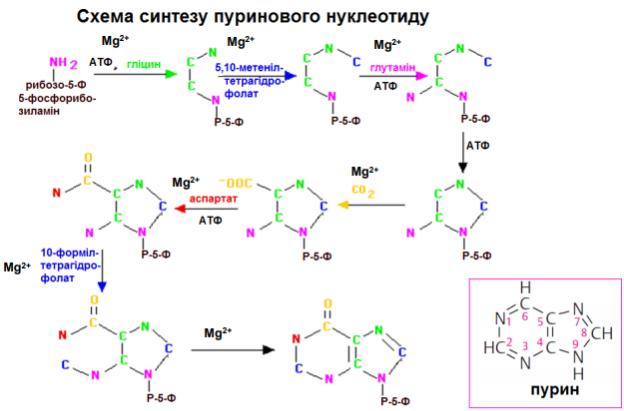
Регулювання метаболізму пуринів має фармактерапевтичну цінність. Інгібітори пуринового синтезу інгібують проліферацію клітин, особливо лейкоцитів. Ці інгібітори включають азатіоприн (azathioprine) – імунодепресант, який використовується при трансплантації органів, аутоімунних захворювань таких як ревматоїдний артрит чи захворювань запалення кишечника: захворювання Крона (Crohn's disease) та виразкові коліти (ulcerative colitis). Мікофенолат мофетіл (Mycophenolate mofetil) імунодепресант, який використовується з метою запобігання відторгнення при трансплантації органів; він інгібує синтез пуринів, блокуючи інозинмонофосфатдегідрогеназу. Метотріксейт (Methotrexate) опосередковано інгібує синтез пуринів блокуванням метаболізму
фолієвої кислоти (він є інгібітором дигідрофолатредуктази).
93. Які сполуки слугують своєрідним джерелом атомів піримідину? Назвати відповідні сполуки та вказати значення цього процесу.
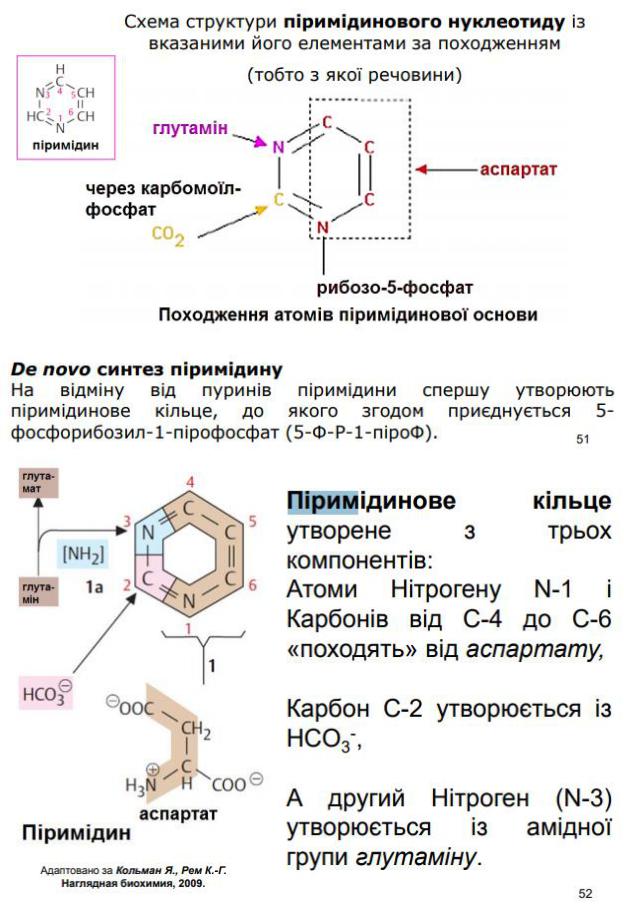
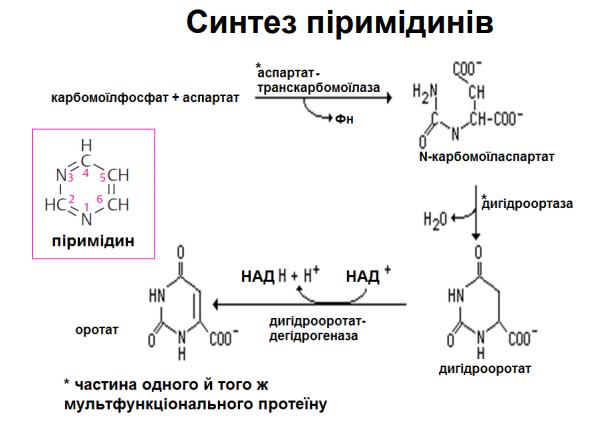
Регулювання піримідинового метаболізму фармакологічно має терапевтичне застосування. Інгібітори піримідинового синтезу використовуються за активного «пом’якшання» гострого ревматоїдного артриту та
псоріатичного артриту. Такими інгібіторами є лефлуномід (Leflunomide) та теріфлуномід (Teriflunomide).
96. Який продукт утворюється внаслідок реплікаційного процесу? Загальна характеристика процесу та утвореного продукту.
Реплікація — складний багатоетапний процес, в якому приймають участь багато ферментів, він потребує багато часу та великих енергетичних витрат клітини. Процес починається з того, що фермент топоізомераза випрямляє закручену у спіраль молекулу ДНК та до неї приєднуються білки, які не дають молекулі знов згорнутись. Фермент геліказа розриває водневі зв'язки між азотистими основами, внаслідок чого ділянка подвійної молекули ДНК розпадається на два ланцюги, утворюється так звана "виделка реплікації». До ланцюга приєднується ДНКпраймаза — фермент який розпочинає синтез ДНК — власне реплікацію. Вона синтезує праймер — послідовність нуклеотидів, від якої наступний фермент — ДНК-полімераза, будує новий ланцюг, використовуючи наявний як матрицю. Праймером слугує фрагмент РНК, він потрібний, тому що ніяка ДНК-полімераза не може почати синтез нового ланцюжка «з нуля», а може тільки додати нуклеотиди до існуючого ланцюжка. Коли праймер виконав свою функцію, він видаляється екзонуклеазою, а інша полімераза "забудовує" пусте місце, яке виникло. Також ДНК-полімераза здатна виправляти можливі помилки реплікації та перевіряти комплементарність. Синтез нових ланцюгів відбувається асиметрично, тобто один з них синтезується безперервно, по ходу роз'єднання молекули ДНК геліказою, інший ланцюг будується в протилежному напрямку — проти напрямку дії гелікази, тому відбувається короткими фрагментами, довжиною 1000 — 2000 нуклеотидів, котрі називаються фрагменти Оказакі, на честь японського вченого, який їх відкрив. Фрагменти Оказакі з'єднує між собою фермент ДНК-лігаза. Таким чином, з однієї молекули ДНК утворюються дві ідентичні, які після закінчення процесу реплікації спіралізуються.
