
Лекция 2 Первичная структура белков
Пептиды
В 1902 г. Эмиль Фишер установил, что отдельные аминокислоты связываются в белках посредством пептидных связей.
Д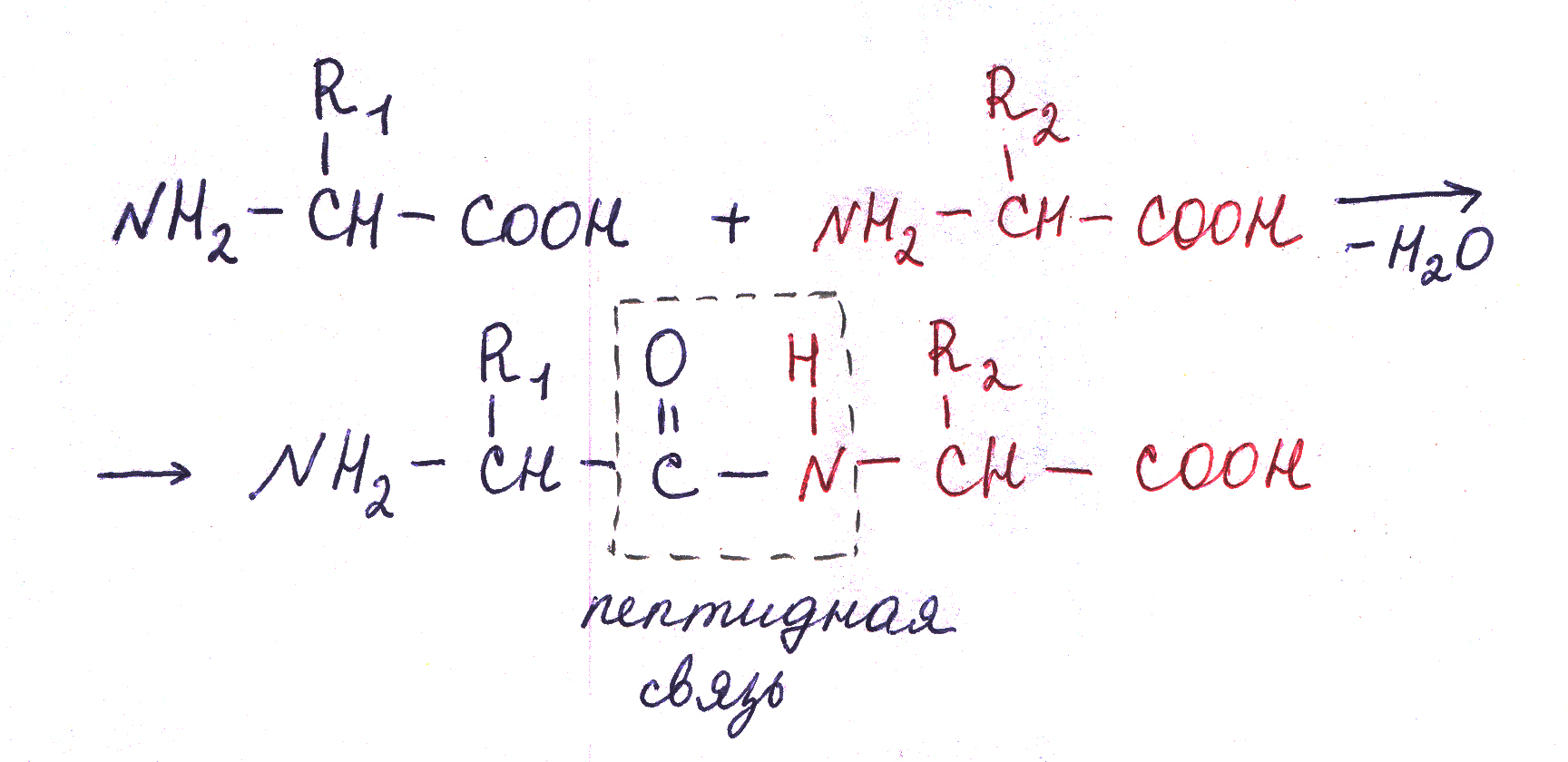 ве
аминокислоты могут ковалентно связываться
друг с другом при помощи замещенной
амидной связи, называемой пептидной
связью с образованием
дипептида.
Пептидная
связь возникает в результате отщепления
компонентов молекулы воды от карбоксильной
группы одной аминокислоты и аминогруппы
другой.
ве
аминокислоты могут ковалентно связываться
друг с другом при помощи замещенной
амидной связи, называемой пептидной
связью с образованием
дипептида.
Пептидная
связь возникает в результате отщепления
компонентов молекулы воды от карбоксильной
группы одной аминокислоты и аминогруппы
другой.

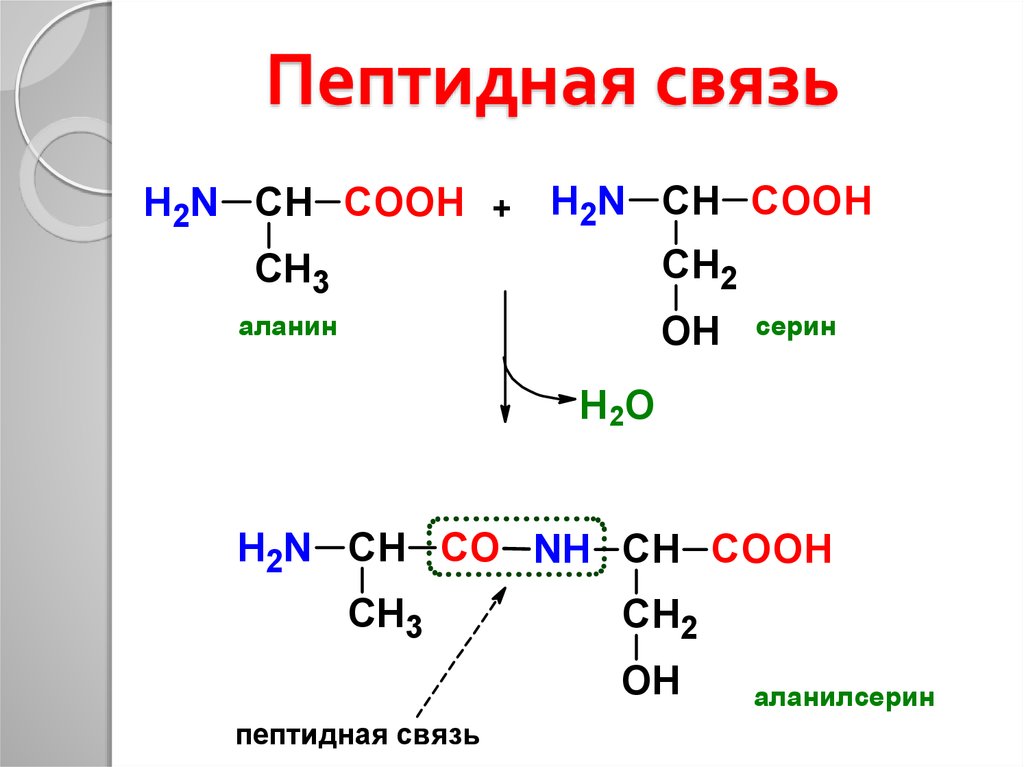
Точно также можно получить тетрапептиды, пентапептиды и т.д. Несколько аминокислотных остатков, соединенных таким образом в цепочки, образуют олигопептиды, большое число – полипептиды.
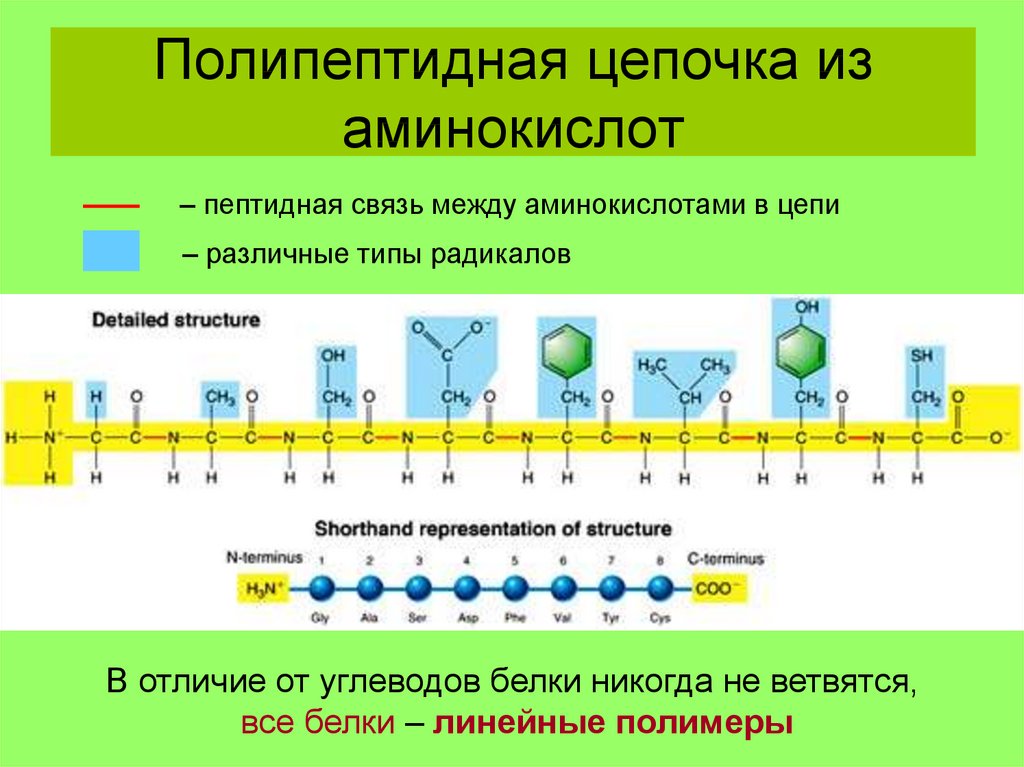
Далее представлена структура полипептида. Аминокислотные звенья в пептидах называют остатками (оставшимися после ухода водорода и гидроксильной группы). Аминокислотный остаток, находящийся на том конце полипептида, где расположена свободная аминогруппа , называется N-концевым остатком, а остаток на противоположном конце цепи, несущем свободную карбоксильную группу – С-концевым остатком.
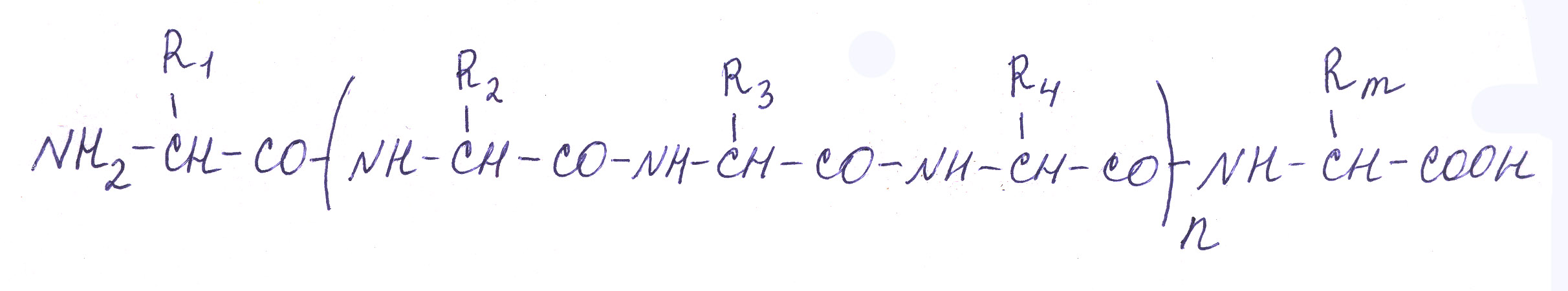
N-конец С-конец
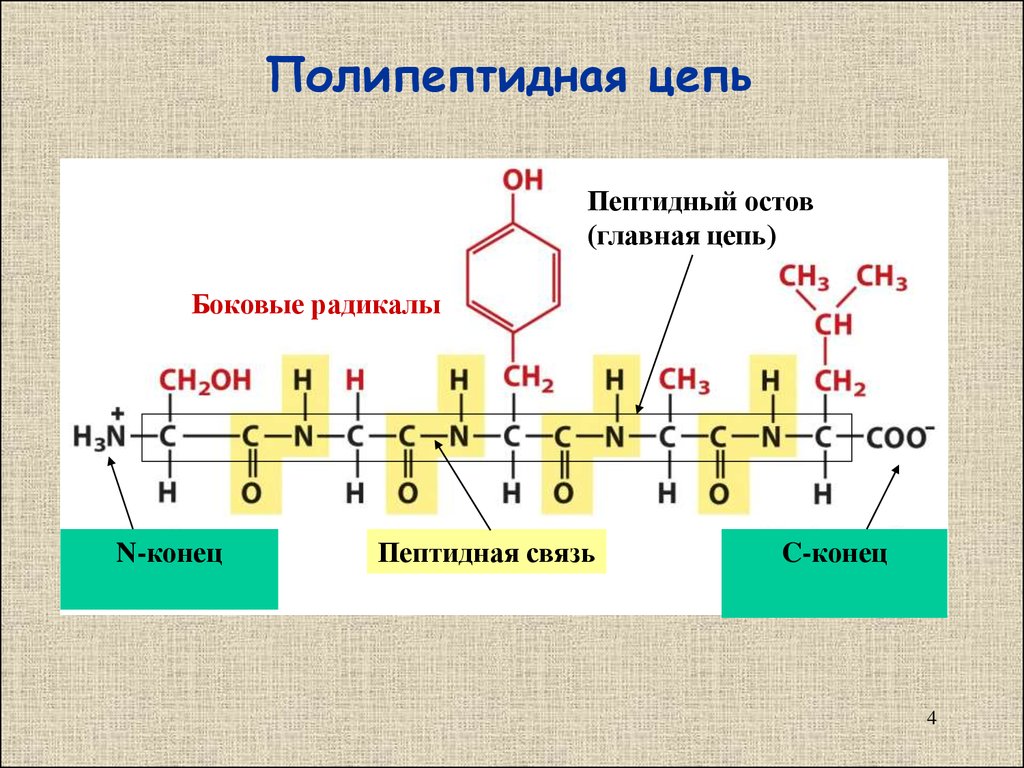
Остов (хребет) полипептида
В остове полипептида чередуются три вида химических групп: -СО, -СН и –NН. Каждая третья связь – пептидная. Остов у всех полипептидов (белков) одинаков. Полипептидная цепь пишется с N-конца трехбуквенными обозначениями. Если известна последовательность, то между названиями аминокислот пишется тире, если последовательность аминокислот не известна, то пишем их через запятую. Так как полипептиды состоят из аминокислотных остатков, окончание –ин в их названиях заменяется на окончание –ил.
2. Первичная структура белков
Последовательность соединения аминокислот в белковой молекуле называется первичной структурой.
Первичная структура каждого белка уникальна и кодируется генетически.
Каждый белок характеризуется определенным числом и последовательностью аминокислотных остатков.
Знание структуры очень важно. Это основа, из которой будут формироваться следующие уровни организации белковой молекулы и определяться её свойства. Именно первичная структура белка определяет пространственную (трехмерную) структуру, которая в свою очередь отвечает за функции белка
Для чего важно знать первичную структуру белка?
1. Для изучения пространственной структуры белков.
2. Для выяснения проблем, связанных с синтезом белка и механизмом действия генов.
3. Для исследования механизмов эволюции белков от низших организмов к высшим.
4. Для выяснения природы наследственных заболеваний.
В хребте полипептидной цепи – каждая 3-я связь – пептидная, она обладает особыми свойствами, важными для формирования пространственной структуры белков.
Пептидная связь более короткая, чем обычная одинарная связь. (Из курса Органической химии вы знаете, что двойная связь является более короткой по сравнению с одинарной связью).
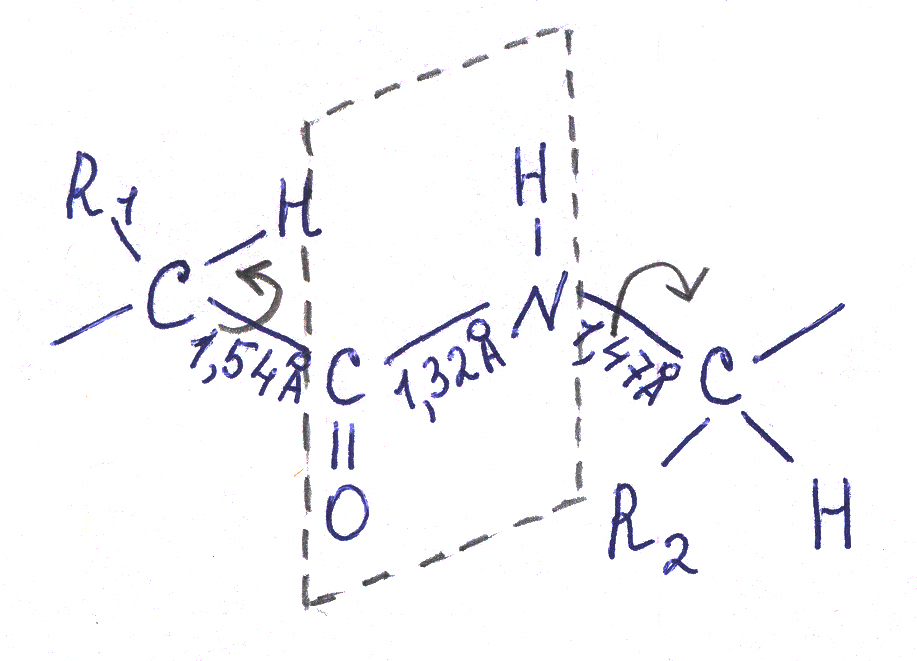
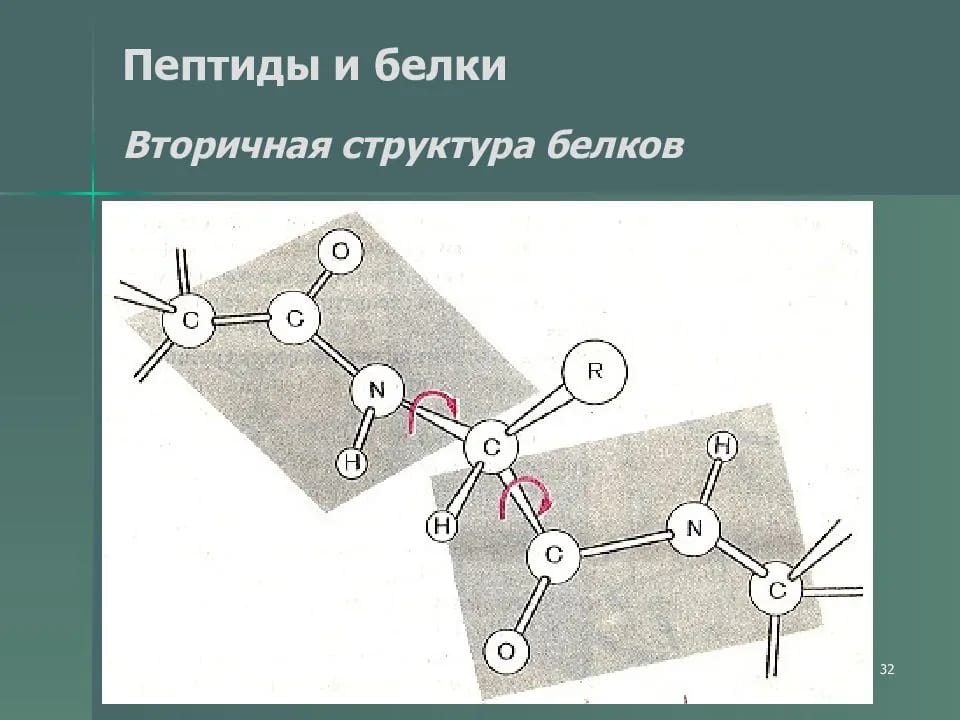
Таким образом, пептидная связь имеет частичный характер двойной связи. Вокруг двойной связи вращений нет, и здесь оно затруднено (в отличие от обычных одинарных связей, которые свободно вращаются). Она имеет плоский (планарный) характер. Атомы кислорода О и водорода Н находятся в транс-положении. Далее полипептидная цепь должна сформировать определенную достаточно устойчивую пространственную структуру. Если в белке вокруг каждой третьей связи (пептидной) вращение не происходит, то структура становится гораздо более устойчивой. Это играет важную роль в стабилизации пространственной структуры белка.
Когда была выяснена первичная структура белков?
Впервые первичная структура белка была изучена Фредериком Сенджером в 1953 г. на примере инсулина (51 аминокислота). Незаурядный человек, он потратил на это 10 лет жизни! Эта 51 аминокислота могла объединяться в миллиарды вариантов!
Затем были изучены рибонуклеаза (124 а.к.), лизоцим (130 аминокислотных остатков (слюна, слёзы), гидролизует клеточные стенки бактерий и проявляет бактерицидные свойства). Но имена этих учёных в историю не вошли. Наиболее крупным из изученных белков являлся иммуноглобулин – 1300 аминокислотных остатков. Авторы, установившие первичную структуру этого белка, также были удостоены Нобелевской премии ввиду высокой важности этого белка.
В настоящее время изучение первичной структуры – рутинная процедура, и созданы специальные приборы – секвенаторы.
