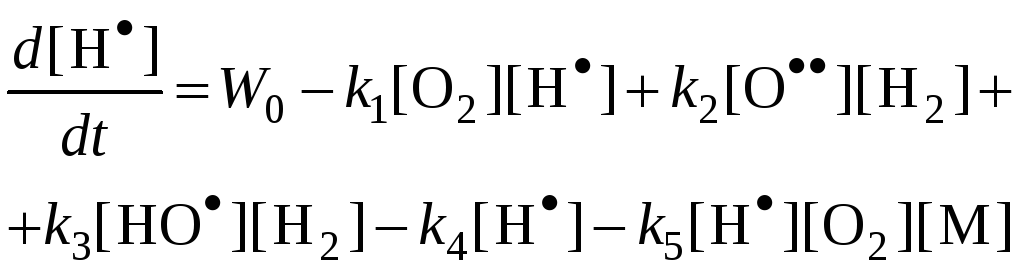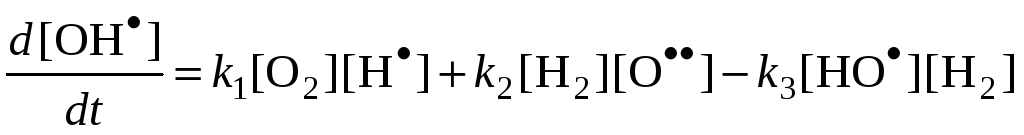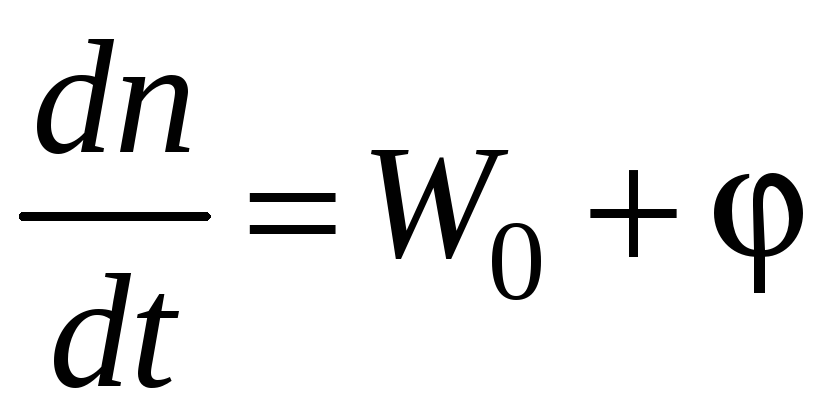Кинетика разветвленных цепных реакций
.doc
Кинетика разветвленных цепных реакций
К таким реакциям относятся реакции окисления молекулярным кислородом H2, P, PH3, SiH4, CS2, CO.
Рассмотрим ее на примере окисления H2.
При небольших давлениях (несколько десятков мм. рт. ст.) схема реакции:
|
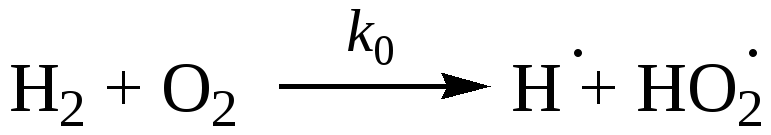
|
(зарождение W0) |
|
|
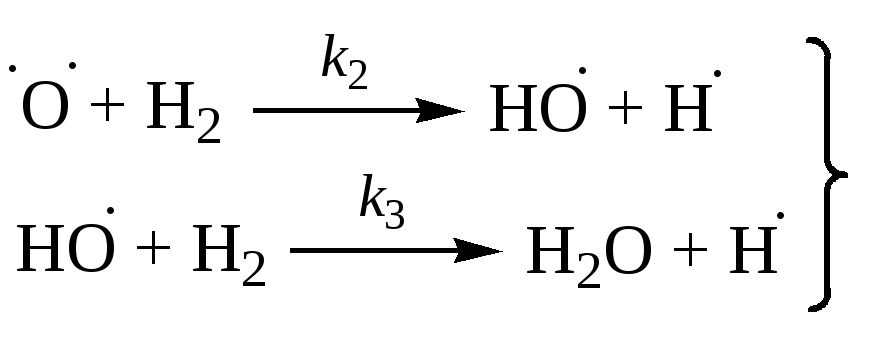
(разветвление) |
|
|
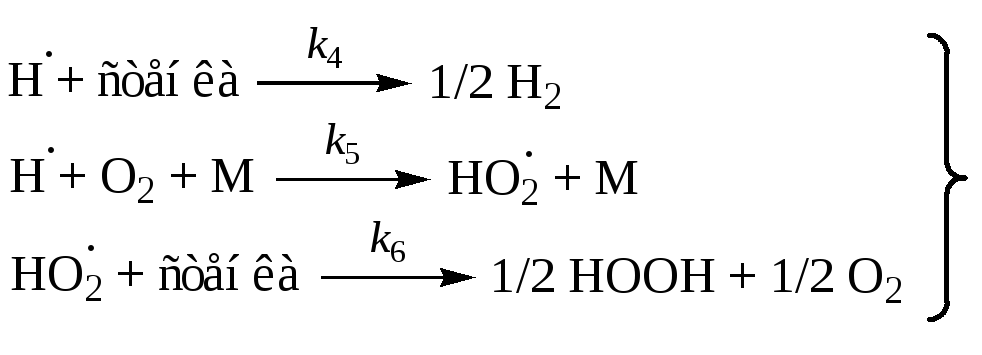
(продолжение) |
|
|
(обрыв) |
Радикал HO2 при малых давлениях и температурах неактивен в продолжении цепей, поэтому реакция (5) – обрыв цепей. Тогда реакцию (6) можно исключить из рассмотрения.
[O] и [OH] << [H], поэтому обрыв с участием этих частиц принебрежим по сравнению с реакциями (4) и (5).
|
|
(1) |
|
|
(2) |
|
|
(3) |
H.H. Семенов предложил метод полустационарных концентраций, по которому в нестационарных условиях можно считать концентрации всех активных центров стационарными, кроме одного, концентрация которого намного больше остальных.
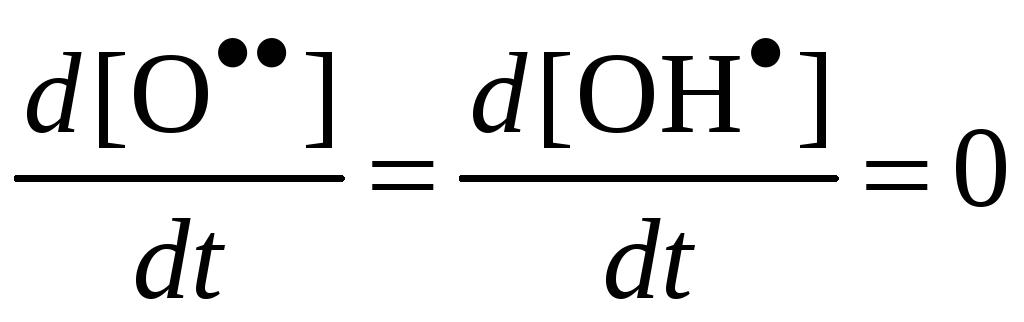 ;
;
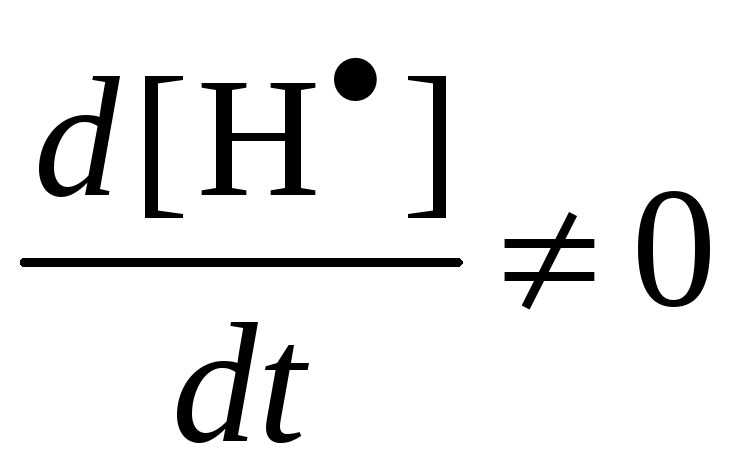
Из (3):
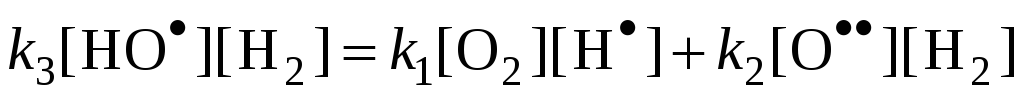
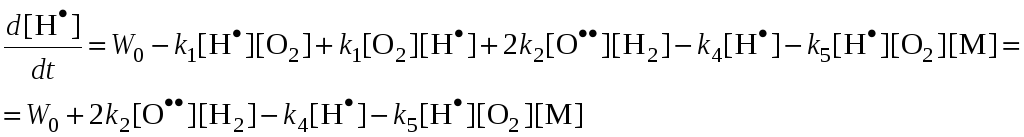
Из (2):
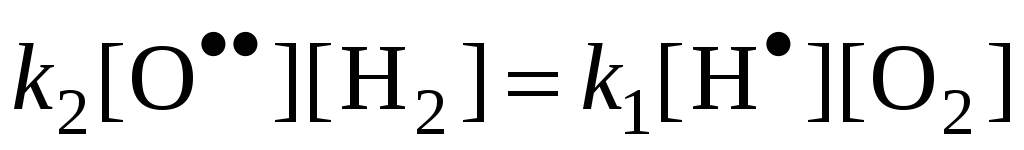

Обозначим:
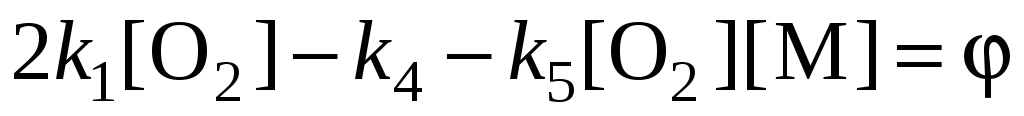 ,
тогда
,
тогда
|
|
– разность удельных скоростей разветвления и обрыва цепей (эффективных констант разветвления и обрыва).
= f – g - фактор автоускорения.

Если g > f, т.е. < 0, то в системе устанавливается стационарная концентрация радикалов.
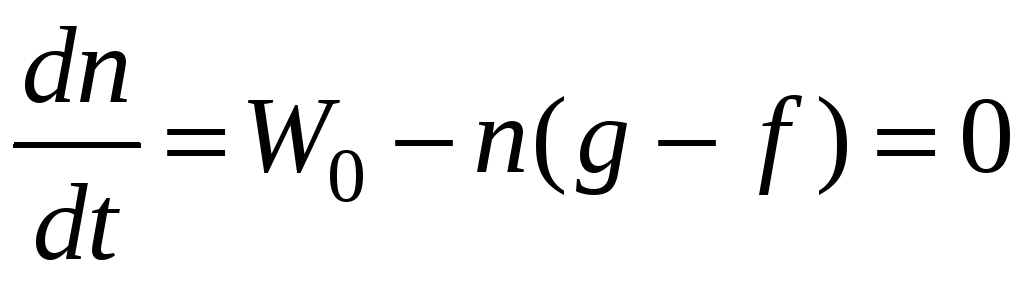 ;
;
 .
.
Наличие разветвления лишь несколько увеличивает стационарную концентрацию радикалов по сравнению с f = 0.
Если f > g,
т.е. > 0,
то, интегрируя уравнение
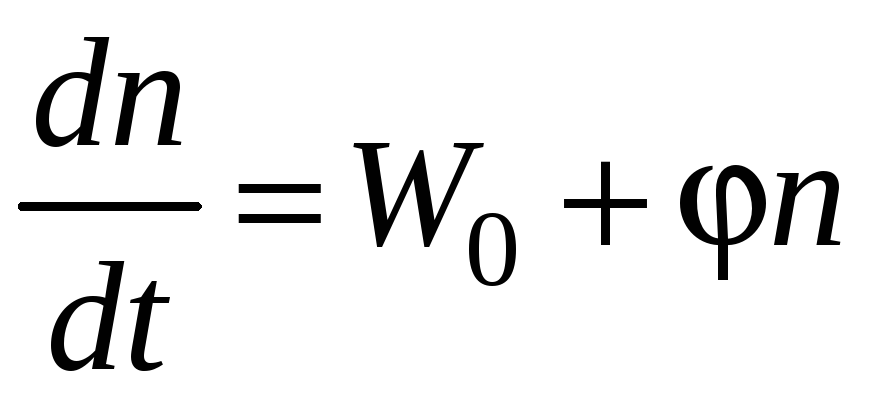 ,
,
получаем.

В этом случае имеет место прогрессивное нарастание концентрации свободных радикалов, и, следовательно, и скорости процесса: через каждые 1/ секунд скорость реакции возрастает в «e» раз. Таким образом, через несколько интервалов 1/ практически полное отсутствие реакции сменяется взрывным протеканием процесса, т.е. вслед за периодом индукции следует цепное воспламенение.

Естественно, что
при цепном воспламенении кинетику
нельзя считать стационарной, но по
методу Н.Н. Семенова удается проводить
расчеты при
 .
.
Предельные явления в разветвленных цепных реакциях
Характерная особенность разветвленной цепной реакции – наличие предельных явлений.
Если обрыв быстрее разветвления (g > f) – стационарная реакция.
Если разветвление быстрее обрыва (f > g) – нестационарное автоускорение с цепным воспламенением.
Переход от (g > f) к (f > g) может происходить при незначительном изменении одного из параметров, определяющих скорость обрыва и разветвления: давления, температуры, состава смеси, размера реакционного сосуда, состояния стенок.
В связи с этим для реакции окисления водорода установлены пределы воспламенения или взрываемости.
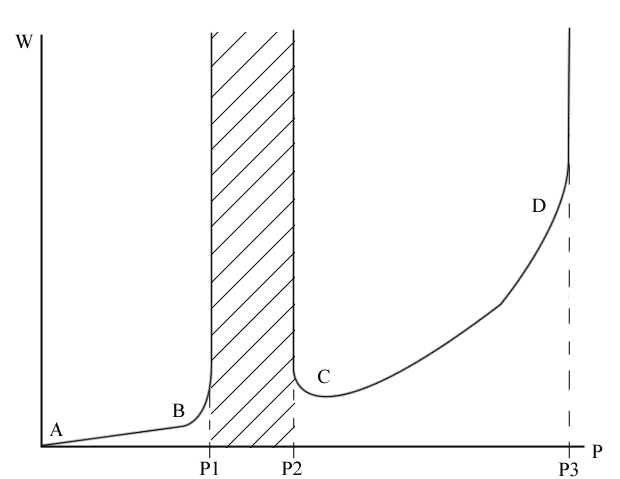
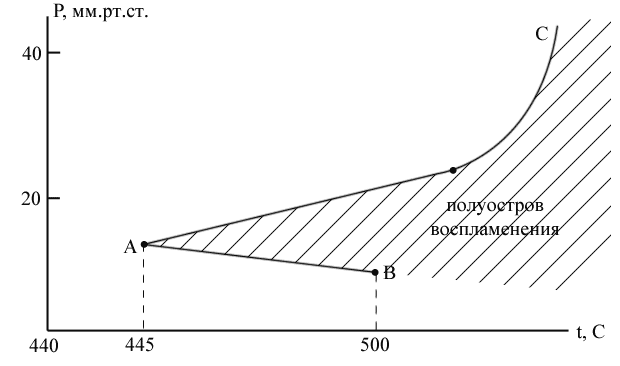
В области малых давлений (A‑B) реакция идет с малой скоростью, g > f. В точке B скорость бесконечно велика, f > g, т.е. происходит взрыв.
P1 – нижний предел взрываемости.
В области P1P2 смесь кислорода с водородом взрывается. В области давлений выше P2 реакция протекает с измеримой скоростью.
P2 – верхний предел воспламенения или взрываемости.
Если дальше повышать давление (т.е. концентрацию кислорода), то в точке D, при давлении P3, произойдет тепловой взрыв.
P3 – третий предел взрываемости.
В точках B и C – цепной взрыв.
Влияние давления и температуры на нижний и верхний пределы воспламенения или взрываемости
Нижний предел (A-B)
При низких давлениях обрыв идет, в основном, на стенках (почти не зависит от давления).
Верхний предел (A-C)
При высоких давлениях обрыв идет, в основном, в объеме. Его скорость пропорциональна P2, а разветвления – пропорциональна P. Отсюда возникает предел.
При t < 445C реакция не может закончиться воспламенением или взрывом ни при каких давлениях.
Нижний предел мало зависит от температуры, но сильно зависит от размеров сосуда и состояния поверхности (т.к. обрыв идет на стенках). Он увеличивается пропорционально квадрату диаметра сосуда, и существует «критический» диаметр, ниже которого реакция не может перейти в стадию воспламенения.
Верхний предел не зависит от формы сосуда и сильно зависит от примесей.
Тепловой взрыв
При давлениях выше P3 имеет место тепловой взрыв – третий предел воспламенения.
q1 – тепло, выделяющееся в реакции;
q2 – тепло, отдаваемое в окружающую среду.
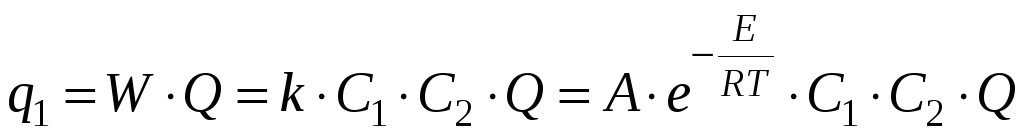 – экспоненциальная
функция;
– экспоненциальная
функция;
q2 = K(T – T0)S – линейная функция, где
K – коэффициент теплопередачи;
T – температура смеси; T0 – температура стенок;
S – площадь поверхности.
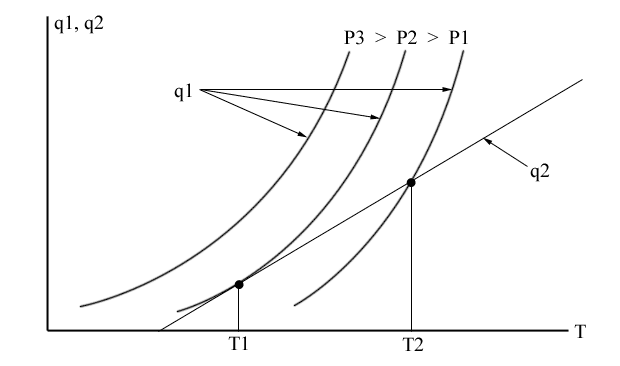
Если q1 > q2, произойдет повышение температуры смеси. Это приведет к росту q1, что вновь увеличит температуру, а ее повышение снова вызовет рост q1 и т.д., т.е. произойдет тепловой взрыв.
В точке пересечения q1 = q2, и воспламенение или взрыв произойдет при давлениях равных или больших P2.