
- •Тема 1.
- •1) Значение щелочей и глинозема в экономике и народном хозяйстве России.
- •2) Современное состояние содового производства.
- •3) Области применения содовых продуктов, масштабы производства.
- •Масштабы производства
- •4) Обзор месторождений природной соды
- •5) Взаимосвязь отдельных стадий производства кальцинированной соды аммиачным способом.
- •6) Принципиальная технологическая схема производства кальцинированной соды аммиачным способом.
- •7) Характеристика и стандарт на готовый продукт и сырье, вспомогательные материалы, применяемые в производстве кальцинированной соды.
- •Сырье и вспомогательные материалы, применяемые в производстве кальцинированной соды
- •Карбонатное сырье (содержащее )
- •8) Методы добычи рассола.
- •9) Отделение рассолоочистки, физико-химические основы процесса.
- •10) Получение извести и углекислого газа. Отделение известково-обжигательных печей.
- •12) Физико-химические основы процесса обжига карбонатного сырья, продукты обжига, степень обжига.
- •1 3) Технологическая схема производства извести и углекислого газа.
- •14) Типы известковых печей.
- •15) Конструкция шахтной известково-обжигательной печи, режим работы.
- •1 6) Обжиг шихты, расположение зон в печи, скорость разложения известняка.
- •17) Очистка и охлаждение печного газа.
- •18) Приготовление и очистка известкового молока [Ca(oh)2].
- •19) Приготовление аммонизированного рассола, назначение абсорбционного отделения.
- •20) Физико-химические основы процесса аммонизации рассола.
- •21) Движущая сила абсорбции.
- •22) Растворимость аммиака в водных растворах хлористого натрия. [?]
- •2 3) Типовая технологическая схема станции абсорбции.
- •24) Нормы технологического режима [отделения абсорбции?].
- •25) Карбонизация аммонизированного рассола.
- •2 6) Назначение отделения карбонизации аммиачно-соляного раствора.
- •27) Физико-химические основы процесса карбонизации и кристаллизации бикарбоната натрия.
- •28) Оптимальные условия процесса карбонизации [аммонизированного рассола].
- •2 9) Технологическая схема отделения карбонизации.
- •30) Устройство карбонизационной колонны.
- •31) Нормы технологического режима отделения карбонизации.
- •Тема 3. Производство кальцинированной соды аммиачным способом. Отделения: фильтрации и кальцинации бикарбоната натрия, дистилляции
- •32) Отделение фильтрации и кальцинации бикарбоната натрия.
- •33) Сущность процесса фильтрации суспензии бикарбоната натрия, технологическая схема отделения фильтрации. Фильтрование гидрокарбонатной суспензии
- •Т ехнологическая схема и аппаратура отделения фильтрования
- •34) Кальцинация бикарбоната натрия.
- •35) Физико-химические основы процесса регенерации аммиака.
- •36) Технологическая схема станции дистилляции.
- •37) Устройство аппаратуры и нормы технологического режима отделения дистилляции.
- •38) Получение кальцинированной соды из природных источников.
- •39) Перспективы развития содовой промышленности.
- •Тема 4. Производство очищенного бикарбоната натрия
- •40) Свойства и применение очищенного бикарбоната натрия.
- •41) Получение бикарбоната натрия из кальцинированной соды или сырого бикарбоната натрия. Физико-химические основы процесса. Технологическая схема производства.
- •42) Комплексное использование и утилизация отходов при производстве соды.
- •43) Получение соды и поташа из сильвинита.
- •44) Способы получения соды и сульфата аммония из мирабилита.
- •45) Получение соды и вяжущих материалов.
- •46) Комплексное использование нефелиновых руд в производстве глинозема, соды, поташа.
- •47) Получение содового раствора [NaHco3] сухим и мокрым способами.
- •48) Карбонизация содового раствора.
- •49) Аппаратура и режим работы отделения карбонизации.
- •50) Фильтрация, сушка и упаковка бикарбоната натрия.
12) Физико-химические основы процесса обжига карбонатного сырья, продукты обжига, степень обжига.
Физико-химические основы процесса обжига:
Разложение карбоната кальция, содержащегося в известняке или меле, протекает по реакции:

(при нормальном давлении и температуре 0 °С).
Поскольку процесс идет с поглощением тепла, т.е. реакция эндотермична, то для смещения реакции вправо необходимо обеспечить подвод тепла в течении всего процесса обжига СаСО3.
Зависимость теплового эффекта реакции от температуры описывается, согласно закону Киргоффа, уравнением:

где:  – изменение
энтальпии системы при ОК;
– изменение
энтальпии системы при ОК;
 – разность
теплоемкостей конечных и начальных
продуктов реакции.
– разность
теплоемкостей конечных и начальных
продуктов реакции.
Тепловой эффект
реакции разложения СаСО3
при нижнем пределе температуры в зоне
обжига, равной 900 °С
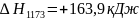 ,
а при верхнем пределе, равном 1200 °С
,
а при верхнем пределе, равном 1200 °С
 .
В среднем тепловой эффект в зоне обжига
можно принять равным + 158,7 кДж.
.
В среднем тепловой эффект в зоне обжига
можно принять равным + 158,7 кДж.
Т.о., с ростом температуры тепловой эффект реакции разложения СаСО3 уменьшается и рассчитывается по формуле:

Константа равновесия реакции разложения СаСО3 определяется концентрацией СО2 в газе:


Равновесное
парциальное давление СО2
( )
в данной системе, согласно правилу
фаз,
определяется одной независимой переменной
– температурой и экспериментальные
данные описываются уравнением (для
в мм рт. ст.):
)
в данной системе, согласно правилу
фаз,
определяется одной независимой переменной
– температурой и экспериментальные
данные описываются уравнением (для
в мм рт. ст.):

Функциональную
зависимость
 можно определить исходя из уравнения
Вант-Гоффа:
можно определить исходя из уравнения
Вант-Гоффа:

Зависимость равновесного давления СО2 (Рсо2) над поверхностью СаСО3 от температуры:
Продукты обжига:
От температуры обжига и продолжительности воздействия ее зависит кристаллическая структура получаемой извести.
В мягких условиях (температура обжига 1150 °С) образуется пористая известь с большой удельной поверхностью и высокой реакционной способностью, т.н. активная известь.
При более высоких температурах протекает процесс рекристаллизации СаО, увеличивается ее прочность, уменьшается ее удельная поверхность с одновременным снижением реакционной способности. Образуется неактивная известь (перекал или пережог). Перекалу обычно подвергаются мелкие куски, т.к. они быстрее разлагаются и нагреваются до температуры окружающей среды, т.е. более длительное время подвергаются высокой температуре.
При сжигании топлива образуется зола, которая содержит SiО2, Аl2О3, Fe2О3.
Степень обжига:
Оксид кальция, входящий в состав извести, может быть в виде свободного (активного и неактивного), а также в виде связанного, т.е. вступившего во взаимодействие с примесями и образовавшего новые соединения (безвозвратные потери СаО).
Активный СаО – часть свобдного оксида кальция, которая способна реагировать с водой в обычных условиях гашения.
Неактивная часть СаО – часть свободного оксида кальция, которая не реагирует с водой в обычных условиях гашения. Неактивный СаО образуется вследствие структурных изменений при высоких температурах, а также за счет обволакивания зерен активного СаО пленкой плава.
Работу печи
оценивают по степени
обжига,
которая выражается отношением активного
СаО к общему количеству СаО:

