
По полярности бокового радикала:
неполярные (глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан);
полярные незаряженные (серин, треонин, цистеин, аспарагин, глутамин, тирозин);
полярные заряженные отрицательно (аспартат, глутамат);
полярные заряженные положительно (лизин, аргинин, гистидин).
По кислотно-основным свойствам:
нейтральные (большинство);
кислые (аспаргиновая и глутаминовая кислоты);
основные (лизин, аргинин, гистидин).
Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
Амфотерность — основное физико-химическое свойство аминокислот. Оно означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты — доноры протонов, и как основания — акцепторы протонов.
Изоэлектрическая точка (ИЭТ, pI) — величина рН, при которой заряд аминокислоты равен 0. Значение изоэлектрической точки зависит от строения радикала аминокислоты:
ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин);
ИЭТ кислых аминокислот — для глутамата 3,2, для аспартата 2,8;
ИЭТ основных аминокислот — для гистидина 7,6, для аргинина 10,8, для лизина 9,7.
Благодаря характеристике изоэлектрической точки, её можно использовать для разделения смеси белков с помощью электрофореза.
Аминокислоты — амфотерные соединения, так как они содержат две функциональные группы: карбоксильную, проявляющую кислотные свойства, и аминогруппу, проявляющую основные свойства.
Реакции по карбоксильной группе:
Этерификация. NH2-CH2-COOH + CH3-OH ↔︎ NH2-CH2-COOCH3 + H2O.
С металлами до водорода. 2NH2-CH2-COOH + 2K → 2NH2-CH2-COOK + H2.
С оксидами и гидроксидами металлов. 2NH2-CH2-COOH + MgO → (NH2-CH2-COO)2Mg + H2O.
С аммиаком. NH2-CH2-COOH + NH3 → NH2-CH2-COONH4.
Реакции по аминогруппе:
С кислотами. 2NH2-CH2-COOH + H2SO4 → [NH3+-CH2-COOH]2SO42-.
С галогеналканами. NH2-CH2-COOH + CH3-Cl → [CH3-NH2+-CH2-COOH]Cl-.
Образование пептидов. Пептиды — вещества, состоящие из нескольких остатков аминокислот, соединённых пептидной (амидной) связью.
При нагревании аминокислоты разлагаются с образованием различных продуктов в зависимости от их типа:
α-Аминокислоты димеризуются и образуют циклические продукты — дикетопиперазины. При этом протекает взаимное ацилирование аминогруппы одной молекулы аминокислоты карбоксильной группой другой молекулы.
β-Аминокислоты отщепляют молекулу аммиака и дают α,β-непредельные кислоты.
γ-Аминокислоты при нагревании превращаются в лактамы — продукты внутримолекулярного ацилирования аминогруппы карбоксилом.
Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
α-аминокислоты вследствие взаимодействия амино- и карбоксильных групп способны к поликонденсации. Образующиеся полиамиды называют пептидами. Группу —C(O)—NH— между двумя α-аминокислотными фрагментами называют пептидной группой. связь с—N, посредством которой остатки α-аминокислот соединены в пептидах и белках, называют пептидной связью. В основе синтеза пептидов лежит процесс образования пептидной (амидной) связи между карбоксильной группой одной α-аминокислоты и аминогруппой — другой. В процессе синтеза возникают сложности, связанные с необходимостью соединять остатки α-аминокислот в определенной последовательности. например, при взаимодействии глицина и аланина возможно образование четырех дипептидов:
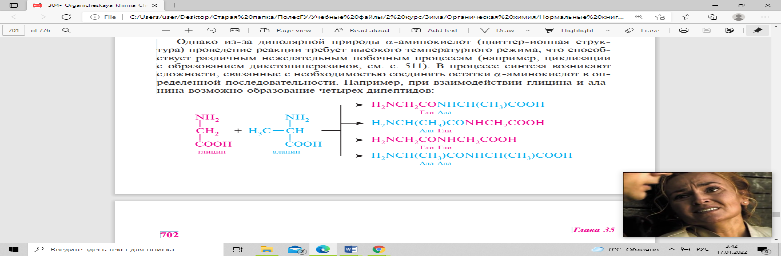 Поэтому
для проведения целенаправленного
синтеза следует создать такие условия,
при которых одна из аминокислот
реагировала по карбоксильной группе,
а другая — по аминогруппе. С этой целью
осуществляют защиту функциональных
групп (–NH2 и —COOH), не принимающих участия
в образовании пептидной связи. Защитные
группы выбирают таким образом, чтобы
затем каждую из них независимо друг от
друга можно было легко удалить, не
разрушая при этом пептидной связи. Для
защиты аминогрупп используют реакцию
ацилирования, чаще всего
бензоксикарбонилхлоридом или
трет-бутоксикарбоксазидом. Важным
свойством карбобензокси- и
трет-бутоксикарбонильных групп является
то, что они надежно защищают хиральный
центр аминокислот от рацемизации.
Карбобензоксигруппу удаляют каталитическим
гидрогенолизом, а трет-бутоксикарбонильную
— с помощью трифторуксусной кислоты.
для защиты карбоксильной группы
используют реакцию этерификации. С
целью повышения эффективности процесса
амидирования, осуществляют активацию
карбоксильной группы N-замещенной
аминокислоты путем превращения ее в
хлорангидрид или в смешанный ангидрид
(чаще взаимодействием с этилхлорформиатом).
Схема синтеза дипептида аланил-глицина:
1. защита аминогруппы аланина; 2. активация
карбоксильной группы N-защищенного
аланина; 3. защита карбоксильной группы
глицина; 4. образование пептидной связи
и снятие защиты. Синтез пептидов согласно
приведенной схеме достаточно сложный
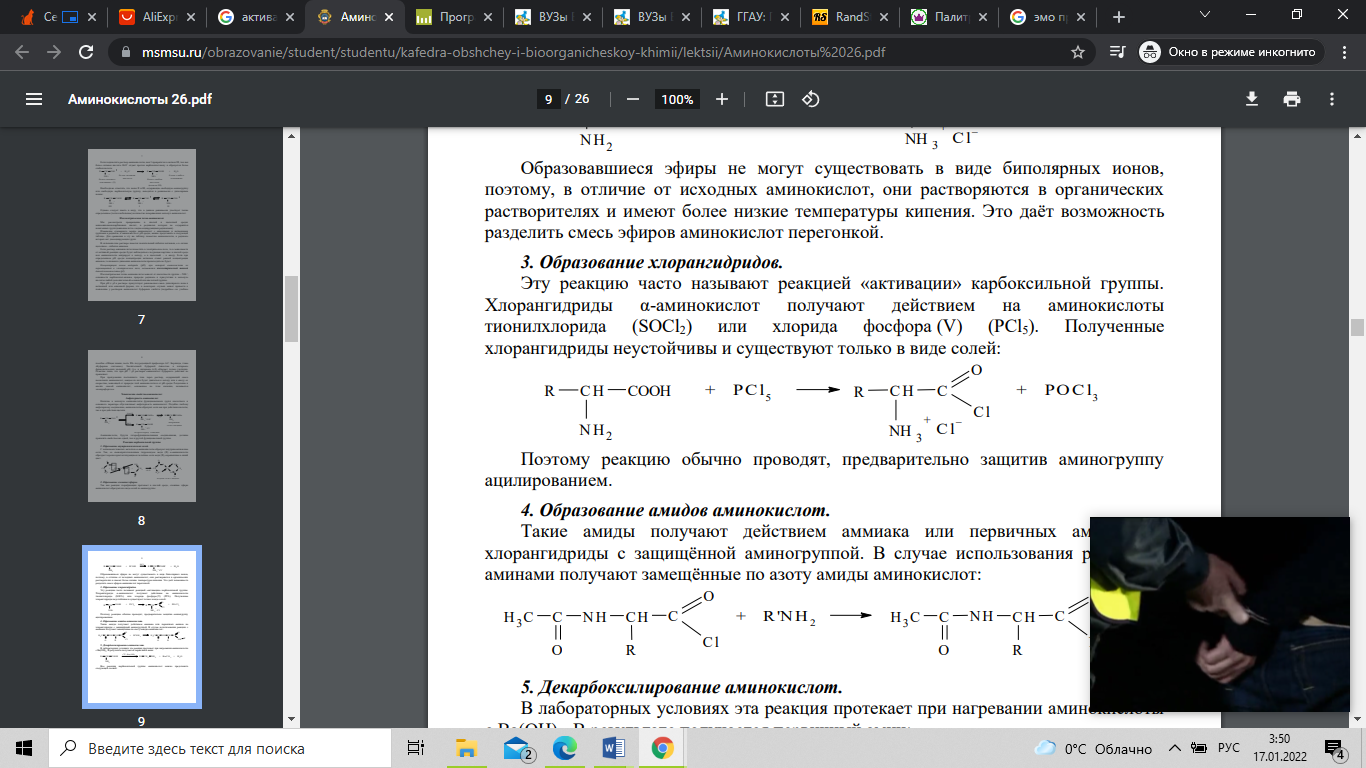
и трудоемкий. Образование хлорангидридов
часто называют реакцией «активации»
карбоксильной группы. Хлорангидриды
α-аминокислот получают действием на
аминокислоты тионилхлорида (SOCl2) или
хлорида фосфора (V) (PCl5). Полученные
хлорангидриды неустойчивы и существуют
только в виде солей:
Поэтому
для проведения целенаправленного
синтеза следует создать такие условия,
при которых одна из аминокислот
реагировала по карбоксильной группе,
а другая — по аминогруппе. С этой целью
осуществляют защиту функциональных
групп (–NH2 и —COOH), не принимающих участия
в образовании пептидной связи. Защитные
группы выбирают таким образом, чтобы
затем каждую из них независимо друг от
друга можно было легко удалить, не
разрушая при этом пептидной связи. Для
защиты аминогрупп используют реакцию
ацилирования, чаще всего
бензоксикарбонилхлоридом или
трет-бутоксикарбоксазидом. Важным
свойством карбобензокси- и
трет-бутоксикарбонильных групп является
то, что они надежно защищают хиральный
центр аминокислот от рацемизации.
Карбобензоксигруппу удаляют каталитическим
гидрогенолизом, а трет-бутоксикарбонильную
— с помощью трифторуксусной кислоты.
для защиты карбоксильной группы
используют реакцию этерификации. С
целью повышения эффективности процесса
амидирования, осуществляют активацию
карбоксильной группы N-замещенной
аминокислоты путем превращения ее в
хлорангидрид или в смешанный ангидрид
(чаще взаимодействием с этилхлорформиатом).
Схема синтеза дипептида аланил-глицина:
1. защита аминогруппы аланина; 2. активация
карбоксильной группы N-защищенного
аланина; 3. защита карбоксильной группы
глицина; 4. образование пептидной связи
и снятие защиты. Синтез пептидов согласно
приведенной схеме достаточно сложный
и трудоемкий. Образование хлорангидридов
часто называют реакцией «активации»
карбоксильной группы. Хлорангидриды
α-аминокислот получают действием на
аминокислоты тионилхлорида (SOCl2) или
хлорида фосфора (V) (PCl5). Полученные
хлорангидриды неустойчивы и существуют
только в виде солей:
 Поэтому
реакцию обычно проводят, предварительно
защитив аминогруппу ацилированием. В
зависимости от структуры белки делят
на простые (протеины) и сложные (протеиды).
Последние, кроме белка, содержат в своей
структуре химически связанную с ним
простетическую группу — небелковую
часть молекулы. По природе простетической
группы протеиды делят на липопротеиды,
нуклеопротеиды, гликопротеиды,
хромопротеиды, фосфопротеиды и
металлопротеиды. Липопротеиды в качестве
простетической группы содержат липиды,
нуклеопротеиды — нуклеиновые кислоты,
гликопротеиды — углеводы, хромопротеиды
— пигменты, фосфопротеиды — фосфорную
кислоту, металлопротеиды — металлы.
Существуют также сложные белковые
комплексы, в состав которых одновременно
входят белки, липиды и углеводы, называемые
гликолипопротеидами. Они содержатся в
соединительной ткани, клеточных стенках
бактерий и др. В зависимости от
пространственной формы молекул белки
делят на глобулярные и фибриллярные.
Глобулярные белки имеют сферическую
или эллипсоидную форму, фибриллярные
— состоят из вытянутых нитевидных
макромолекул, называемых протеноидами.
Глобулярные белки (альбумин, глобулин)
малоустойчивы к действию температуры,
кислот и щелочей, а фибриллярные (белки
волос, ногтей, эпидермиса; белки
соединительной, костной, хрящевой ткани
и др.) весьма устойчивы. Под влиянием
многих факторов (повышенная температура,
изменение рн среды, уф- и γ-излучение и
др.) происходит разрушение пространственной
формы белков при сохранении первичной
структуры. Этот процесс называется
денатурацией белка. Денатурация является,
как правило, необратимым процессом и
приводит к потере биологических функций
белков. Примером тепловой денатурации
является «свертывание» яичных белков
при варке яиц. При денатурации происходит
разрыв водородных связей, стабилизирующих
пространственную форму белка.
денатурированный белок теряет
растворимость, в результате чего
первоначальная пространственная форма
его не может быть восстановлена.
Денатурация может быть также вызвана
образованием нерастворимых солей
белков. Это происходит при отравлении
солями тяжелых металлов (ртути, свинца
и др.). В качестве противоядия в таких
случаях применяют белки с повышенным
содержанием кислотных групп, например,
яичный альбумин. выступая в качестве
конкурента, эти белки связывают металлы
с образованием нерастворимых солей,
которые выводятся из организма.
Определенную последовательность
α-аминокислот, входящих в данную
полипептидную цепь, называют первичной структурой
пептида или белка. Вторичной структурой
белка называют пространственное
расположение (пространственную укладку)
атомов основной полипептидной цепи.
Полипептидная цепь, имеющая тот или
иной тип вторичной структуры, способна
определенным образом скручиваться в
пространстве, что и определяет третичную структуру
белка, то есть общую форму полипептидной
цепи. Четвертичная структура
белка относится к макромолекулам, в
состав которых входят несколько
полипептидных цепей (субъединиц),
связанных между собой нековалентными
связями.
Поэтому
реакцию обычно проводят, предварительно
защитив аминогруппу ацилированием. В
зависимости от структуры белки делят
на простые (протеины) и сложные (протеиды).
Последние, кроме белка, содержат в своей
структуре химически связанную с ним
простетическую группу — небелковую
часть молекулы. По природе простетической
группы протеиды делят на липопротеиды,
нуклеопротеиды, гликопротеиды,
хромопротеиды, фосфопротеиды и
металлопротеиды. Липопротеиды в качестве
простетической группы содержат липиды,
нуклеопротеиды — нуклеиновые кислоты,
гликопротеиды — углеводы, хромопротеиды
— пигменты, фосфопротеиды — фосфорную
кислоту, металлопротеиды — металлы.
Существуют также сложные белковые
комплексы, в состав которых одновременно
входят белки, липиды и углеводы, называемые
гликолипопротеидами. Они содержатся в
соединительной ткани, клеточных стенках
бактерий и др. В зависимости от
пространственной формы молекул белки
делят на глобулярные и фибриллярные.
Глобулярные белки имеют сферическую
или эллипсоидную форму, фибриллярные
— состоят из вытянутых нитевидных
макромолекул, называемых протеноидами.
Глобулярные белки (альбумин, глобулин)
малоустойчивы к действию температуры,
кислот и щелочей, а фибриллярные (белки
волос, ногтей, эпидермиса; белки
соединительной, костной, хрящевой ткани
и др.) весьма устойчивы. Под влиянием
многих факторов (повышенная температура,
изменение рн среды, уф- и γ-излучение и
др.) происходит разрушение пространственной
формы белков при сохранении первичной
структуры. Этот процесс называется
денатурацией белка. Денатурация является,
как правило, необратимым процессом и
приводит к потере биологических функций
белков. Примером тепловой денатурации
является «свертывание» яичных белков
при варке яиц. При денатурации происходит
разрыв водородных связей, стабилизирующих
пространственную форму белка.
денатурированный белок теряет
растворимость, в результате чего
первоначальная пространственная форма
его не может быть восстановлена.
Денатурация может быть также вызвана
образованием нерастворимых солей
белков. Это происходит при отравлении
солями тяжелых металлов (ртути, свинца
и др.). В качестве противоядия в таких
случаях применяют белки с повышенным
содержанием кислотных групп, например,
яичный альбумин. выступая в качестве
конкурента, эти белки связывают металлы
с образованием нерастворимых солей,
которые выводятся из организма.
Определенную последовательность
α-аминокислот, входящих в данную
полипептидную цепь, называют первичной структурой
пептида или белка. Вторичной структурой
белка называют пространственное
расположение (пространственную укладку)
атомов основной полипептидной цепи.
Полипептидная цепь, имеющая тот или
иной тип вторичной структуры, способна
определенным образом скручиваться в
пространстве, что и определяет третичную структуру
белка, то есть общую форму полипептидной
цепи. Четвертичная структура
белка относится к макромолекулам, в
состав которых входят несколько
полипептидных цепей (субъединиц),
связанных между собой нековалентными
связями.
Классификация и номенклатура гетероциклов. Пятичленные гетероциклы с одним или несколькими гетероатомами: фуран, тиофен, пиррол, индол, их строение (участие неподеленной электронной пары в создании ароматической системы). Особенности протекания реакций электрофильного замещения в этих гетероциклах.
Гетероциклические
соединения классифицируют по
размеру кольца, по типу гетероатомов и
их количеству. Наиболее распространенные
ненасыщенные гетероциклы имеют
тривиальные названия, которые используются
в качестве основы для названия их
производных и конденсированных
гетеросистем.  Многие
полностью или частично гидрированные
гетероциклы тоже имеют свои тривиальные
названия:
Многие
полностью или частично гидрированные
гетероциклы тоже имеют свои тривиальные
названия:  Ароматические
шестичленные гетероциклы, содержащие
хотя бы один атом азота, объединяют под
общим названием «азины»; в соответствии
с количеством гетероатомов различают
моно-, ди-, триазины и т.д.
Ароматические
шестичленные гетероциклы, содержащие
хотя бы один атом азота, объединяют под
общим названием «азины»; в соответствии
с количеством гетероатомов различают
моно-, ди-, триазины и т.д.  Пятичленные
азотистые гетероциклы с более чем одним
гетероатомом называют азолами. К ним
относятся соединения следующих
типов:
Пятичленные
азотистые гетероциклы с более чем одним
гетероатомом называют азолами. К ним
относятся соединения следующих
типов:  Нумерация
атомов в ядре гетероциклов проводится
от гетероатома так, чтобы сумма номеров
гетероатомов была наименьшей. В тех
случаях, когда есть варианты, наименьший
номер должен быть присвоен наиболее
старшему гетероатому. Правила старшинства
самых распространенных гетероатомов:
1. Азот > Кислород > Сера. 2. Гетероатом
«пиррольного» типа старше атома того
же элемента «пиридинового»
типа. Пятичленные гетероароматические
соединения с одним гетероатомом можно
рассматривать как производные бензола,
в котором группировка —CH=CH— замещена
на гетероатом. Важнейшими представителями
этой группы гетероциклов являются
пиррол, фуран и тиофен.
Нумерация
атомов в ядре гетероциклов проводится
от гетероатома так, чтобы сумма номеров
гетероатомов была наименьшей. В тех
случаях, когда есть варианты, наименьший
номер должен быть присвоен наиболее
старшему гетероатому. Правила старшинства
самых распространенных гетероатомов:
1. Азот > Кислород > Сера. 2. Гетероатом
«пиррольного» типа старше атома того
же элемента «пиридинового»
типа. Пятичленные гетероароматические
соединения с одним гетероатомом можно
рассматривать как производные бензола,
в котором группировка —CH=CH— замещена
на гетероатом. Важнейшими представителями
этой группы гетероциклов являются
пиррол, фуран и тиофен.
 Пиррол —
бесцветная жидкость с запахом, напоминающим
запах хлороформа (т. кип. 130); малорастворим
в воде, хорошо растворим в этаноле и
бензоле, на воздухе темнеет и
осмоляется. Фуран —
бесцветная жидкость со своеобразным
запахом, напоминающим запах хлороформа
(т. кип. 32), нерастворим в воде, хорошо
растворяется в этаноле и диэтиловом
эфире. Тиофен —
бесцветная жидкость со слабым запахом
сернистых соединений (т. кип. 84), нерастворим
в воде, хорошо растворим в этаноле, эфире
и бензоле. устойчив к действию высокой
температуры. на свету окисляется.
Реакционная способность пиррола, фурана
и тиофена определяется наличием в их
структуре цикла с π-электроноизбыточной
ароматической системой (шесть p-электронов
приходится на пять атомов цикла). Однако
степень ароматичности указанных
гетероциклов ниже, чем у бензола, и
зависит от природы гетероатома. Поскольку
электроотрицательность атома серы
меньше электроотрицательности атомов
азота и кислорода, доля участия
неподеленной пары электронов атома
серы в образовании ароматического
секстета молекулы тиофена больше, чем
атома азота в пирроле и атома кислорода
в фуране. В некоторых реакциях фуран
ведет себя как ненасыщенное (диеновое)
соединение. Вследствие электроотрицательности
гетероатома в молекулах пиррола, фуранаи
тиофена, в отличие от бензола, электронная
плотность распределена неравномерно,
в частности, на атомах углерода в
α-положении плотность выше, чем в
β-положении, что определяет направленность
протекания реакций электрофильного
замещения. Реакции электрофильного замещения
(SE). являясь π-избыточными ароматическими
системами, пиррол, фуран и тиофен легко
вступают в характерные для ароматических
соединений реакции электрофильного
замещения. Эти реакции протекают
значительно легче, чем у бензола.
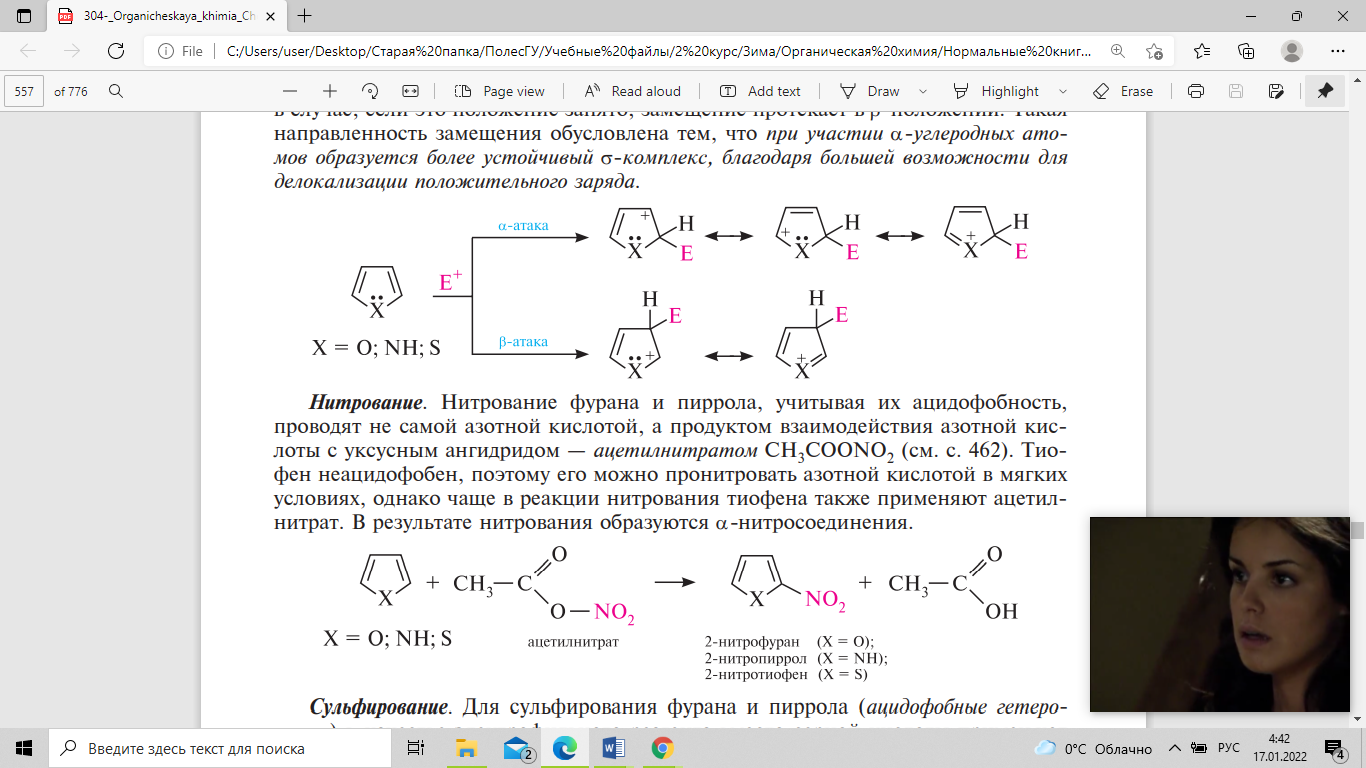
Активность гетероциклов в SE-реакциях
в первую очередь замещается атом водорода
при α-углеродном атоме и только в случае,
если это положение занято, замещение
протекает в β-положении. Такая
направленность замещения обусловлена
тем, что при участии α-углеродных атомов
образуется более устойчивый σ-комплекс,
благодаря большей возможности для
делокализации положительного заряда.
Пиррол —
бесцветная жидкость с запахом, напоминающим
запах хлороформа (т. кип. 130); малорастворим
в воде, хорошо растворим в этаноле и
бензоле, на воздухе темнеет и
осмоляется. Фуран —
бесцветная жидкость со своеобразным
запахом, напоминающим запах хлороформа
(т. кип. 32), нерастворим в воде, хорошо
растворяется в этаноле и диэтиловом
эфире. Тиофен —
бесцветная жидкость со слабым запахом
сернистых соединений (т. кип. 84), нерастворим
в воде, хорошо растворим в этаноле, эфире
и бензоле. устойчив к действию высокой
температуры. на свету окисляется.
Реакционная способность пиррола, фурана
и тиофена определяется наличием в их
структуре цикла с π-электроноизбыточной
ароматической системой (шесть p-электронов
приходится на пять атомов цикла). Однако
степень ароматичности указанных
гетероциклов ниже, чем у бензола, и
зависит от природы гетероатома. Поскольку
электроотрицательность атома серы
меньше электроотрицательности атомов
азота и кислорода, доля участия
неподеленной пары электронов атома
серы в образовании ароматического
секстета молекулы тиофена больше, чем
атома азота в пирроле и атома кислорода
в фуране. В некоторых реакциях фуран
ведет себя как ненасыщенное (диеновое)
соединение. Вследствие электроотрицательности
гетероатома в молекулах пиррола, фуранаи
тиофена, в отличие от бензола, электронная
плотность распределена неравномерно,
в частности, на атомах углерода в
α-положении плотность выше, чем в
β-положении, что определяет направленность
протекания реакций электрофильного
замещения. Реакции электрофильного замещения
(SE). являясь π-избыточными ароматическими
системами, пиррол, фуран и тиофен легко
вступают в характерные для ароматических
соединений реакции электрофильного
замещения. Эти реакции протекают
значительно легче, чем у бензола.
Активность гетероциклов в SE-реакциях
в первую очередь замещается атом водорода
при α-углеродном атоме и только в случае,
если это положение занято, замещение
протекает в β-положении. Такая
направленность замещения обусловлена
тем, что при участии α-углеродных атомов
образуется более устойчивый σ-комплекс,
благодаря большей возможности для
делокализации положительного заряда.
 Пиррол,
являясь слабой NH-кислотой (рка ~ 17,5),
взаимодействует с металлическим калием,
безводным калия гидроксидом, металлическим
натрием и литием в жидком аммиаке, с
калия и натрия амидами, а также
магнийорганическими соединениями,
образуя соли. Пирролид-анион, входящий
в состав солей, представляет собой
довольно устойчивую частицу вследствие
делокализации отрицательного заряда
по пиррольному ядру. Соли пиррола
являются реакционноспособными
соединениями и широко применяются в
органическом синтезе для введения в
молекулу пиррола алкильных и ацильных
заместителей. направление реакций
алкилирования и ацилирования зависит
от температуры. Пиррол при взаимодействии
с хлороформом в щелочной среде подвергается
не только формилированию, но и претерпевает
расширение цикла:
Пиррол,
являясь слабой NH-кислотой (рка ~ 17,5),
взаимодействует с металлическим калием,
безводным калия гидроксидом, металлическим
натрием и литием в жидком аммиаке, с
калия и натрия амидами, а также
магнийорганическими соединениями,
образуя соли. Пирролид-анион, входящий
в состав солей, представляет собой
довольно устойчивую частицу вследствие
делокализации отрицательного заряда
по пиррольному ядру. Соли пиррола
являются реакционноспособными
соединениями и широко применяются в
органическом синтезе для введения в
молекулу пиррола алкильных и ацильных
заместителей. направление реакций
алкилирования и ацилирования зависит
от температуры. Пиррол при взаимодействии
с хлороформом в щелочной среде подвергается
не только формилированию, но и претерпевает
расширение цикла:
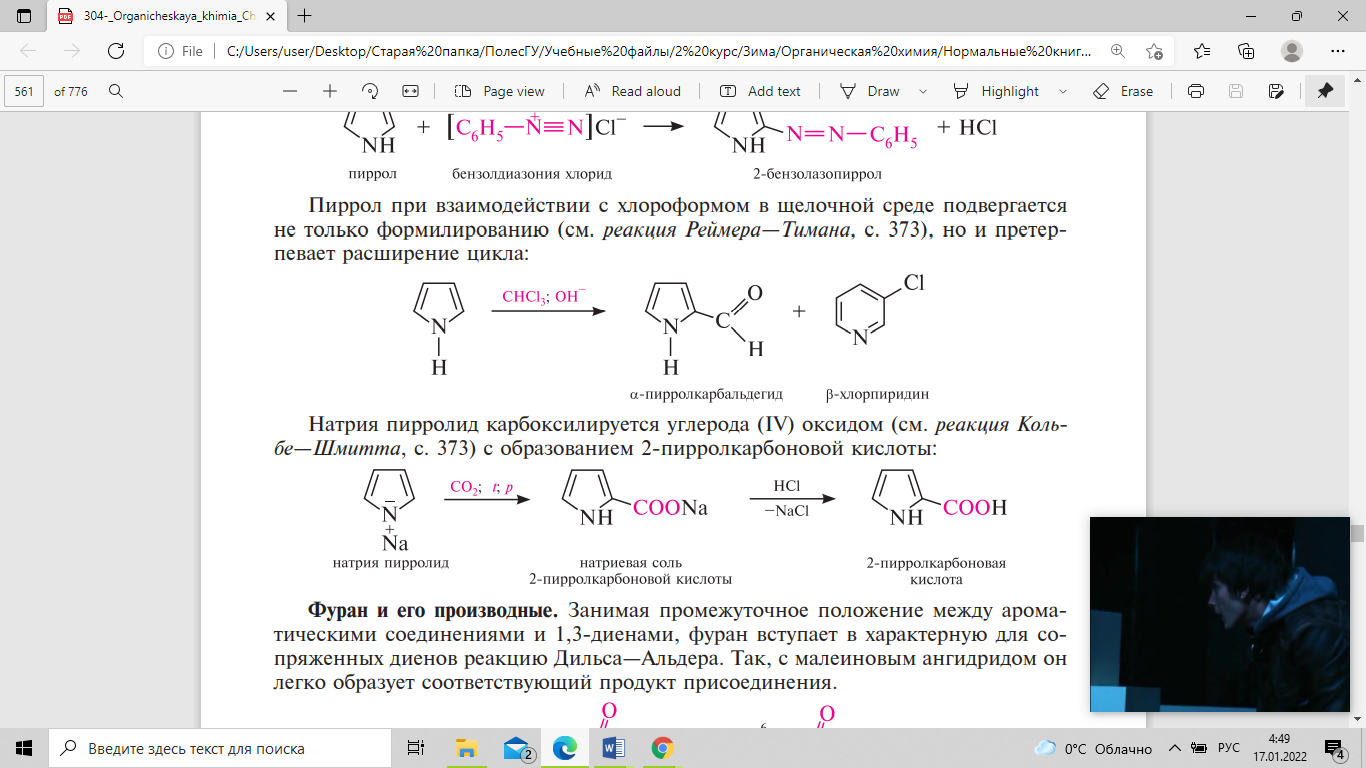 Занимая
промежуточное положение между
ароматическими соединениями и 1,3-диенами,
фуран вступает в характерную для
сопряженных диенов реакцию дильса—альдера.
Так, с малеиновым ангидридом он легко
образует соответствующий продукт
присоединения.
Занимая
промежуточное положение между
ароматическими соединениями и 1,3-диенами,
фуран вступает в характерную для
сопряженных диенов реакцию дильса—альдера.
Так, с малеиновым ангидридом он легко
образует соответствующий продукт
присоединения.
 При
конденсации 2-пирролидона с
ацетиленом образуется N-винил-2-пирролидон,
который легко полимеризуется, образуя
поливинилпирролидон (ПвП) - образует
коллоидные растворы в воде и применяется
для приготовления кровезаменителя
«Гемодеза». Порфин является
ароматическим соединением, имеет плоское
строение молекулы, содержит замкнутую
сопряженную систему с числом π-электронов
— 26 (11 π-связей и 2 пары неподеленных
электронов при атомах азота), что отвечает
правилу Хюккеля (4n + 2, n = 6). Производные
порфина получили общее название
«порфирины». Гемоглобин —
красящее вещество крови, содержащееся
в эритроцитах, представляет собой
сложный белок — хромопротеид, состоящий
из белка глобина и окрашенной в красный
цвет небелковой части — гема. По
химической структуре гем является
комплексом порфина с Fe (II). Частично
гидрированный порфиновый цикл,
координационно связанный с магнием,
входит в состав зеленого пигмента
растений — хлорофилла. В основе
структуры витамина B12 лежит
макроцикл, состоящий из четырех частично
гидрированных пиррольных ядер, в котором
атомы азота образуют координационный
комплекс с атомом кобальта и цианид-ионом.
Важнейшим производным фурана
является фурфурол —
бесцветная или слегка желтоватая
маслянистая жидкость (т. кип. 162 с), имеющая
приятный запах свежеиспеченного ржаного
хлеба. впервые был выделен из отрубей.
Нитрование фурфурола проводят
концентрированной азотной кислотой в
среде уксусного ангидрида. в процессе
реакции получают ацилаль —
5-нитрофурфуролдиацетат, который при
гидролизе в присутствии разведенной
серной кислоты образует 5-нитрофурфурол
- исходное вещество для синтеза ряда
лекарственных препаратов. Так, при
взаимодействии 5-нитрофурфурола с
семикарбазидом образуется семикарбазон
5-нитрофурфурола, который применяется
в медицине под названием «фурацилин».
Представителями группы лекарственных
препаратов нитрофуранового ряда являются
также фурадонин и фуразолидон. Препараты
нитрофуранового ряда обладают высокой
антибактериальной активностью. Они
находят широкое применение в медицине
для лечения гнойных и воспалительных
процессов. Особенно ценным свойством
этих препаратов является их способность
в ряде случаев проявлять эффект против
форм возбудителей, устойчивых к
сульфаниламидам и антибиотикам.
Молекула индола (бензо[b]пиррола)
представляет собой конденсированную
гетероциклическую систему, состоящую
из пиррольного и бензольного колец.
Нумерацию атомов в индоле начинают с
гетероатома, атомы углерода в пиррольном
цикле обозначают также буквами α и β.
Индол — бесцветное кристаллическое
вещество (т. пл. 52с), имеющее своеобразный
неприятный запах; хорошо растворим в
этаноле, эфире и толуоле, практически
не растворим в воде. В малых концентрациях
индол обладает приятным цветочным
запахом. По химическим свойствам он
напоминает пиррол. В реакциях
электрофильного замещения в молекуле
индола более реакционноспособным
является гетероциклическое кольцо, но
в отличие от пиррола заместитель
направляется в β-положение. Это можно
объяснить тем, что образование σ-комплекса
по β-положению является для индола более
выгодным процессом (в сравнении с
α-положением), поскольку в этом случае
положительный заряд может быть
делокализован без нарушения ароматической
системы бензольного ядра. В результате
электрофильной атаки α-положения
образуется σ-комплекс, в котором
делокализация положительного заряда
может быть осуществлена только с
нарушением ароматической системы
бензольного кольца, что энергетически
для молекулы не выгодно. Если β-положение
занято, то электрофильное замещение
протекает по α-положению. Индоксил -
желтое кристаллическое вещество с
сильным фенольным запахом (т. пл. 85),
растворяется в воде, спиртах, ацетоне,
эфире и бензоле. В промышленности
получают взаимодействием анилина с
натриевой солью хлоруксусной
кислоты. Индоксил легко
вступает в реакции, характерные для
карбонильных соединений и фенолов. В
щелочной среде индоксил легко окисляется
кислородом воздуха, образуя синий
краситель — индиго. L-триптофан является
незаменимой аминокислотой, входящей в
состав белков. Серотонин [5-гидрокси-3-(β-аминоэтил)индол],
кристаллическое вещество (т. пл. 207—212),
растворимое в воде, нерастворимое в
органических растворителях. серотонин
является биогенным амином, который
играет важную роль в процессах
жизнедеятельности организма, принимает
участие в передаче нервных импульсов,
вызывает сокращение гладкой мускулатуры
внутренних органов и сужение кровеносных
сосудов, повышает стойкость капилляров
и количество тромбоцитов в крови. В
организме образуется из триптофана. С
нарушением обмена серотонина связывают
появление симптомов шизофрении.
Применяется в медицине в виде соли с
адипиновой кислотой как антигеморрагическое
средство. β-Индолилуксусная кислота (гетероауксин)
- кристаллическое вещество (т. пл.
168—169), растворимое в воде и этиловом
спирте. Гетероауксин является продуктом
окислительного дезаминирования
триптофана. Он оказывает стимулирующее
влияние на рост растений (гормон роста)
и широко применяется в сельском хозяйстве.
На основе индолилуксусной кислоты
создан лекарственный препарат —
индометацин, обладающий сильным
противовоспалительным действием.
При
конденсации 2-пирролидона с
ацетиленом образуется N-винил-2-пирролидон,
который легко полимеризуется, образуя
поливинилпирролидон (ПвП) - образует
коллоидные растворы в воде и применяется
для приготовления кровезаменителя
«Гемодеза». Порфин является
ароматическим соединением, имеет плоское
строение молекулы, содержит замкнутую
сопряженную систему с числом π-электронов
— 26 (11 π-связей и 2 пары неподеленных
электронов при атомах азота), что отвечает
правилу Хюккеля (4n + 2, n = 6). Производные
порфина получили общее название
«порфирины». Гемоглобин —
красящее вещество крови, содержащееся
в эритроцитах, представляет собой
сложный белок — хромопротеид, состоящий
из белка глобина и окрашенной в красный
цвет небелковой части — гема. По
химической структуре гем является
комплексом порфина с Fe (II). Частично
гидрированный порфиновый цикл,
координационно связанный с магнием,
входит в состав зеленого пигмента
растений — хлорофилла. В основе
структуры витамина B12 лежит
макроцикл, состоящий из четырех частично
гидрированных пиррольных ядер, в котором
атомы азота образуют координационный
комплекс с атомом кобальта и цианид-ионом.
Важнейшим производным фурана
является фурфурол —
бесцветная или слегка желтоватая
маслянистая жидкость (т. кип. 162 с), имеющая
приятный запах свежеиспеченного ржаного
хлеба. впервые был выделен из отрубей.
Нитрование фурфурола проводят
концентрированной азотной кислотой в
среде уксусного ангидрида. в процессе
реакции получают ацилаль —
5-нитрофурфуролдиацетат, который при
гидролизе в присутствии разведенной
серной кислоты образует 5-нитрофурфурол
- исходное вещество для синтеза ряда
лекарственных препаратов. Так, при
взаимодействии 5-нитрофурфурола с
семикарбазидом образуется семикарбазон
5-нитрофурфурола, который применяется
в медицине под названием «фурацилин».
Представителями группы лекарственных
препаратов нитрофуранового ряда являются
также фурадонин и фуразолидон. Препараты
нитрофуранового ряда обладают высокой
антибактериальной активностью. Они
находят широкое применение в медицине
для лечения гнойных и воспалительных
процессов. Особенно ценным свойством
этих препаратов является их способность
в ряде случаев проявлять эффект против
форм возбудителей, устойчивых к
сульфаниламидам и антибиотикам.
Молекула индола (бензо[b]пиррола)
представляет собой конденсированную
гетероциклическую систему, состоящую
из пиррольного и бензольного колец.
Нумерацию атомов в индоле начинают с
гетероатома, атомы углерода в пиррольном
цикле обозначают также буквами α и β.
Индол — бесцветное кристаллическое
вещество (т. пл. 52с), имеющее своеобразный
неприятный запах; хорошо растворим в
этаноле, эфире и толуоле, практически
не растворим в воде. В малых концентрациях
индол обладает приятным цветочным
запахом. По химическим свойствам он
напоминает пиррол. В реакциях
электрофильного замещения в молекуле
индола более реакционноспособным
является гетероциклическое кольцо, но
в отличие от пиррола заместитель
направляется в β-положение. Это можно
объяснить тем, что образование σ-комплекса
по β-положению является для индола более
выгодным процессом (в сравнении с
α-положением), поскольку в этом случае
положительный заряд может быть
делокализован без нарушения ароматической
системы бензольного ядра. В результате
электрофильной атаки α-положения
образуется σ-комплекс, в котором
делокализация положительного заряда
может быть осуществлена только с
нарушением ароматической системы
бензольного кольца, что энергетически
для молекулы не выгодно. Если β-положение
занято, то электрофильное замещение
протекает по α-положению. Индоксил -
желтое кристаллическое вещество с
сильным фенольным запахом (т. пл. 85),
растворяется в воде, спиртах, ацетоне,
эфире и бензоле. В промышленности
получают взаимодействием анилина с
натриевой солью хлоруксусной
кислоты. Индоксил легко
вступает в реакции, характерные для
карбонильных соединений и фенолов. В
щелочной среде индоксил легко окисляется
кислородом воздуха, образуя синий
краситель — индиго. L-триптофан является
незаменимой аминокислотой, входящей в
состав белков. Серотонин [5-гидрокси-3-(β-аминоэтил)индол],
кристаллическое вещество (т. пл. 207—212),
растворимое в воде, нерастворимое в
органических растворителях. серотонин
является биогенным амином, который
играет важную роль в процессах
жизнедеятельности организма, принимает
участие в передаче нервных импульсов,
вызывает сокращение гладкой мускулатуры
внутренних органов и сужение кровеносных
сосудов, повышает стойкость капилляров
и количество тромбоцитов в крови. В
организме образуется из триптофана. С
нарушением обмена серотонина связывают
появление симптомов шизофрении.
Применяется в медицине в виде соли с
адипиновой кислотой как антигеморрагическое
средство. β-Индолилуксусная кислота (гетероауксин)
- кристаллическое вещество (т. пл.
168—169), растворимое в воде и этиловом
спирте. Гетероауксин является продуктом
окислительного дезаминирования
триптофана. Он оказывает стимулирующее
влияние на рост растений (гормон роста)
и широко применяется в сельском хозяйстве.
На основе индолилуксусной кислоты
создан лекарственный препарат —
индометацин, обладающий сильным
противовоспалительным действием.
Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
По химическому строению пиридин (Азин) можно рассматривать как аналог бензола, в молекуле которого группа —СН= замещена атомом азота. Азинами называют шестичленные гетероароматические азотсодержащие соединения, которые содержат в цикле хотя бы один пиридиновый атом азота, а также би- и полициклические системы на основе азинового цикла. Пиридин — бесцветная жидкость с характерным неприятным запахом (т. кип. 115), смешивающаяся с водой, этанолом и большинством органических растворителей. Является гетероароматическим соединением, содержащим циклическую шести-π-электронную сопряженную систему. Неподеленная пара электронов атома азота не участвует в образовании ароматического секстета и обусловливает основные свойства пиридина. в отличие от бензола, в молекуле пиридина электронная плотность распределена неравномерно. Пиридин является π-дефицитной гетероароматической системой. Влияние атома азота на электронную плотность пиридинового ядра сравнимо с влиянием нитрогруппы на бензольное кольцо в молекуле нитробензола. Пиридин является слабым основанием. Основность пиридина (рKвн+ = 5,25) близка к основности анилина (рKвн+ = 4,6). Водные растворы пиридина окрашивают красную лакмусовую бумагу в синий цвет. При взаимодействии с сильными минеральными и органическими кислотами (хлороводородная, бромоводородная, серная, пикриновая и др.) пиридин образует хорошо кристаллизующиеся пиридиниевые соли:
 Реакции электрофильного замещения
в пиридиновом цикле протекают лишь в
жестких условиях. Так, нитрование
осуществляется с низким выходом при
нагревании пиридина с калия нитратом
в дымящей серной кислоте при 300С,
сульфирование — при нагревании с олеумом
(220—270С) в присутствии катализатора —
ртути (ІІ) сульфата, бромирование —
возможно при действии брома в олеуме.
Электрофильный реагент направляется
в β-положение цикла:
Реакции электрофильного замещения
в пиридиновом цикле протекают лишь в
жестких условиях. Так, нитрование
осуществляется с низким выходом при
нагревании пиридина с калия нитратом
в дымящей серной кислоте при 300С,
сульфирование — при нагревании с олеумом
(220—270С) в присутствии катализатора —
ртути (ІІ) сульфата, бромирование —
возможно при действии брома в олеуме.
Электрофильный реагент направляется
в β-положение цикла:
 Реакции
алкилирования и ацилирования по
Фриделю—Крафтсу для пиридина не
характерны. Низкая реакционная способность
пиридинового цикла в реакциях
электрофильного замещения и ориентация
замещения в β-положение обусловлена
электроноакцепторными свойствами
гетероатома (–I, –M-эффекты), который,
снижая электронную плотность на всех
атомах углерода цикла, в меньшей степени
оказывает влияние на β-положение, что
и предопределяет место атаки электрофильным
реагентом. Кроме того, в реакциях с
протонными реагентами (нитрование,
сульфирование) пиридин образует по
гетероатому соли пиридиния, а с галогенами
— донорно-акцепторные комплексы, в
которых на атоме азота появляется
положительный заряд, а это, в свою
очередь, приводит к еще большей
дезактивации пиридинового
цикла. Пиридин-N-оксид,
в отличие от пиридина, более активен в
реакциях электрофильного замещения.
Это обусловлено некоторым электронодонорным
эффектом атома кислорода. на атомах
углерода в α- и γ-положениях молекулы
пиридин-N-оксида в результате смещения
электронной плотности от атома кислорода
в кольцо электронная плотность повышена
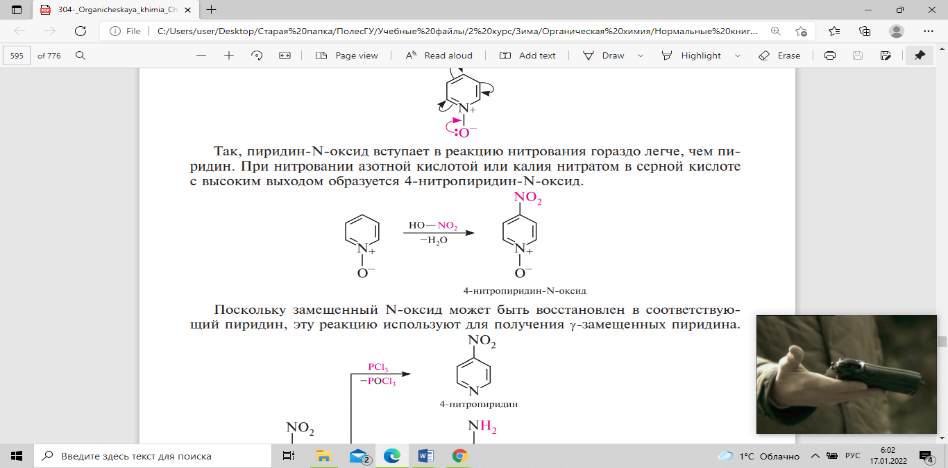
в сравнении с пиридином. Так, пиридин-N-оксид
вступает в реакцию нитрования гораздо
легче, чем пиридин. При нитровании
азотной кислотой или калия нитратом в
серной кислоте с высоким выходом
образуется 4-нитропиридин-N-оксид.
Реакции
алкилирования и ацилирования по
Фриделю—Крафтсу для пиридина не
характерны. Низкая реакционная способность
пиридинового цикла в реакциях
электрофильного замещения и ориентация
замещения в β-положение обусловлена
электроноакцепторными свойствами
гетероатома (–I, –M-эффекты), который,
снижая электронную плотность на всех
атомах углерода цикла, в меньшей степени
оказывает влияние на β-положение, что
и предопределяет место атаки электрофильным
реагентом. Кроме того, в реакциях с
протонными реагентами (нитрование,
сульфирование) пиридин образует по
гетероатому соли пиридиния, а с галогенами
— донорно-акцепторные комплексы, в
которых на атоме азота появляется
положительный заряд, а это, в свою
очередь, приводит к еще большей
дезактивации пиридинового
цикла. Пиридин-N-оксид,
в отличие от пиридина, более активен в
реакциях электрофильного замещения.
Это обусловлено некоторым электронодонорным
эффектом атома кислорода. на атомах
углерода в α- и γ-положениях молекулы
пиридин-N-оксида в результате смещения
электронной плотности от атома кислорода
в кольцо электронная плотность повышена
в сравнении с пиридином. Так, пиридин-N-оксид
вступает в реакцию нитрования гораздо
легче, чем пиридин. При нитровании
азотной кислотой или калия нитратом в
серной кислоте с высоким выходом
образуется 4-нитропиридин-N-оксид.
 Многие
производные гидроксипиридинов применяются
в медицине. Представителем этой группы
соединений является пиридоксин
(витамин В6),
содержится в неочищенных зернах злаков,
в овощах, мясе, рыбе, молоке, яичном
желтке и др, играет важную роль в обмене
веществ. В организме пиридоксин
превращается в пиридоксаль-5-фосфат,
который с некоторыми белками образует
пиридоксалевые ферменты, осуществляющие
декарбоксилирование и переаминирование
аминокислот. Применяется пиридоксин в
виде соли с хлороводородной кислотой
при в6-гиповитаминозе, токсикозах,
анемиях, лейкопениях и заболеваниях
нервной системы. Пиридинкарбоновые
кислоты находят широкое применение в
синтезе ЛС. Так, никотиновая кислота и
ее амид (никотинамид) известны в
медицинской практике как две формы
витамина РР (кислота является провитамином,
а амид — витамином РР). При недостатке
витамина РР в организме развивается
заболевание кожи — пеллагра. суточная
потребность человека в никотиновой
кислоте составляет 20—30 мг и удовлетворяется
в основном за счет пищевых продуктов —
молока, рыбы, овощей, фруктов, гречневой
крупы и др. На основе производных
изоникотиновой кислоты созданы
лекарственные препараты (изониазид,
фтивазид), которые применяют при лечении
туберкулеза. Хинолин (бензо[b]пиридин)
представляет собой конденсированную
гетероциклическую систему, состоящую
из пиридинового и бензольного колец.
Бесцветная жидкость с весьма неприятным
запахом (т. кип. 237), хорошо смешивается
с водой, этанолом, диэтиловым эфиром и
другими органическими растворителями,
перегоняется с водяным паром. Молекула
имеет плоское строение и содержит
замкнутую сопряженную π-электронную
систему из 10 π-электронов, что соответствует
правилу Хюккеля. По химическим свойствам
хинолин напоминает пиридин. Как основание
хинолин немного слабее пиридина (рKвн+
хинолина — 4,94; рKвн+ пиридина в H2O —
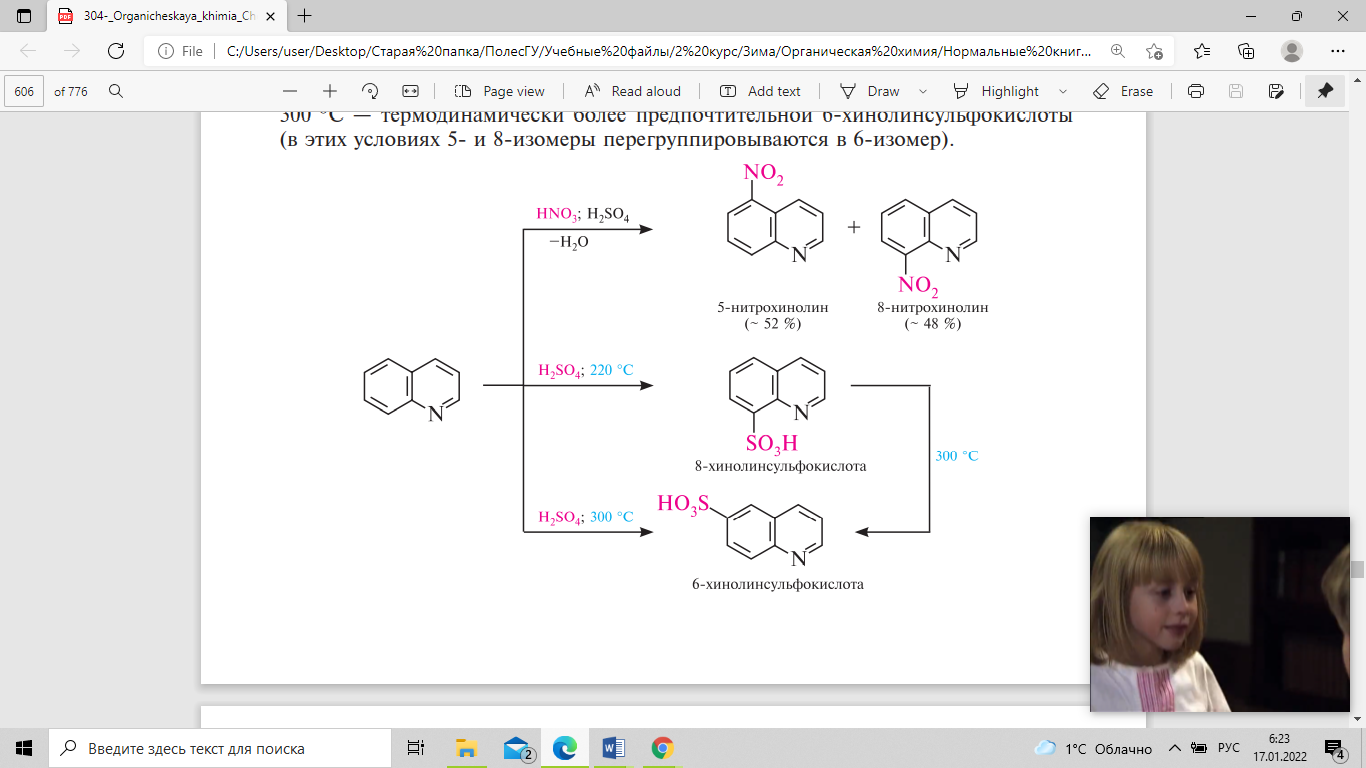
5,25). Реакции электрофильного замещения
в молекуле хинолина протекают
преимущественно в положениях 5 и 8. Так,
при нитровании нитрующей смесью
образуется смесь 5- и 8-нитрохинолинов,
сульфирование концентрированной серной
кислотой при 220С приводит к образованию
8-хинолинсульфокислоты, а при 300С —
термодинамически более предпочтительной
6-хинолинсульфокислоты (в этих условиях
5- и 8-изомеры перегруппировываются в
6-изомер).
Многие
производные гидроксипиридинов применяются
в медицине. Представителем этой группы
соединений является пиридоксин
(витамин В6),
содержится в неочищенных зернах злаков,
в овощах, мясе, рыбе, молоке, яичном
желтке и др, играет важную роль в обмене
веществ. В организме пиридоксин
превращается в пиридоксаль-5-фосфат,
который с некоторыми белками образует
пиридоксалевые ферменты, осуществляющие
декарбоксилирование и переаминирование
аминокислот. Применяется пиридоксин в
виде соли с хлороводородной кислотой
при в6-гиповитаминозе, токсикозах,
анемиях, лейкопениях и заболеваниях
нервной системы. Пиридинкарбоновые
кислоты находят широкое применение в
синтезе ЛС. Так, никотиновая кислота и
ее амид (никотинамид) известны в
медицинской практике как две формы
витамина РР (кислота является провитамином,
а амид — витамином РР). При недостатке
витамина РР в организме развивается
заболевание кожи — пеллагра. суточная
потребность человека в никотиновой
кислоте составляет 20—30 мг и удовлетворяется
в основном за счет пищевых продуктов —
молока, рыбы, овощей, фруктов, гречневой
крупы и др. На основе производных
изоникотиновой кислоты созданы
лекарственные препараты (изониазид,
фтивазид), которые применяют при лечении
туберкулеза. Хинолин (бензо[b]пиридин)
представляет собой конденсированную
гетероциклическую систему, состоящую
из пиридинового и бензольного колец.
Бесцветная жидкость с весьма неприятным
запахом (т. кип. 237), хорошо смешивается
с водой, этанолом, диэтиловым эфиром и
другими органическими растворителями,
перегоняется с водяным паром. Молекула
имеет плоское строение и содержит
замкнутую сопряженную π-электронную
систему из 10 π-электронов, что соответствует
правилу Хюккеля. По химическим свойствам
хинолин напоминает пиридин. Как основание
хинолин немного слабее пиридина (рKвн+
хинолина — 4,94; рKвн+ пиридина в H2O —
5,25). Реакции электрофильного замещения
в молекуле хинолина протекают
преимущественно в положениях 5 и 8. Так,
при нитровании нитрующей смесью
образуется смесь 5- и 8-нитрохинолинов,
сульфирование концентрированной серной
кислотой при 220С приводит к образованию
8-хинолинсульфокислоты, а при 300С —
термодинамически более предпочтительной
6-хинолинсульфокислоты (в этих условиях
5- и 8-изомеры перегруппировываются в
6-изомер).
 8-гидроксихинолин
образует малорастворимые в воде комплексы
(хелаты). Ряд производных 8-гидроксихинолина
применяют в медицинской практике в
качестве противомикробных средств
(хинозол, нитроксолин (5-нок) и
др.). Изохинолин (бензо[c]пиридин)
является изомером хинолина. Молекула
изохинолина, как и хинолина, состоит из
конденсированных пиридинового и
бензольного циклов, но, в отличие от
хинолина, циклы соединены по связи
С-3—C-4 пиридинового кольца. Изохинолин
— бесцветное кристаллическое вещество
(т. пл. 24,6), растворимое в воде, этаноле,
диэтиловом эфире, хлороформе и бензоле.
По химическим свойствам изохинолин
мало отличается от хинолина.за счет
гетероатома изохинолин проявляет
основные и нуклеофильные свойства и
легко образует соли с кислотами, алкил-
и ацилгалогенидами. Как основание
изохинолин немного сильнее хинолина
(рKвн+ изохинолина в Н2О — 5,14; рKвн+ хинолина
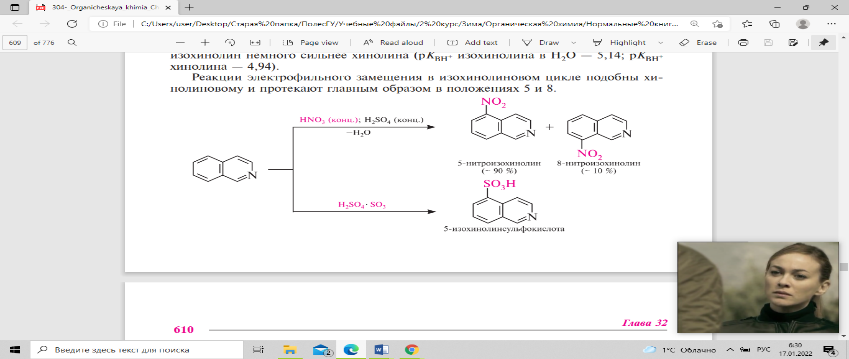
— 4,94). Реакции электрофильного замещения
в изохинолиновом цикле подобны
хинолиновому и протекают главным образом
в положениях 5 и 8.
8-гидроксихинолин
образует малорастворимые в воде комплексы
(хелаты). Ряд производных 8-гидроксихинолина
применяют в медицинской практике в
качестве противомикробных средств
(хинозол, нитроксолин (5-нок) и
др.). Изохинолин (бензо[c]пиридин)
является изомером хинолина. Молекула
изохинолина, как и хинолина, состоит из
конденсированных пиридинового и
бензольного циклов, но, в отличие от
хинолина, циклы соединены по связи
С-3—C-4 пиридинового кольца. Изохинолин
— бесцветное кристаллическое вещество
(т. пл. 24,6), растворимое в воде, этаноле,
диэтиловом эфире, хлороформе и бензоле.
По химическим свойствам изохинолин
мало отличается от хинолина.за счет
гетероатома изохинолин проявляет
основные и нуклеофильные свойства и
легко образует соли с кислотами, алкил-
и ацилгалогенидами. Как основание
изохинолин немного сильнее хинолина
(рKвн+ изохинолина в Н2О — 5,14; рKвн+ хинолина
— 4,94). Реакции электрофильного замещения
в изохинолиновом цикле подобны
хинолиновому и протекают главным образом
в положениях 5 и 8.
 Ядро
изохинолина является структурным
фрагментом молекул алкалоидов
изохинолинового ряда — папаверина,
морфина, кодеина и др.
Ядро
изохинолина является структурным
фрагментом молекул алкалоидов
изохинолинового ряда — папаверина,
морфина, кодеина и др.
